Идоза
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
| Идоза | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
(2S,3R,4S,5R)-2,3,4,5,6-пентагидроксигексаналь (D-идоза), (2R,3S,4R,5S)-2,3,4,5,6-пентагидроксигексаналь (L-идоза) |
| Традиционные названия | идоза, идогексоза |
| Хим. формула | C6H12O6 |
| Физические свойства | |
| Состояние | твёрдое, кристаллическое |
| Молярная масса | 180,1559 ± 0,0074 г/моль |
| Плотность | 1,54 г/см³ |
| Классификация | |
| Рег. номер CAS | 2152-76-3 |
| PubChem | 111123 |
| SMILES | |
| ChEBI | 37709 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Идоза — моносахарид, относится к альдогекзозам. В формуле Фишера у D(+)-формы ОН около 2-го и 4-го атома углерода находится слева. То есть, D-идозу можно рассматривать, как диастереомер D-гулозы.
Идоза не образуется в живых организмах, но соответствующая ей уроновая кислота важна, поскольку входит в состав гликозаминогликанов дерматансульфата и гепаринсульфата.
Методы синтеза[править | править код]
D-Идоза образуется изомеризацией D-сорбозы под действием фермента D-ксилоза кетол-изомеразы[1], однако реакционное равновесие существенно сдвинуто в сторону D-сорбозы.
D-Идоза может быть синтезирована конденсацией нитрометана с D-ксилозой, в результате чего образуются два эпимерных дезоксинитроальдита, 1-дезокси-1-нитро-d-идит и 6-дезокси-6-нитро-1-сорбит, которые разделяются кристаллизацией. Гидролиз по Нефу 1-дезокси-1-нитро-d-идита ведет к преобразованию концевой нитрометиленовой группы в альдегидную и, тем самым, образованию D-идозы, выход достигает 68%[1].
D-Идоза также может быть синтезирована из глюкозы через ее взаимодействие с цианидом в условиях реакции Килиани и гидролизом образовавшихся циангидринов до смеси идо- и глюко- гептоновых кислот. Окислительное отщеплнение перйодатом терминальной метилольной группы идо-гептоновой кислоты ведет к образованию D-идуроновой кислоты, которая затем восстанавливается до D-идозы[2].
Циклические формы идозы[править | править код]
| Изомеры D-идозы | ||
|---|---|---|
| Линейная форма | Проекция Хеуорса | |
 |
 α-D-идофураноза |
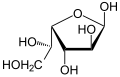 β-D-идофураноза |
 α-D-идопираноза |
 β-D-идопираноза | |
α-D-идофураноза - (2R,3S,4R,5S)-5-[(R)-1,2-дигидроксиэтил)]-оксолан-2,3,4-триол
α-L-идофураноза - (2S,3R,4S,5R)-5-[(S)-1,2-дигидроксиэтил)]-оксолан-2,3,4-триол
β-D-идофураноза - (2S,3S,4R,5S)-5-[(R)-1,2-дигидроксиэтил)]-оксолан-2,3,4-триол
β-L-идофураноза - (2R,3R,4S,5R)-5-[(S)-1,2-дигидроксиэтил)]-оксолан-2,3,4-триол
α-D-идопираноза - (2R,3S,4R,5S,6R)-6-(гидроксиметил)-оксан-2,3,4,5-тетраол
α-L-идопираноза - (2S,3R,4S,5R,6S)-6-(гидроксиметил)-оксан-2,3,4,5-тетраол
β-D-идопираноза - (2S,3S,4R,5S,6R)-6-(гидроксиметил)-оксан-2,3,4,5-тетраол
β-L-идопираноза - (2R,3R,4S,5R,6S)-6-(гидроксиметил)-оксан-2,3,4,5-тетраол
Это заготовка статьи по химии. Помогите Википедии, дополнив её. |
Примечания[править | править код]
- ↑ 1 2 Pastinen, Ossi; Schoemaker, Hans E.; Leisola, Matti (1999–01). "Xylose Isomerase Catalysed Novel Hexose Epimerization". Biocatalysis and Biotransformation. 17 (5): 393—400. doi:10.3109/10242429909015238. ISSN 1024-2422. Дата обращения: 22 сентября 2020.
{{cite journal}}: Википедия:Обслуживание CS1 (формат даты) (ссылка) - ↑ Liu, Zilei; Jenkinson, Sarah F.; Yoshihara, Akihide; Wormald, Mark R.; Izumori, Ken; Fleet, George W. J. (2019-10-18). "d-Idose, d-Iduronic Acid, and d-Idonic Acid from d-Glucose via Seven-Carbon Sugars". Molecules. 24 (20): 3758. doi:10.3390/molecules24203758. ISSN 1420-3049. Архивировано из оригинала 14 февраля 2020. Дата обращения: 22 сентября 2020.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка)
Литература[править | править код]
- Merck Index, 11th Edition,