Фтороводород
| Фтороводород | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Фтороводород | ||
| Традиционные названия | фтористый водород, гидрофторид; водорода фторид | ||
| Хим. формула | HF | ||
| Рац. формула | HF | ||
| Физические свойства | |||
| Состояние | газ или подвижная жидкость | ||
| Молярная масса | 20,01 г/моль | ||
| Плотность | 0,99 г/см³ | ||
| Энергия ионизации | 15,98 ± 0,01 эВ[1] и 16,04 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −83,4 °C | ||
| • кипения | +19,54 °C | ||
| • разложения | разложение заметно при температуре выше +3500 °C | ||
| Критическая точка | 188 | ||
| Энтальпия | |||
| • образования | −273,3 кДж/моль | ||
| Давление пара | 783 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 3,17 | ||
| Растворимость | |||
| • в воде | 72,47 (20 °C) | ||
| Структура | |||
| Дипольный момент | 6,1E−30 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | 7664-39-3 | ||
| PubChem | 14917 и 16211014 | ||
| Рег. номер EINECS | 231-634-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | MW7875000 | ||
| ChEBI | 29228 | ||
| ChemSpider | 14214 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м³ | ||
| ЛД50 | 14,3 мг/кг (крысы, внутривенно) | ||
| Токсичность | Чрезвычайно ядовит, СДЯВ | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фто́роводоро́д (гидрофтори́д, фто́ристый водоро́д, фтори́д водоро́да, плавиковая кислота HF) — бесцветный газ (при стандартных условиях) с резким неприятным запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная летучая жидкость. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF. Токсичен, максимальная ПДКмр.рз = 0,5 мг/м³, среднесменная ПДКсс.рз = 0,1 мг/м³ (в пересчёте на F). Фтористый водород, как элемент микроклимата (компонент воздуха рабочей зоны), в соответствии с ГОСТ 12.1.005-88 относится к I классу опасности (чрезвычайно опасные вещества), фтористый водород безводный (прозрачная жидкость с резким раздражающим запахом, дымящая на воздухе), как химический реактив, в соответствии с ГОСТ 14022-88 относится к II классу опасности (высокоопасные вещества).
Строение молекулы
[править | править код]Молекула фтороводорода сильно полярна, μ = 0,19 Д. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FH приблизительно составляет 41,5 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи термический распад фтороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама — самого тугоплавкого из металлов). Для сравнения — у воды термический распад становится заметным при температурах выше 2000 °C.
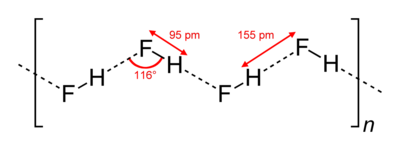
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F•••H) = 155 пм. Аналогичные зигзагообразные цепи с углом HFH = 140° имеют и полимеры HF, существующие в газовой фазе.
Свойства
[править | править код]Физические свойства
[править | править код]- Критическая температура фтористого водорода 188 °C, критическое давление 64 атм.
- Теплота испарения жидкого HF в точке кипения составляет лишь 7,5 кДж/моль (примерно в 6 раз меньше, чем у воды при 20 °C). Это обусловлено тем, что само по себе испарение мало меняет характер ассоциации фтористого водорода (димерная форма, характерная для жидкости, сохраняется и в парах — в отличие от фазового перехода воды).
- Диэлектрическая проницаемость жидкого фтористого водорода (84 при 0 °C) очень близка к значению д.п. для воды.
Химические свойства
[править | править код]- Химические свойства HF зависят от присутствия воды. Сухой фтористый водород не действует на большинство металлов и не реагирует с оксидами металлов. Однако если реакция начнется, то дальше она некоторое время идет с автокатализом, так как в результате взаимодействия количество воды увеличивается:
- Жидкий HF — сильный ионизирующий растворитель. Все электролиты, растворённые в нём, за исключением хлорной кислоты HClO4, являются кислотами:
- В жидком фтороводороде кислотные свойства по Льюису проявляют соединения, которые являются акцепторами фторид-ионов, например, BF3, SbF5:
- Здесь, – кислота Льюиса (акцептор электронов), – основание Льюиса (донор электронов).
- Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III)
- Фтороводород в газообразном состоянии и в виде водного раствора реагирует с диоксидом кремния:
- При условии, если фтороводород в газообразном состоянии:
- При условии, если фтороводород в виде водного раствора:
- Фтороводород неограниченно растворяется в воде, при этом происходит ионизация молекул HF:
-
- Kd= 7,2⋅10−4
-
- Kd= 5,1
-
- Водный раствор фтороводорода (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их труднорастворимо в воде, хорошо растворяются лишь фториды NH4, Na, К, Rb, Cs, Ag(I), Tl(I), Sn(II), Ni(II), Be, Sb(III), Ge(II), Co(II), Mn(II), Mn(III), Cr(III), Zr(IV), Ti(III). Все растворимые соли плавиковой кислоты ядовиты.
Получение
[править | править код]Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в отличие от хлора) в темноте с образованием фтороводорода:
В промышленности фтороводород получают при взаимодействии плавикового шпата и сильных нелетучих кислот (например, серной):
Процесс проводят в стальных печах при 120—300 °C, по сравнению с аналогичными реакциями получения других галогеноводородов, реакция получения фтороводорода из фторидов идет очень медленно. Части установки, служащие для поглощения фтороводорода, делаются из свинца.
Токсикология
[править | править код]Фтористый водород (гидрофторид) обладает резким запахом, очень ядовит, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей. Фтороводород обладает слабыми наркотическими свойствами.
Как и некоторые другие производные фтора, HF высокоопасен в обращении.
Подробнее о токсикологии фтороводорода см в ст. Плавиковая кислота.
Применение
[править | править код]Применяют для получения криолита, фтористых производных урана, фреонов, фторорганических веществ, матового травления силикатного стекла (плавиковую кислоту — для прозрачного травления). Необычная растворимость биологических молекул в жидком фтороводороде без разложения (напр., белков) используется в биохимии. Добавление в жидкий фтороводород акцепторов фтора позволяет создавать сверхкислые среды.
Интересные факты
[править | править код]- Известный писатель-фантаст Иван Ефремов написал повесть «Сердце змеи», в которой описал гипотетическую жизнь, образовавшуюся на планете, где основную роль в природе играет не кислород, а фтор, а вместо воды поверхность планеты покрыта океанами фтороводорода. На эту мысль писателя навела глубокая аналогия между свойствами воды и фтороводорода.
- Фтороводород реагирует со стеклом, поэтому он хранится в пластмассовых ёмкостях. При хранении фтороводорода в стеклянной посуде прибегают к покрытию стекла парафином для защиты его от фтороводорода.
Примечания
[править | править код]- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0334.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
Литература
[править | править код]- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия, 1994.










![{\displaystyle {\mathsf {BF_{3}+2HF\rightarrow H_{2}F^{+}+[BF_{4}]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b7cf222171c2123fb0bb579add63b755167321d)

![{\displaystyle {\mathsf {3NaF+AlF_{3}\rightarrow 3Na^{+}+[AlF_{6}]^{3-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa0a65949ba8547f30c26a0664380fee08dd3321)
![{\displaystyle {\mathsf {AlF_{3}+3BF_{3}\rightarrow Al^{3+}+3[BF_{4}]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/303cbc2236584fcbc85671b5f5e42673e80c1af9)

![{\displaystyle {\mathsf {6HF+SiO_{2}\rightarrow H_{2}[SiF_{6}]+2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d2ea1bd5787e2ee429e823c776390c9b14504e6)



