Антитела
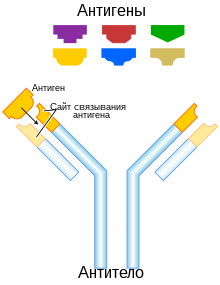
Антитела́, иммуноглобулины — крупные глобулярные белки плазмы крови, выделяющиеся плазматическими клетками иммунной системы и служащие для нейтрализации клеток патогенов (бактерий, грибов, многоклеточных паразитов) и вирусов, а также белковых ядов и некоторых других чужеродных веществ. Каждое антитело распознаёт уникальный элемент патогена, отсутствующий в самом организме, — антиген, а в пределах данного антигена — определённый его участок, эпитоп. Связываясь с антигенами на поверхности патогенов, антитела могут либо непосредственно нейтрализовать их, либо привлекать другие компоненты иммунной системы, такие как система комплемента и фагоциты, чтобы уничтожить чужеродные клетки или вирусные частицы. Антитела — важнейший компонент гуморального специфического иммунитета.
Антитела (иммуноглобулины) образуют белковое суперсемейство. Молекула антитела имеет Y-образную форму, на двух концах молекулы располагаются два одинаковых сайта связывания антигенов, а третий конец бывает одного из нескольких видов, в зависимости от него антитела относят к тому или иному классу. В состав одного антитела в большинстве случаев входят две тяжёлые цепи и две лёгкие цепи. У млекопитающих существует пять типов тяжёлых цепей — α, γ, δ, ε и μ, которым соответствуют пять изотипов (классов) антител — IgA, IgG, IgD, IgE и IgM[1]. Антитела каждого изотипа отличаются от других функциями и особенностями структуры. Колоссальная вариабельность антител обеспечивается перестройками локусов, кодирующих тяжёлые и лёгкие цепи, в ходе V(D)J-рекомбинации.
Образование антител, распознающих нормальные белки организма (аутоантител), составляет основу развития аутоиммунных заболеваний, например, системной красной волчанки, ревматоидного артрита и других. Полное или частичное отсутствие антител приводит к развитию иммунодефицитных состояний.
Строение[править | править код]

Молекулы иммуноглобулинов (антител) имеют форму буквы «Y» и состоят из двух одинаковых легких и двух одинаковых тяжелых полипептидных цепей, соединенных вместе дисульфидными связями. Полипептидные цепи на «верхних» концах «буквы Y» завершаются аминогруппами и являются антигенсвязывающими участками, «ножка» — карбоксильными группами[2].
Известны растворимые и мембранные формы антител. Мембранные антитела встречаются у B-лимфоцитов и называются B-клеточными рецепторами. Растворимые антитела по строению практически идентичны мембранным, различия касаются лишь C-концевой (константной) части. Молекула мономерного иммуноглобулина имеет молекулярную массу 150—170 кДа и состоит из четырёх полипептидных цепей: двух лёгких, или L-цепей (англ. Lite) (масса 50—60 кДа), и двух тяжёлых, или H-цепей (англ. Heavy) (масса 100—120 кДа), которые располагаются симметрично и соединены дисульфидными связями. H- и L-цепи соединены единственной дисульфидной связью, расположенной недалеко от C-конца лёгкой цепи, остальные дисульфидные связи скрепляют H-цепи. В состав лёгких цепей входит два гомологичных сегмента (домена), а в состав тяжёлых — 4—5 доменов. Домены состоят из приблизительно 110 аминокислотных остатков (а. о.) и имеют сходную пространственную структуру, которая стабилизирована одной дисульфидной связью, однако их функции различаются[3]. Эти домены относятся к так называемым иммуноглобулиновым доменам, содержащим характерный структурный мотив, известный как иммуноглобулиновая укладка, представленная двумя β-слоями, которые взаимодействуют друг с другом с помощью дисульфидных связей и электростатических взаимодействий, формируя нечто наподобие сэндвича[4]. Домены взаимодействуют друг с другом посредством гидрофобных взаимодействий[5].

N-концы всех цепей участвуют в распознавании антигена, то есть образуют два одинаковых сайта связывания антигена. Ключевую роль в процессе распознавания антигена играет соответствие структур антигена (точнее, части молекулы антигена — эпитопа) и антигенраспознающего участка антитела, или паратопа по принципу «ключ-замок». Специфичность иммуноглобулинов определяется аминокислотной последовательностью антигенраспознающих доменов, которые называют вариабельными, или V-доменами (их также называют FV-участками). Антигенсвязывающий участок формируется V-доменами тяжёлых и лёгких цепей (VH- и VL-домены соответственно). Его формируют вариабельные петли β-листов, три из которых относятся к VL-доменам, а оставшиеся три — к VH-доменам. Эти петли иногда называют участками, определяющими комплементарность (англ. complementarity-determining regions, CDRs)[6]. CDRs также известны как гипервариабельные участки. В молекуле иммуноглобулина обычно имеется 3 гипервариабельных участка, положение которых в цепи может быть различным. Кроме того, в состав каждого V-домена входит 4 участка относительно постоянного состава (каркасные участки)[7]. Сверхвысокая вариабельность CDRs обеспечивает огромное разнообразие иммуноглобулинов[8].
Остальные домены молекулы иммуноглобулина имеют фиксированную структуру, поэтому их называют константными, или C-доменами. L-цепь содержит один C-домен (обозначается CL), а H-цепь — 3 или 4 домена, которые обозначаются CH1, CH2, CH3, CH4. C-домены не участвуют в распознавании антигенов и необходимы для взаимодействия с рецепторами иммунных клеток, активации системы комплемента и других эффекторных функций[3].
Доля гипервариабельных положений в V-доменах по сравнению с относительно инвариантными невелико и составляет 15—20 % от всех аминокислотных остатков. Кроме того, в эволюции позвоночных животных V-домены оказались более консервативными, чем константные домены, причём их консервативность связана с константными участками. Так, гомология VL-доменов между тигровой и галапагосской акулами составляет около 75 %, а между человеком и собакой — около 50 %[9].
Антитело называют моноспецифичным, если оно может распознавать только один антиген или эпитоп, и биспецифичным, если оно связывается с двумя разными антигенами или двумя разными эпитопами в составе одного антигена[10]. Некоторые антитела называют поливалентными, или неспецифичными, если они распознают несколько антигенов[11].
Под действием протеаз молекулы иммуноглобулинов расщепляются на фрагменты, которые имеют специальные названия. Так, папаин расщепляет молекулу иммуноглобулина на три фрагмента: два фрагмента Fab (от англ. Fragment antigen binding) и один фрагмент Fc (от англ. Fragment cristallizable). В состав фрагментов Fab входят V-домены, а также CL- и CH1-домены, а Fc содержит остальные C-домены и соединяющие их дисульфидные связи. Пепсин разрезает молекулу иммуноглобулина немного иначе и даёт двухвалентный антигенсвязывающий F(ab')2-фрагмент и укороченный Fc'-фрагмент[12].
В области C-доменов находится большая часть участков, взаимодействующих с рецепторами клеток, такими как Fc-рецепторы. Так, в домене Сγ2 расположены участки связывания с компонентом комплемента С4b, а также с рецепторами FcγRI и FcγRII. В домене Сγ3 локализован участок связывания с FcγRIII. Продолжительность пребывания антитела в кровотоке зависит от особенностей строения домена CH2[8]. Между доменами СН1 и СН2 располагается участок, различный по протяжённости в Н-цепях разных изотипов и не входящий в состав доменов. В связи высоким содержанием пролина этот участок обладает высокой гибкостью, поэтому его также называют шарнирным участком. Именно в нём располагаются сайты расщепления иммуноглобулинов протеазами[13].
Молекулы антител подвергаются гликозилированию, то есть являются гликопротеинами. L-цепи лишены стабильных участков гликозилирования, а в Н-цепях они представлены во всех доменах, кроме вариабельного (больше всего их находится в СН2-домене). Сайтов N-гликозилирования в составе антител больше, чем сайтов O-гликозилирования. Углеводная составляющая антител не влияет на их специфичность, однако гликозилирование необходимо для стабилизации функционально важных характеристик молекулы, обеспечивает взаимодействие с лектинами, определяет особенности катаболизма и биологические свойства антител. Углеводные фрагменты в составе антител чаще всего имеют основу из остатков маннозы и хитобиозы[14].
Классы[править | править код]
Тяжёлые и лёгкие цепи существуют в нескольких вариантах, отличающихся структурой и функциями, в связи с чем антитела делят на классы, или изотипы. Выделяют два типа L цепей (κ и λ) и пять изотипов H-цепей (μ, γ, α, δ и ε). В состав одной молекулы иммуноглобулина могут входить только H-цепи одного вида. У млекопитающих существует пять основных типов антител: IgM, IgG, IgA, IgD и IgE (латинские буквы в названиях классов антител соответствуют греческим в обозначении изотипов Н-цепей). Иммуноглобулины классов IgG и IgA разделяют на подклассы (субтипы), также в зависимости от особенностей Н-цепей. Иммуноглобулины всех классов могут принадлежать к К- и L-типам в зависимости от присутствия в их составе L-цепей κ- или λ-типов соответственно[15]. Разные изотипы H-цепей имеют отличающееся количество C-доменов: γ-, α- и δ-цепи имеют по 3 C-домена, а в состав μ- и ε-цепей входит по 4 C-домена[8]. Классы антител также различаются степенью гликозилирования, в частности, наименее гликозилированы антитела класса IgG[14].
Основные свойства классов антител перечислены в таблице ниже[15].
| Свойство | IgM | IgG | IgA | IgD | IgE |
|---|---|---|---|---|---|
| Молекулярная масса, кДа | 950 | 150; субтип IgG3 — 165 | 150; димер — 300 | 185 | 190 |
| Количество мономеров | 5 | 1 | 1 или 2 | 1 | 1 |
| Валентность | 5 | 2 | 2 или 4 | 2 | 2 |
| Изотип H-цепи | μ | γ | α | δ | ε |
| Количество C-доменов в H-цепи | 4 | 3 | 3 | 3 | 4 |
| Количество дисульфидных связей между H-цепями | 4 | 3—12 | 4 или 5 | 1 | 3 |
| Содержание в сыворотке, мг/мл | 1,5 | 13—14 | 3,5 | 0,03 | 0,00002—0,0005 |
| Время полужизни, сут | 5—10 | 23 (IgG3 — 7) | 6 | 3 | 2 |
| Клетки, связывающие антитело через Fc-рецепторы | — | Макрофаги, моноциты, нейтрофилы | Макрофаги, моноциты, нейтрофилы (слабо) | — | Тучные клетки, базофилы |
| Функции | Мембранный рецептор, первичный иммунный ответ | Вторичный иммунный ответ, защита от бактерий и вирусов | Преобладают в секретах слизистых оболочек | Мембранный рецептор | Реагины, защита от паразитов |

Помимо перечисленных выше классов антител млекопитающих, у некоторых позвоночных животных имеются другие классы антител. Например, у костных рыб имеется особый класс антител IgT/Z, а у амфибий, рептилий и птиц имеются иммуноглобулины Y (IgY), которые состоят из двух тяжёлых и двух лёгких цепей и в больших количествах накапливаются в яичном желтке[16]. У хрящевых рыб и млекопитающих семейства верблюдовых имеются антитела из тяжёлых цепей, лишённые лёгких цепей. Считается, что антитела из тяжёлых цепей хрящевых рыб и верблюдовых — результат конвергентной эволюции, и они появились в связи с функциональными особенностями. Около 50 % антител верблюдов и близких видов составляют типичные для млекопитающих антитела из четырёх цепей. Существуют ли животные, обладающие только антителами из тяжёлых цепей, неизвестно[17].
Функции[править | править код]
К основным функциям антител в иммунной системе можно отнести:
- нейтрализацию, в ходе которой нейтрализующие антитела блокируют часть поверхности бактериальной клетки или вириона и делают их неактивными;
- агглютинацию, при которой антитела «склеивают» чужеродные клетки в комки, которые уничтожаются путём фагоцитоза;
- преципитацию, в ходе которой антитела собирают растворимые в плазме крови антигены в скопления, выпадающие в осадок, подвергающийся фагоцитозу;
- активацию комплемента, при которой антитела присоединяются к поверхности патогенной клетки, благодаря чему её могут атаковать компоненты системы комплемента, вызвать её лизис и запустить воспаление[18].
Антитела, которые связываются с поверхностью чужеродной клетки, активируют первый компонент каскада комплемента с помощью своих Fc-участков; такой способ активации комплемента получил название классического пути активации комплемента[19]. В результате клетка, покрытая антителами, может погибнуть двумя способами. Во-первых, связывание антител и компонентов комплемента с поверхностью клетки помечает её как мишень для уничтожения фагоцитами, которые привлекаются к клетке некоторыми компонентами каскада комплемента. Во-вторых, компоненты комплемента формируют мембраноатакующий комплекс на поверхности клетки, который вызывает её гибель в результате лизиса[20].

Чтобы противодействовать размножению внеклеточных патогенов, антитела «склеивают» патогенные клетки вместе, вызывая их агглютинацию[21]. Поскольку минимальная валентность (то есть число одновременно связанных антигенов) антитела равна двум, оно может связать две молекулы антигена, расположенные на разных клетках, и тем самым соединить их. Покрывая поверхность патогена, антитела привлекают к нему эффекторные иммунные клетки с помощью Fc-участков. Клетки, которые распознают Fc-участки антител, имеют специальные Fc-рецепторы (FcR), которые могут связываться с Fc-участками IgA, IgG и IgE. Связывание Fc-рецептора клетки с антителом активирует её, что у фагоцитов проявляется в запуске фагоцитоза, у тучных клеток и нейтрофилов — дегрануляции, натуральных киллеров — высвобождении цитокинов и цитотоксических молекул, что в конце концов приводит к уничтожению микроорганизма. Активация натуральных киллеров антителами запускает механизм, известный как зависимая от антител клеточная цитотоксичность (англ. antibody-dependent cell-mediated cytotoxicity, ADCC). Этот механизм может объяснить эффективность моноклональных антител в лечении рака. Поскольку Fc-рецепторы специфичны только к антителам определённого изотипа, иммунная система обладает достаточной гибкостью, чтобы запускать определённый вид иммунного ответа на данного патогена[22].
У человека и высших приматов в плазме крови постоянно присутствуют так называемые натуральные антитела, которые образуются без предшествующей инфекции, вакцинации или иного воздействия. Благодаря этим антителам система комплемента может запускать лизис клеток микроорганизмов и вирионов оболочечных вирусов без предшествующей активации адаптивного иммунитета. Многие натуральные антитела специфичны к дисахариду галактозе-α(1,3)-галактозе (α-Gal), который является концевым сахаром гликозилированных белков поверхности клетки. Выработка этих антител запускается в ответ на синтез α-Gal симбиотическими кишечными бактериями[23]. Отторжение ксенотрансплантата отчасти можно объяснить действием натуральных антител реципиента, атакующих α-Gal в составе белков трансплантата[24].
Активированные B-клетки претерпевают дифференцировку в плазматические клетки, способные секретировать антитела, или B-клетки памяти, которые сохраняются в организме в течение долгого времени и хранят память об антигенах, с которыми организм ранее сталкивался[18]. В пренетальном и неонатальном периодах антитела поступают в организм младенца от матери. Начало выработки собственных антител различается в разных классах антител и обычно происходит в течение первых лет жизни[19].
Помимо перечисленных выше функций в иммунной системе, антитела могут выполнять и другие, неканонические роли. У некоторых антител композиция аминокислотных остатков в сайте связывания антигена очень близка к таковой в активном центре некоторых ферментов, поэтому антитела могут катализировать некоторые химические реакции. Антитела, обладающие каталитической активностью, называют абзимами. Показано, что синтез антител с различной каталитической активностью начинается при иммунизации промежуточными соединениями соответствующих реакций. Однако по каталитической активности абзимы сильно уступают «истинным» ферментам. У человека как в норме, так и при патологии нередко детектируются антитела с протеолитической активностью, которые расщепляют молекулы, специфичные для патогенов. Протеолитические антитела относятся к классам IgG, IgA и IgM. Некоторые антитела классов IgM и IgG могут убивать клетки микрорганизмов в одиночку без участия других эффекторных механизмов, однако механизм их действия известен лишь в нескольких случаях. В частности, показано, что инактивирующие моноклональные антитела IgM и IgG вызывают изменения экспрессии генов и метаболизма у патогенного гриба Cryptococcus neoformans при связывании с поверхностью его клеток. Связывание антител с поверхностью болезнетворной бактерии Borrelia burgdorferi вызывает формирование пор и гибель клетки в результате осмотического шока. Иногда разные антитела инактивируют патогена за счёт синергического действия без участия дополнительных эффекторных путей. Особые неканонические функции описаны у антител класса IgA. Так, они могут опосредовать трансэпителиальный транспорт бактерий в кишечнике у мышей и регулировать проникновение бактериальных метаболитов в клетки хозяина. Кроме того, антитела могут работать как шапероны и переносчики разнообразных соединений и в здоровом организме[25].
Разнообразие[править | править код]
Практически все микроорганизмы могут вызывать иммунный ответ. Для успешного распознавания и уничтожения патогенов необходимо большое разнообразие антител, распознающих разные антигены[26]. По некоторым оценкам, в организме человека образуется 10 млрд различных антител, каждое из которых распознаёт уникальный эпитоп[27]. Хотя в каждой особи образуется огромное количество антител, количество генов, которые их кодируют, ограничено размером генома. Существует несколько механизмов, которые дают возможность позвоночным животным получать огромное число различных антител с относительно небольшого количества генов[28].
Вариабельность доменов[править | править код]
Участки, кодирующие компоненты антител, у человека располагаются на нескольких хромосомах. На хромосоме 14 собраны гены, кодирующие варианты тяжёлой цепи, лёгкие цепи κ и λ закодированы на хромосомах 22 и 2. Вариабельные домены, образованные участками как лёгкой, так и тяжёлой цепей, отличаются между антителами, образованными разными плазматическими клетками. Различия между вариабельными доменами затрагивают три петли, известные как гипервариабельные участки (HV-1, HV-2 and HV-3) или участки, определяющие комплементарность (CDR1, CDR2 и CDR3). Локус тяжёлых цепей кодирует 65 вариабельных доменов с разными CDRs. Комбинация каждого из этих вариантов в пределах линейно расположенных генов, кодирующих другие домены тяжёлой цепи, обеспечивает огромное разнообразие антител. Эта комбинация происходит в результате V(D)J-рекомбинации, механизм которой описан ниже[29].
V(D)J-рекомбинация[править | править код]

В ходе процесса V(D)J-рекомбинации формируется уникальный участок ДНК, кодирующий вариабельный домен. Вариабельный участок тяжёлой или лёгкой цепи кодируется локусом, разбитым на несколько фрагментов — субгенов, которые обозначаются V (от англ. variable), D (от англ. diversity) и J (от англ. joining)[28]. Субгены V, D и J кодируют вариабельный участок тяжёлой цепи, в то время как вариабельный участок лёгкой цепи кодируют субгены V и J. Каждый субген представлен несколькими вариантами, тандемно расположенными друг за другом на хромосоме. В костном мозге при созревании B-клетки в её локусах, кодирующих вариабельные домены, происходят перестройки, в результате которых в составе локуса остаётся по одному варианту субгенов V, D и J, а остальные варианты навсегда удаляются из генома. Поскольку каждый субген присутствует в нескольких вариантах, их комбинации будут давать антитела с разной специфичностью к антигенам. Важную роль в V(D)J-рекомбинации играют белки RAG, которые вносят разрывы в определённые участки, и в их отсутствие V(D)J-рекомбинация невозможна[30]. После того, как в ходе созревания в геноме B-клетки для тяжёлой и лёгкой цепей появился один функциональный ген, кодирующий вариабельный домен, остальные локусы, кодирующие вариабельные домены, перестают экспрессироваться (аллельное исключение), так что каждая B-клетка может производить антитела только с одним вариабельным доменом[22][31].
Соматическая гипермутация[править | править код]
После активации антигеном B-клетки начинают интенсивно пролиферировать. Параллельно частым делениям в локусах, кодирующих гипервариабельные домены тяжёлой и лёгкой цепей, наблюдается повышенная частота точечных мутаций. Этот процесс называется соматической гипермутацией. Соматическая гипермутация происходит с частотой примерно в один мутировавший нуклеотид вариабельного домена на клеточное деление[32]. В результате этого процесса дочерние клетки, появляющиеся в результате деления, будут продуцировать антитела с немного отличающимися вариабельными доменами. Таким образом, соматическая гипермутация служит ещё одним механизмом повышения разнообразия антител и оказывает влияние на сродство антител к антигену[33]. Некоторые мутации понижают сродство антитела к некоторому антигену, а другие, напротив, повышают[34]. Те B-клетки, которые экспрессируют антитела с высоким сродством к антигену, в ходе взаимодействия с другими клетками получают сильные сигналы, способствующие выживанию, и не подвергаются апоптозу. По этой причине B-клетки, кодирующие антитела с высоким сродством к антигену, будут иметь конкурентное преимущество перед B-клетками, кодирующими антитела с меньшим сродством, и сродство к антигену с каждым делением B-клеток будет повышаться. Постепенное повышение сродства к антигену и отбор B-клеток с лучшим сродством происходит при участии T-хелперов уже после V(D)J-рекомбинации[35].
Переключение классов[править | править код]

Переключение классов антител происходит после активации B-клетки и позволяет ей производить антитела разных классов (IgA, IgE или IgG)[30]. Различия между антителами разных классов связаны с C-доменами тяжёлой цепи. Сначала наивные B-клетки производят только поверхностные иммуноглобулины IgM или IgD с одинаковой антигенной специфичностью. Поскольку каждый изотип связан со специфической функцией, после активации плазматическая клетка должна производить антитела IgG, IgA или IgE, чтобы эффективно противодействовать патогену. Благодаря переключению классов разные дочерние клетки, происходящие от одной и той же B-клетки, могут производить антитела разных изотипов. В ходе переключения классов изменения происходят лишь в C-доменах тяжёлой цепи. Поэтому потомки одной B-клетки могут производить антитела разных классов, но с одинаковой антигенной специфичностью. Переключение классов происходит под действием некоторых цитокинов[36].
В ходе переключения классов происходят перестройки в локусе, кодирующем тяжёлые цепи. Для прохождения процесса необходимы консервативные нуклеотидные мотивы, известные как S-участки (от англ. switch), которые находятся выше каждого локуса, кодирующего тяжёлые цепи (исключение составляют лишь δ-типы). Далее специальные ферменты вносят два разрыва в ДНК по двум S-участкам[37][38]. В результате фрагмент между двумя разрывами удаляется, двуцепочечный разрыв в константном участке репарируется с помощью негомологичного соединения концов[39].
Образование и секреция[править | править код]
Антитела выделяет особая разновидность B-клеток — плазматические клетки. Как и большинство секретируемых белков, тяжёлые и лёгкие цепи иммуноглобулинов синтезируются рибосомами, находящимися на шероховатом эндоплазматическом ретикулуме (ЭПР). В ходе синтеза образующаяся полипептидная цепь поступает в люмен ЭПР, где подвергается гликозилированию. Правильная укладка тяжёлых цепей и связывание с лёгкими цепями с образованием антитела регулируются шаперонами ЭПР, такими как кальнексин и BiP. Они связываются с новосинтезированными иммуноглобулиновыми полипептидами и защищают их от разрушения, пока они принимают правильную структуру. Также в люмене ЭПР происходит сборка антитела за счёт образования дисульфидных связей между тяжёлыми и лёгкими цепями. После сборки молекулы антител освобождаются от шаперонов и поступают в аппарат Гольджи, где их углеводные остатки подвергаются дополнительному процессингу. Везикулы, содержащие зрелые антитела, отпочковываются от аппарата Гольджи и сливаются с клеточной мембраной, после чего мембранные формы антител остаются заякоренными в мембране клетки, а свободные антитела выходят в межклеточное пространство[40].
По мере созревания B-клеток в костном мозге экспрессия иммуноглобулинов претерпевает ряд изменений. Самые ранние клетки B-клеточного ряда, пре-B-клетки, синтезируют только мембранные формы тяжёлых цепей класса μ. Эти цепи формируют комплекс с белками, которые называют суррогатными лёгкими цепями, и формируют пре-B-клеточный рецептор, небольшая доля которого экспонируется на поверхности B-клетки. Незрелые и зрелые B-клетки синтезируют лёгкие цепи классов κ и λ, которые, соединяясь с тяжёлыми цепями класса μ, образуют антитела IgM. Зрелые B-клетки экспрессируют мембранные формы IgM и IgD, которые служат рецепторами, распознающими антигены и запускающими активацию B-клетки. Пре-B-клеточные рецепторы и B-клеточные рецепторы нековалентно связаны с интегринами, сигнальные функции которых необходимы для экспрессии поверхностных форм IgM и IgD[41].
Когда B-клетки активируются антигенами и другими стимулами, они превращаются в плазматические клетки, секретирующие антитела. При переходе к плазматическим клеткам доля секретируемых иммуноглобулинов по сравнению с мембранными резко возрастает. Кроме того, в это же время переходит переключение классов антител, и клетка перестаёт синтезировать IgM и IgD, но начинает выделять IgA, IgE или IgG[42].
Эволюция[править | править код]
Адаптивный иммунитет и антитела в ходе эволюции появились у позвоночных животных примерно 500 миллионов лет назад[43]. Наиболее древними классами антител, вероятно, являются IgM и IgD, причём антитела IgD, которые есть практически у всех позвоночных, даже у хрящевых рыб, считают древнейшим классом антител (антитела IgD хрящевых рыб иногда обозначают IgW; W соответствует греческой букве ω). Однако есть и позвоночные, утратившие IgD, например, птицы и несколько видов млекопитающих. В то же время типичные для млекопитающих классы IgA, IgE и IgG есть не у всех групп позвоночных. В частности, у костных рыб отсутствуют IgA, IgE и IgD, однако имеется дополнительный класс антител IgT (или IgZ), который отсутствует у других позвоночных. Антитела IgT (T соответствует греческой букве τ), вероятно, защищают слизистые оболочки рыб[44]. Необычные классы антител есть и у других позвоночных, например, антитела из тяжёлых цепей у хрящевых рыб и верблюдовых, а также IgY амфибий, рептилий и птиц[16][17].
Предсказание структуры и компьютерный дизайн антител[править | править код]
Для использования антител в медицине и биотехнологиях необходимо знать их структуру с высоким разрешением. Информация о структуре антител широко используется в белковой инженерии антител, модификации их способности к связыванию антигенов и идентификации эпитопов отдельных антител. Одним из методов, широко использующихся для определения структур антител, является рентгеноструктурный анализ, однако кристаллизация антител — это очень долгий и трудоёмкий процесс, поэтому широко распространено предсказание структур антител с помощью вычислительных методов. Однако предсказание не даёт точных сведений о структуре. Компьютерное моделирование структур вариабельных доменов можно производить с помощью программ Web Antibody Modeling (WAM)[45] и Prediction of Immunoglobulin Structure (PIGS)[46]. Предсказание структуры вариабельных доменов также можно производить с помощью сервиса Rosetta, в котором с помощью специальных методов в ходе предсказания минимизируется протяжённость петель, соответствующих CDR, оптимизируется положение лёгких и тяжёлых цепей относительно друг друга и строятся модели, предсказывающие докинг антител с их уникальными антигенами[47]. Существует несколько программ, осуществляющих компьютерный дизайн антител на основании результатов биоинформатического изучения CDR[48][49][50].
Один из наиболее эффективных методов идентификации пептидов и белков, включая антитела, — жидкостная хроматография, связанная с тандемной масс-спектрометрией[51]. Высокопроизводительные методы секвенирования аминокислотных последовательностей антител требуют специальных вычислительных подходов для анализа данных, в том числе для секвенирования de novo из данных масс-спектрометрии[52], а также подходов к поиску по базам данных, содержащих белковые последовательности[53][54]. Особое значение для секвенирования аминокислот имеет метод дробовика, покрытие которого увеличено посредством фрагментации методами CID/HCD/ETD[55]. Существуют методы определения аминокислотных последовательностей, для которых необходимы последовательности похожих белков[56] или известная последовательность генома[57]. Современные методы секвенирования могут производить сборку белковых последовательностей с высокой точностью, сочетая секвенирование пептидов de novo, интенсивность и позиционные доверительные оценки, полученные с помощью поиска гомологов по базам данных[58].
Применение в медицине[править | править код]
Диагностика[править | править код]
Выявление и определение концентрации специфических антител в крови является довольно распространённым методом медицинской диагностики[59]. Например, наличие в организме вируса Эпштейна — Барр или бактерии Borrelia burgdorferi, вызывающей болезнь Лайма, определяется по титру антител против них. Если соответствующие антитела выявить не удалось, то пациент или никогда не сталкивался с этими патогенами, или сталкивался очень давно, и плазматические клетки, продуцирующие антитела против них, уже исчезли[60].
В клинической иммунологии профиль антител пациента характеризуют, определяя концентрации антител разных классов с помощью нефелометрии[61]. Повышение содержания антител некоторых классов может быть полезным для выявления причин повреждений печени, когда установить точный диагноз не удаётся. Так, повышенное содержание IgA свидетельствует об алкогольном циррозе печени, повышение уровня IgM говорит в пользу вирусных гепатитов и первичного цирроза печени, а уровень IgG повышается при вирусных гепатитах, аутоиммунных заболеваниях и циррозе[62].
Развитие аутоиммунных заболеваний связано с образованием антител, распознающих эпитопы самого организма (аутоантител). Их можно выявить с помощью анализа крови. Антитела, действующие против поверхностных антигенов эритроцитов, вызывают гемолитическую анемию и могут быть выявлены с помощью реакции Кумбса. Реакцию Кумбса также проводят при скрининге антител при переливании крови и у беременных женщин[63].
Принцип взаимодействия антигенов и антител используют методы иммунодиагностики, такие как иммуноферментный анализ, иммунофлуоресцентный анализ, вестерн-блот, иммунодиффузия, иммуноэлектрофорез и магнитный иммуноанализ. Мечение антител радиоактивным изотопом фтора 18F позволяет их использовать для визуализации раковых опухолей с помощью позитронно-эмиссионной томографии[64].
Лечение заболеваний[править | править код]
Моноклональные антитела применяют для лечения ревматоидного артрита[65], рассеянного склероза[66], псориаза[67] и многих видов рака, среди которых неходжкинские лимфомы[68], рак толстой кишки, головы и шеи, молочной железы[69].
Многие иммунодефициты, такие как болезнь Брутона и гипогаммаглобулинемия, связаны с полным или частичным отсутствием антител[70]. Пациентам, страдающим от этих заболеваний, с помощью искусственного введения антител обеспечивают пассивный иммунитет[71].
Пренатальная терапия[править | править код]
У человека на эритроцитах присутствует антиген, известный как резус-фактор (Rh). В ходе родов или осложнений при беременности кровь плода может попасть в кровоток матери, и если у ребёнка резус-фактор положительный, а у матери отрицательный, то в организме матери вырабатываются антитела против резус-фактора. При последующих беременностях резус-положительным плодом они могут атаковать его, приводя к гемолитической желтухе новорождённых[72]. Чтобы предотвратить возникновение резус-конфликта, резус-отрицательным женщинам, беременным резус-положительным плодом, искусственно вводят антитела к резус-фактору (Rho(D)-иммуноглобулин). Введение Rho(D)-иммуноглобулина необходимо произвести до того, как резус-фактор плода активирует B-клетки матери и запустит адаптивный иммунный ответ и образование B-клеток памяти[73].
Применение в научных исследованиях[править | править код]

Антитела, специфические к заданному антигену, можно получить, введя антиген в млекопитающее (мышь, крысу, кролика, козу, овцу, лошадь) и затем выделив из него большое количество антител. Кровь, выделенная из иммунизированного животного, содержит поликлональные антитела, то есть несколько разных антител, специфичных к одному и тому же антигену. Поликлональные антитела можно также получить, впрыснув антиген в яичный желток развивающегося куриного яйца[76]. Чтобы получить антитела, распознающие строго определённый эпитоп в составе антигена, плазматические клетки, выделяющие антитела к антигену, выделяют из животного и иммортализируют, сливая их с раковыми клетками. Клетки, полученные при слиянии плазматических клеток с раковыми, называют гибридомами, и они постоянно выделяют нужные антитела, размножаясь в культуре клеток. Из одиночных гибридом получают идентичные антитела, называемые моноклональными[77]. Поликлональные и моноклональные антитела часто очищают с помощью белка A/G или аффинной хроматографии[78].
Очищенные антитела нашли множество применений в исследовательском процессе. Антитела ко многим антигенам можно купить у коммерческих компаний. В исследованиях антитела чаще всего используют для определения локализации клеточных и внеклеточных белков. Их также применяют в проточной цитометрии для разделения клеток по тому, какие белки они экспрессируют[79]. Антитела используют для отделения белков и связанных с ними молекул от остального содержимого клеточного лизата посредством иммунопреципитации[80], для идентификации белков, разделённых гель-электрофорезом, с помощью вестерн-блота[81]. Антитела составляют основу иммунофлуоресценции и иммуногистохимии, с помощью которых изучается экспрессия и локализация интересующих белков в клетках и тканях[79][82]. Антитела можно использовать для детекции и оценки концентрации белков, в частности, с помощью иммуноферментного анализа и метода ELISpot[83][84].
Несмотря на многочисленные применения, работа с антителами довольно трудоёмка, поскольку на результат эксперимента влияют множество факторов, которые необходимо контролировать, в частности, влияющие на степень сродства антитела к антигену pH, растворитель, состояние ткани и другие. Предпринималось множество попыток улучшить способ валидации антител исследователями[85][86]. Исследователи, работающие с антителами, должны тщательно записывать условия экспериментов, чтобы они могли быть воспроизведены другими учёными[87].
Миметики антител[править | править код]

Миметиками антител называют органические соединения, которые, как и антитела, могут специфически связывать антигены. Как правило, миметики антител представляют собой искусственные пептиды массой от 3 до 20 кДа. Иногда в роли миметиков антител выступают нуклеиновые кислоты и малые молекулы, однако ими не могут быть искусственные антитела, фрагменты антител или их ковалентно связанные комбинации. В отличие от антител, их миметики обычно обладают лучшей растворимостью, лучше проникают в ткань и обладают большей стабильностью по отношению к температуре и действию ферментов, кроме того, они дешевле настоящих антител. Некоторые миметики антител, такие как Affimer и DARPin, зарегистрированы для использования в исследовательских, терапевтических и диагностических целях[88].
История изучения[править | править код]

Термин «антитело» (нем. Antikörper) впервые встречается в трудах Пауля Эрлиха. В частности, термин «Antikörper» можно найти в заключении его статьи «Экспериментальное изучение иммунитета», которая вышла в октябре 1891 года. В этой работе утверждается, что «если две субстанции вызывают выделение двух разных Antikörper, то они тоже различны». Тем не менее поначалу термин «Antikörper» не закрепился, и для обозначения антител было предложено несколько других терминов: Immunkörper, Amboceptor, Zwischenkörper, substance sensibilisatrice, copula, Desmon, philocytase, fixateur и Immunisin[89].
Изучение антител началось в 1890 году, когда Китасато Сибасабуро и Эмиль Адольф фон Беринг описали действие антител против дифтерии и столбнячного токсина[90]. Сибасабуро развил теорию гуморального иммунитета и предположил, что в сыворотке крови имеется некий медиатор, способный взаимодействовать с чужеродными антигенами[91]. На основе идей Сибасабуро Пауль Эрлих в 1897 году выдвинул теорию боковых цепей, объясняющую принципы взаимодействия антител и антигенов. Он предположил, что рецепторы («боковые цепи») на поверхности клеток могут специфично взаимодействовать с токсинами по принципу «ключ-замок», и взаимодействие рецептора с токсином запускает выработку антител[92]. Другие исследователи предположили, что антитела свободно перемещаются по кровотоку. В 1904 году Алмрот Райт предположил, что антитела покрывают поверхность бактериальных клеток, направляя их на фагоцитоз и разрушение; этот процесс сейчас известен как опсонизация[93].
В 1920-х годах Майкл Гейдельберг и Освальд Эвери смогли пронаблюдать, что антигены могут уходить в осадок под действием антител, и показали, что антитела имеют белковую природу[94]. Биохимические особенности взаимодействия антитела и антигена были детально изучены в конце 1930-х годов Джоном Марраком[95]. В 1937 году иммуноглобулины как разновидность белков выявлены с помощью гель-электрофореза во фракциях γ- и β-глобулинов сыворотки крови[90]. В 1940-х годах Лайнус Полинг подтвердил гипотезу Эрлиха относительно взаимодействия антигенов и антител по принципу «ключ-замок» и показал, что взаимодействие антитела и антигена в большей степени зависит от пространственной конфигурации антигена , чем от его химического состава[96]. В 1948 году Астрид Фагреус показала, что антитела выделяют плазматические клетки — разновидность B-лимфоцитов[97].
В дальнейшем исследования были сконцентрированы на изучении структуры антител. В начале 1960-х годов Джералд Эдельман и Джозеф Галли описали лёгкую цепь антител[98] и показали, что именно лёгкая цепь является белком Бенс-Джонса, который был описан Генри Бенс Джонсом в 1845 году[99]. В дальнейшем Эдельман показал, что антитела состоят из двух тяжёлых и двух лёгких цепей, скреплённых дисульфидными связями. Примерно в то же время Родни Портер описал Fab- и Fc-участки в составе молекул IgG[100]. Вместе эти исследователи описали структуру и полную аминокислотную последовательность IgG, за что в 1972 году были удостоены Нобелевской премии по физиологии и медицине[100]. Фрагмент Fv был очищен и описан Дэвидом Гиволом[101]. Ранние исследования антител были сконцентрированы на IgG и IgM, и новые изотипы иммуноглобулинов были идентифицированы в 1960-х годах. Томас Томаши описал секретируемые антитела IgA[102], Дэвид Роув и Джон Фей открыли IgD[103], а Кимисиге Исизака и Теруко Исизака открыли IgE и установили, что именно эти антитела задействованы в развитии аллергических реакций[104]. В 1976 году Судзуми Тонегава начал серию экспериментов показал, что гены, кодирующие антитела, претерпевают перестройки, за счёт которых создаётся огромное разнообразие антител[105]. В 1987 году Тонегава получил Нобелевскую премию по физиологии и медицине за открытие механизмов разнообразия антител[106].
В 1970-х годах в результате изучения гомогенных опухолевых антигенов была разработана гибридомная технология, благодаря которой стало возможным получать моноклональные антитела с заданной специфичностью[3].
См. также[править | править код]
Примечания[править | править код]
- ↑ Ройт и др., 2000.
- ↑ Ройт и др., 2000, Иммуноглобулины — особое семейство белков.
- ↑ 1 2 3 Ярилин, 2010, с. 232.
- ↑ Barclay A. N. Membrane proteins with immunoglobulin-like domains--a master superfamily of interaction molecules. (англ.) // Seminars In Immunology. — 2003. — August (vol. 15, no. 4). — P. 215—223. — doi:10.1016/s1044-5323(03)00047-2. — PMID 14690046.
- ↑ Ярилин, 2010, с. 235.
- ↑ Al-Lazikani B., Lesk A. M., Chothia C. Standard conformations for the canonical structures of immunoglobulins. (англ.) // Journal Of Molecular Biology. — 1997. — 7 November (vol. 273, no. 4). — P. 927—948. — doi:10.1006/jmbi.1997.1354. — PMID 9367782.
- ↑ Ярилин, 2010, с. 238.
- ↑ 1 2 3 Ярилин, 2010, с. 239.
- ↑ Галактионов, 2004, с. 61.
- ↑ Spiess C., Zhai Q., Carter P. J. Alternative molecular formats and therapeutic applications for bispecific antibodies. (англ.) // Molecular Immunology. — 2015. — October (vol. 67, no. 2 Pt A). — P. 95—106. — doi:10.1016/j.molimm.2015.01.003. — PMID 25637431.
- ↑ Farlex dictionary > polyvalent. Citing: The American Heritage Medical Dictionary. 2004. Дата обращения: 17 апреля 2020. Архивировано 21 марта 2021 года.
- ↑ Ярилин, 2010, с. 232—233.
- ↑ Ярилин, 2010, с. 239—240.
- ↑ 1 2 Ярилин, 2010, с. 240.
- ↑ 1 2 Ярилин, 2010, с. 234—235.
- ↑ 1 2 Lanzarini N. M., Bentes G. A., Volotão E. M., Pinto M. A. Use of chicken immunoglobulin Y in general virology. (англ.) // Journal Of Immunoassay & Immunochemistry. — 2018. — Vol. 39, no. 3. — P. 235—248. — doi:10.1080/15321819.2018.1500375. — PMID 30044696.
- ↑ 1 2 Nanobodies. Nanobody.org. Дата обращения: 29 мая 2022. Архивировано 16 февраля 2021 года.
- ↑ 1 2 Borghesi L., Milcarek C. From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion. (англ.) // Immunologic Research. — 2006. — Vol. 36, no. 1-3. — P. 27—32. — doi:10.1385/IR:36:1:27. — PMID 17337763.
- ↑ 1 2 Ravetch J. V., Bolland S. IgG Fc receptors. (англ.) // Annual Review Of Immunology. — 2001. — Vol. 19. — P. 275—290. — doi:10.1146/annurev.immunol.19.1.275. — PMID 11244038.
- ↑ Rus H., Cudrici C., Niculescu F. The role of the complement system in innate immunity. (англ.) // Immunologic Research. — 2005. — Vol. 33, no. 2. — P. 103—112. — doi:10.1385/IR:33:2:103. — PMID 16234578.
- ↑ Pier G. B., Lyczak J. B., Wetzler L. M. Immunology, Infection, and Immunity. — ASM Press, 2004. — ISBN 978-1-55581-246-1.
- ↑ 1 2 Murphy, Weaver, 2017, p. 399—445.
- ↑ Racaniello, Vincent. Natural antibody protects against viral infection. Virology Blog (6 октября 2009). Дата обращения: 22 января 2010. Архивировано 20 февраля 2010 года.
- ↑ Milland J., Sandrin M. S. ABO blood group and related antigens, natural antibodies and transplantation. (англ.) // Tissue Antigens. — 2006. — December (vol. 68, no. 6). — P. 459—466. — doi:10.1111/j.1399-0039.2006.00721.x. — PMID 17176435.
- ↑ Dimitrov J. D., Lacroix-Desmazes S. Noncanonical Functions of Antibodies. (англ.) // Trends In Immunology. — 2020. — 6 April. — doi:10.1016/j.it.2020.03.006. — PMID 32273170.
- ↑ Mian I. S., Bradwell A. R., Olson A. J. Structure, function and properties of antibody binding sites. (англ.) // Journal Of Molecular Biology. — 1991. — 5 January (vol. 217, no. 1). — P. 133—151. — doi:10.1016/0022-2836(91)90617-f. — PMID 1988675.
- ↑ Fanning L. J., Connor A. M., Wu G. E. Development of the immunoglobulin repertoire. (англ.) // Clinical Immunology And Immunopathology. — 1996. — April (vol. 79, no. 1). — P. 1—14. — doi:10.1006/clin.1996.0044. — PMID 8612345.
- ↑ 1 2 Nemazee D. Receptor editing in lymphocyte development and central tolerance. (англ.) // Nature Reviews. Immunology. — 2006. — October (vol. 6, no. 10). — P. 728—740. — doi:10.1038/nri1939. — PMID 16998507.
- ↑ Peter Parham. The Immune System. — 2nd ed.. — New York: Garland Science, 2005. — P. 47—62.
- ↑ 1 2 Market E., Papavasiliou F. N. V(D)J recombination and the evolution of the adaptive immune system. (англ.) // PLoS Biology. — 2003. — October (vol. 1, no. 1). — P. 16—16. — doi:10.1371/journal.pbio.0000016. — PMID 14551913.
- ↑ Bergman Y., Cedar H. A stepwise epigenetic process controls immunoglobulin allelic exclusion. (англ.) // Nature Reviews. Immunology. — 2004. — October (vol. 4, no. 10). — P. 753—761. — doi:10.1038/nri1458. — PMID 15459667.
- ↑ Diaz M., Casali P. Somatic immunoglobulin hypermutation. (англ.) // Current Opinion In Immunology. — 2002. — April (vol. 14, no. 2). — P. 235—240. — doi:10.1016/s0952-7915(02)00327-8. — PMID 11869898.
- ↑ Honjo T., Habu S. Origin of immune diversity: genetic variation and selection. (англ.) // Annual Review Of Biochemistry. — 1985. — Vol. 54. — P. 803—830. — doi:10.1146/annurev.bi.54.070185.004103. — PMID 3927822.
- ↑ Or-Guil M., Wittenbrink N., Weiser A. A., Schuchhardt J. Recirculation of germinal center B cells: a multilevel selection strategy for antibody maturation. (англ.) // Immunological Reviews. — 2007. — April (vol. 216). — P. 130—141. — doi:10.1111/j.1600-065X.2007.00507.x. — PMID 17367339.
- ↑ Neuberger M. S., Ehrenstein M. R., Rada C., Sale J., Batista F. D., Williams G., Milstein C. Memory in the B-cell compartment: antibody affinity maturation. (англ.) // Philosophical Transactions Of The Royal Society Of London. Series B, Biological Sciences. — 2000. — 29 March (vol. 355, no. 1395). — P. 357—360. — doi:10.1098/rstb.2000.0573. — PMID 10794054.
- ↑ Stavnezer J., Amemiya C. T. Evolution of isotype switching. (англ.) // Seminars In Immunology. — 2004. — August (vol. 16, no. 4). — P. 257—275. — doi:10.1016/j.smim.2004.08.005. — PMID 15522624.
- ↑ Durandy A. Activation-induced cytidine deaminase: a dual role in class-switch recombination and somatic hypermutation. (англ.) // European Journal Of Immunology. — 2003. — August (vol. 33, no. 8). — P. 2069—2073. — doi:10.1002/eji.200324133. — PMID 12884279.
- ↑ Casali P., Zan H. Class switching and Myc translocation: how does DNA break? (англ.) // Nature Immunology. — 2004. — November (vol. 5, no. 11). — P. 1101—1103. — doi:10.1038/ni1104-1101. — PMID 15496946.
- ↑ Lieber M. R., Yu K., Raghavan S. C. Roles of nonhomologous DNA end joining, V(D)J recombination, and class switch recombination in chromosomal translocations. (англ.) // DNA Repair. — 2006. — 8 September (vol. 5, no. 9-10). — P. 1234—1245. — doi:10.1016/j.dnarep.2006.05.013. — PMID 16793349.
- ↑ Abbas, Lichtman, Pillai, 2015, p. 97.
- ↑ Abbas, Lichtman, Pillai, 2015, p. 97—98.
- ↑ Abbas, Lichtman, Pillai, 2015, p. 98.
- ↑ Schroeder Jr. H. W. The evolution and development of the antibody repertoire. (англ.) // Frontiers In Immunology. — 2015. — Vol. 6. — P. 33—33. — doi:10.3389/fimmu.2015.00033. — PMID 25699050.
- ↑ Fillatreau S., Six A., Magadan S., Castro R., Sunyer J. O., Boudinot P. The astonishing diversity of Ig classes and B cell repertoires in teleost fish. (англ.) // Frontiers In Immunology. — 2013. — Vol. 4. — P. 28—28. — doi:10.3389/fimmu.2013.00028. — PMID 23408183.
- ↑ Web Antibody Modeling (WAM) (17 июля 2011). Дата обращения: 17 апреля 2020. Архивировано из оригинала 17 июля 2011 года.
- ↑ Marcatili P., Rosi A., Tramontano A. PIGS: automatic prediction of antibody structures. (англ.) // Bioinformatics. — 2008. — 1 September (vol. 24, no. 17). — P. 1953—1954. — doi:10.1093/bioinformatics/btn341. — PMID 18641403.
- ↑ Weitzner B. D., Jeliazkov J. R., Lyskov S., Marze N., Kuroda D., Frick R., Adolf-Bryfogle J., Biswas N., Dunbrack Jr. R. L., Gray J. J. Modeling and docking of antibody structures with Rosetta. (англ.) // Nature Protocols. — 2017. — February (vol. 12, no. 2). — P. 401—416. — doi:10.1038/nprot.2016.180. — PMID 28125104.
- ↑ Adolf-Bryfogle J., Kalyuzhniy O., Kubitz M., Weitzner B. D., Hu X., Adachi Y., Schief W. R., Dunbrack Jr. R. L. RosettaAntibodyDesign (RAbD): A general framework for computational antibody design. (англ.) // PLoS Computational Biology. — 2018. — April (vol. 14, no. 4). — P. e1006112—1006112. — doi:10.1371/journal.pcbi.1006112. — PMID 29702641.
- ↑ Lapidoth G. D., Baran D., Pszolla G. M., Norn C., Alon A., Tyka M. D., Fleishman S. J. AbDesign: An algorithm for combinatorial backbone design guided by natural conformations and sequences. (англ.) // Proteins. — 2015. — August (vol. 83, no. 8). — P. 1385—1406. — doi:10.1002/prot.24779. — PMID 25670500.
- ↑ Li T., Pantazes R. J., Maranas C. D. OptMAVEn--a new framework for the de novo design of antibody variable region models targeting specific antigen epitopes. (англ.) // PloS One. — 2014. — Vol. 9, no. 8. — P. e105954—105954. — doi:10.1371/journal.pone.0105954. — PMID 25153121.
- ↑ Pham V., Henzel W. J., Arnott D., Hymowitz S., Sandoval W. N., Truong B. T., Lowman H., Lill J. R. De novo proteomic sequencing of a monoclonal antibody raised against OX40 ligand. (англ.) // Analytical Biochemistry. — 2006. — 1 May (vol. 352, no. 1). — P. 77—86. — doi:10.1016/j.ab.2006.02.001. — PMID 16545334.
- ↑ Ma B., Zhang K., Hendrie C., Liang C., Li M., Doherty-Kirby A., Lajoie G. PEAKS: powerful software for peptide de novo sequencing by tandem mass spectrometry. (англ.) // Rapid Communications In Mass Spectrometry : RCM. — 2003. — Vol. 17, no. 20. — P. 2337—2342. — doi:10.1002/rcm.1196. — PMID 14558135.
- ↑ Zhang J., Xin L., Shan B., Chen W., Xie M., Yuen D., Zhang W., Zhang Z., Lajoie G. A., Ma B. PEAKS DB: de novo sequencing assisted database search for sensitive and accurate peptide identification. (англ.) // Molecular & Cellular Proteomics : MCP. — 2012. — April (vol. 11, no. 4). — P. 111—010587. — doi:10.1074/mcp.M111.010587. — PMID 22186715.
- ↑ Perkins D. N., Pappin D. J., Creasy D. M., Cottrell J. S. Probability-based protein identification by searching sequence databases using mass spectrometry data. (англ.) // Electrophoresis. — 1999. — December (vol. 20, no. 18). — P. 3551—3567. — doi:10.1002/(SICI)1522-2683(19991201)20:18<3551::AID-ELPS3551>3.0.CO;2-2. — PMID 10612281.
- ↑ Bandeira N., Tang H., Bafna V., Pevzner P. Shotgun protein sequencing by tandem mass spectra assembly. (англ.) // Analytical Chemistry. — 2004. — 15 December (vol. 76, no. 24). — P. 7221—7233. — doi:10.1021/ac0489162. — PMID 15595863.
- ↑ Liu X., Han Y., Yuen D., Ma B. Automated protein (re)sequencing with MS/MS and a homologous database yields almost full coverage and accuracy. (англ.) // Bioinformatics. — 2009. — 1 September (vol. 25, no. 17). — P. 2174—2180. — doi:10.1093/bioinformatics/btp366. — PMID 19535534.
- ↑ Castellana N. E., Pham V., Arnott D., Lill J. R., Bafna V. Template proteogenomics: sequencing whole proteins using an imperfect database. (англ.) // Molecular & Cellular Proteomics : MCP. — 2010. — June (vol. 9, no. 6). — P. 1260—1270. — doi:10.1074/mcp.M900504-MCP200. — PMID 20164058.
- ↑ Tran N. H., Rahman M. Z., He L., Xin L., Shan B., Li M. Complete De Novo Assembly of Monoclonal Antibody Sequences. (англ.) // Scientific Reports. — 2016. — 26 August (vol. 6). — P. 31730—31730. — doi:10.1038/srep31730. — PMID 27562653.
- ↑ Animated depictions of how antibodies are used in ELISA assays. Cellular Technology Ltd.—Europe. Дата обращения: 8 мая 2007. Архивировано из оригинала 14 июня 2011 года.
- ↑ Animated depictions of how antibodies are used in ELISPOT assays. Cellular Technology Ltd.—Europe. Дата обращения: 8 мая 2007. Архивировано из оригинала 16 мая 2011 года.
- ↑ Stern P. Current possibilities of turbidimetry and nephelometry // Klin Biochem Metab. — 2006. — Vol. 14, № 3. — P. 146—151. Архивировано 10 апреля 2008 года.
- ↑ Rhoades R. A., Pflanzer R. G. Human Physiology. — 5th. — Thomson Learning, 2002. — С. 584. — ISBN 978-0-534-42174-8.
- ↑ Dean, Laura. Chapter 4: Hemolytic disease of the newborn // Blood Groups and Red Cell Antigens. — NCBI Bethesda (MD): National Library of Medicine (US), 2005.
- ↑ Rodriguez E. A., Wang Y., Crisp J. L., Vera D. R., Tsien R. Y., Ting R. New Dioxaborolane Chemistry Enables (18)F-Positron-Emitting, Fluorescent (18)F-Multimodality Biomolecule Generation from the Solid Phase. (англ.) // Bioconjugate Chemistry. — 2016. — 18 May (vol. 27, no. 5). — P. 1390—1399. — doi:10.1021/acs.bioconjchem.6b00164. — PMID 27064381.
- ↑ Feldmann M., Maini R. N. Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned? (англ.) // Annual Review Of Immunology. — 2001. — Vol. 19. — P. 163—196. — doi:10.1146/annurev.immunol.19.1.163. — PMID 11244034.
- ↑ Doggrell S. A. Is natalizumab a breakthrough in the treatment of multiple sclerosis? (англ.) // Expert Opinion On Pharmacotherapy. — 2003. — June (vol. 4, no. 6). — P. 999—1001. — doi:10.1517/14656566.4.6.999. — PMID 12783595.
- ↑ Krueger G. G., Langley R. G., Leonardi C., Yeilding N., Guzzo C., Wang Y., Dooley L. T., Lebwohl M., CNTO 1275 Psoriasis Study Group. A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis. (англ.) // The New England Journal Of Medicine. — 2007. — 8 February (vol. 356, no. 6). — P. 580—592. — doi:10.1056/NEJMoa062382. — PMID 17287478.
- ↑ Plosker G. L., Figgitt D. P. Rituximab: a review of its use in non-Hodgkin's lymphoma and chronic lymphocytic leukaemia. (англ.) // Drugs. — 2003. — Vol. 63, no. 8. — P. 803—843. — doi:10.2165/00003495-200363080-00005. — PMID 12662126.
- ↑ Vogel C. L., Cobleigh M. A., Tripathy D., Gutheil J. C., Harris L. N., Fehrenbacher L., Slamon D. J., Murphy M., Novotny W. F., Burchmore M., Shak S., Stewart S. J. First-line Herceptin monotherapy in metastatic breast cancer. (англ.) // Oncology. — 2001. — Vol. 61 Suppl 2. — P. 37—42. — doi:10.1159/000055400. — PMID 11694786.
- ↑ LeBien T. W. Fates of human B-cell precursors. (англ.) // Blood. — 2000. — 1 July (vol. 96, no. 1). — P. 9—23. — PMID 10891425.
- ↑ Ghaffer A. Immunization. Immunology — Chapter 14. University of South Carolina School of Medicine (26 марта 2006). Дата обращения: 6 июня 2007. Архивировано 18 октября 2010 года.
- ↑ Urbaniak S. J., Greiss M. A. RhD haemolytic disease of the fetus and the newborn. (англ.) // Blood Reviews. — 2000. — March (vol. 14, no. 1). — P. 44—61. — doi:10.1054/blre.1999.0123. — PMID 10805260.
- ↑ Fung Kee Fung K., Eason E., Crane J., Armson A., De La Ronde S., Farine D., Keenan-Lindsay L., Leduc L., Reid G. J., Aerde J. V., Wilson R. D., Davies G., Désilets V. A., Summers A., Wyatt P., Young D. C., Maternal-Fetal Medicine Committee, Genetics Committee. Prevention of Rh alloimmunization. (англ.) // Journal Of Obstetrics And Gynaecology Canada : JOGC = Journal D'obstetrique Et Gynecologie Du Canada : JOGC. — 2003. — September (vol. 25, no. 9). — P. 765—773. — doi:10.1016/s1701-2163(16)31006-4. — PMID 12970812.
- ↑ Cytochrome P450 Mediated Drug and Carcinogen Metabolism using Monoclonal Antibodies. home.ccr.cancer.gov. Дата обращения: 2 апреля 2018. Архивировано 15 декабря 2018 года.
- ↑ Gelboin H. V., Krausz K. W., Gonzalez F. J., Yang T. J. Inhibitory monoclonal antibodies to human cytochrome P450 enzymes: a new avenue for drug discovery. (англ.) // Trends In Pharmacological Sciences. — 1999. — November (vol. 20, no. 11). — P. 432—438. — doi:10.1016/s0165-6147(99)01382-6. — PMID 10542439.
- ↑ Tini M., Jewell U. R., Camenisch G., Chilov D., Gassmann M. Generation and application of chicken egg-yolk antibodies. (англ.) // Comparative Biochemistry And Physiology. Part A, Molecular & Integrative Physiology. — 2002. — March (vol. 131, no. 3). — P. 569—574. — doi:10.1016/s1095-6433(01)00508-6. — PMID 11867282.
- ↑ Cole S. P., Campling B. G., Atlaw T., Kozbor D., Roder J. C. Human monoclonal antibodies. (англ.) // Molecular And Cellular Biochemistry. — 1984. — June (vol. 62, no. 2). — P. 109—120. — doi:10.1007/bf00223301. — PMID 6087121.
- ↑ Kabir S. Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis. (англ.) // Immunological Investigations. — 2002. — August (vol. 31, no. 3-4). — P. 263—278. — doi:10.1081/imm-120016245. — PMID 12472184.
- ↑ 1 2 Brehm-Stecher B. F., Johnson E. A. Single-cell microbiology: tools, technologies, and applications. (англ.) // Microbiology And Molecular Biology Reviews : MMBR. — 2004. — September (vol. 68, no. 3). — P. 538—559. — doi:10.1128/MMBR.68.3.538-559.2004. — PMID 15353569.
- ↑ Williams N. E. Immunoprecipitation procedures. (англ.) // Methods In Cell Biology. — 2000. — Vol. 62. — P. 449—453. — PMID 10503210.
- ↑ Kurien B. T., Scofield R. H. Western blotting. (англ.) // Methods (San Diego, Calif.). — 2006. — April (vol. 38, no. 4). — P. 283—293. — doi:10.1016/j.ymeth.2005.11.007. — PMID 16483794.
- ↑ Scanziani E. Immunohistochemical staining of fixed tissues. (англ.) // Methods In Molecular Biology (Clifton, N.J.). — 1998. — Vol. 104. — P. 133—140. — doi:10.1385/0-89603-525-5:133. — PMID 9711649.
- ↑ Reen D. J. Enzyme-linked immunosorbent assay (ELISA). (англ.) // Methods In Molecular Biology (Clifton, N.J.). — 1994. — Vol. 32. — P. 461—466. — doi:10.1385/0-89603-268-X:461. — PMID 7951745.
- ↑ Kalyuzhny A. E. Chemistry and biology of the ELISPOT assay. (англ.) // Methods In Molecular Biology (Clifton, N.J.). — 2005. — Vol. 302. — P. 15—31. — doi:10.1385/1-59259-903-6:015. — PMID 15937343.
- ↑ Saper C. B. An open letter to our readers on the use of antibodies. (англ.) // The Journal Of Comparative Neurology. — 2005. — 26 December (vol. 493, no. 4). — P. 477—478. — doi:10.1002/cne.20839. — PMID 16304632.
- ↑ NOT-OD-16-011: Implementing Rigor and Transparency in NIH & AHRQ Research Grant Applications. grants.nih.gov. Дата обращения: 17 апреля 2020. Архивировано 12 февраля 2020 года.
- ↑ Vasilevsky N. A., Brush M. H., Paddock H., Ponting L., Tripathy S. J., Larocca G. M., Haendel M. A. On the reproducibility of science: unique identification of research resources in the biomedical literature. (англ.) // PeerJ. — 2013. — Vol. 1. — P. e148—148. — doi:10.7717/peerj.148. — PMID 24032093.
- ↑ Gebauer M., Skerra A. Engineered protein scaffolds as next-generation antibody therapeutics. (англ.) // Current Opinion In Chemical Biology. — 2009. — June (vol. 13, no. 3). — P. 245—255. — doi:10.1016/j.cbpa.2009.04.627. — PMID 19501012.
- ↑ Lindenmann J. Origin of the terms 'antibody' and 'antigen'. (англ.) // Scandinavian Journal Of Immunology. — 1984. — April (vol. 19, no. 4). — P. 281—285. — doi:10.1111/j.1365-3083.1984.tb00931.x. — PMID 6374880.
- ↑ 1 2 Ярилин, 2010, с. 231.
- ↑ A G N. The Late Baron Shibasaburo Kitasato. (англ.) // Canadian Medical Association Journal. — 1931. — August (vol. 25, no. 2). — P. 206—206. — PMID 20318414.
- ↑ Winau F., Westphal O., Winau R. Paul Ehrlich--in search of the magic bullet. (англ.) // Microbes And Infection. — 2004. — July (vol. 6, no. 8). — P. 786—789. — doi:10.1016/j.micinf.2004.04.003. — PMID 15207826.
- ↑ Silverstein A. M. Cellular versus humoral immunology: a century-long dispute. (англ.) // Nature Immunology. — 2003. — May (vol. 4, no. 5). — P. 425—428. — doi:10.1038/ni0503-425. — PMID 12719732.
- ↑ Van Epps H. L. Michael Heidelberger and the demystification of antibodies. (англ.) // The Journal Of Experimental Medicine. — 2006. — 23 January (vol. 203, no. 1). — P. 5—5. — doi:10.1084/jem.2031fta. — PMID 16523537.
- ↑ Marrack JR. Chemistry of antigens and antibodies. — 2nd edition. — London: His Majesty's Stationery Office, 1938.
- ↑ The Linus Pauling Papers: How Antibodies and Enzymes Work. Дата обращения: 5 июня 2007. Архивировано 5 декабря 2010 года.
- ↑ Silverstein A. M. Labeled antigens and antibodies: the evolution of magic markers and magic bullets. (англ.) // Nature Immunology. — 2004. — December (vol. 5, no. 12). — P. 1211—1217. — doi:10.1038/ni1140. — PMID 15549122.
- ↑ Edelman G.M., Gally J.A. The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins. (англ.) // The Journal Of Experimental Medicine. — 1962. — 1 August (vol. 116). — P. 207—227. — doi:10.1084/jem.116.2.207. — PMID 13889153.
- ↑ Stevens F. J., Solomon A., Schiffer M. Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology. (англ.) // Biochemistry. — 1991. — 16 July (vol. 30, no. 28). — P. 6803—6805. — doi:10.1021/bi00242a001. — PMID 2069946.
- ↑ 1 2 Raju T. N. The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917-85). (англ.) // Lancet (London, England). — 1999. — 18 September (vol. 354, no. 9183). — P. 1040—1040. — doi:10.1016/s0140-6736(05)76658-7. — PMID 10501404.
- ↑ Hochman J., Inbar D., Givol D. An active antibody fragment (Fv) composed of the variable portions of heavy and light chains. (англ.) // Biochemistry. — 1973. — 13 March (vol. 12, no. 6). — P. 1130—1135. — doi:10.1021/bi00730a018. — PMID 4569769.
- ↑ Tomasi T. B. The discovery of secretory IgA and the mucosal immune system. (англ.) // Immunology Today. — 1992. — October (vol. 13, no. 10). — P. 416—418. — doi:10.1016/0167-5699(92)90093-M. — PMID 1343085.
- ↑ Preud'homme J. L., Petit I., Barra A., Morel F., Lecron J. C., Lelièvre E. Structural and functional properties of membrane and secreted IgD. (англ.) // Molecular Immunology. — 2000. — October (vol. 37, no. 15). — P. 871—887. — doi:10.1016/s0161-5890(01)00006-2. — PMID 11282392.
- ↑ Johansson S. G. The discovery of immunoglobulin E. (англ.) // Allergy And Asthma Proceedings. — 2006. — March (vol. 27, no. 2 Suppl 1). — P. 3—6. — PMID 16722325.
- ↑ Hozumi N., Tonegawa S. Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1976. — October (vol. 73, no. 10). — P. 3628—3632. — doi:10.1073/pnas.73.10.3628. — PMID 824647.
- ↑ The MIT 150: 150 Ideas, Inventions, and Innovators that Helped Shape Our World. The Boston Globe (15 мая 2011). Дата обращения: 8 августа 2011. Архивировано 4 марта 2016 года.
Литература[править | править код]
- Галактионов В. Г. Иммунология. — М.: Издат. центр «Академия», 2004. — 528 с. — ISBN 5-7695-1260-1.
- Ярилин А. А. Иммунология. — М.: ГЭОТАР-Медиа, 2010. — 752 с. — ISBN 978-5-9704-1319-7.
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology. — Philadelphia: Elsevier Saunders, 2015. — ISBN 978-0-323-22275-4.
- Kenneth Murphy, Casey Weaver. Janeway's Immunobiology. — Garland Science, 2017. — ISBN 978-0-8153-4505-3.
- Ройт, А. Гл. 6. Антитела и клеточные рецепторы для них // Иммунология / А. Ройт, Дж. Бростофф, Д. Мейл. — 5-е изд. — М. : Мир, 2000. — 592 с. с. : ил. — 7000 экз. — ББК 28.073. — УДК 57.083.3(G). — ISBN 5-03-003305-X.
Ссылки[править | править код]
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |