Глицеральдегид
| Глицеральдегид | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
(R)-2,3-дигидроксипропаналь (D-глицеральдегид,D-глицероза) |
| Традиционные названия | глицераль, глицериновый альдегид, глицероза, глицеротриоза |
| Хим. формула | C3H6O3 |
| Физические свойства | |
| Молярная масса | 90,08 г/моль |
| Плотность | 1,455 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 145 °C |
| • кипения | 140−150 °C при 0,8 мм.рт.ст. °C |
| Классификация | |
| Рег. номер CAS | 56-82-6 |
| PubChem | 751 |
| Рег. номер EINECS | 200-290-0 |
| SMILES | |
| InChI | |
| ChEBI | 5445 |
| ChemSpider | 731 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Глицеральдегид (глицераль, глицериновый альдегид, глицероза, 2,3-дигидроксипропаналь) — моносахарид из группы триоз с эмпирической формулой , принадлежит к альдозам[1]. Является простейшим представителем альдосахаров (альдоз) и единственным сахаром из группы альдотриоз.
Строение молекулы[править | править код]
Глицеральдегид изомерен дигидроксиацетону, отличаясь от него наличием альдегидной группы вместо кетонной. Так как глицеральдегид имеет хиральный центр (асимметричный атом углерода ) то, следовательно, он существует в виде двух энантиомеров с противоположным оптическим вращением: D- (R- или +) и L-(S- или -) стереоизомеров, а также рацемата (эквимолярной смеси энантиомеров). Структура глицеральдегида служит основой для номенклатуры оптических изомеров углеводов.
| D-глицеральдегид (R)-глицеральдегид (+)-глицеральдегид |
L-глицеральдегид (S)-глицеральдегид (−)-глицеральдегид | |
| Проекция Фишера | 
|
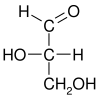
|
| Скелетная формула | 
|

|
| Шаростержневая модель | 
|
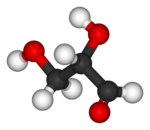
|
Циклическая форма для глицеральдегида отсутствует.
В живых организмах содержатся исключительно производные D-глицеральдегида.[2]
Физические и химические свойства[править | править код]
D- и L-глицеральдегид представляет собой сладкое бесцветное кристаллическое вещество, хорошо растворимое в воде (с образованием вязкого сиропа), малорастворимое в этаноле и диэтиловом эфире, нерастворим в неполярных растворителях. Водный раствор глицеральдегида обладает оптической активностью (вращает плоскость поляризации).[3]
Рацемат глицеральдегид существует в кристаллическом состоянии в виде циклического димера — полуацеталя, который при растворении в воде диссоциирует с образованием раствора мономера (D- и L-энантиомеров).
В кислой среде глицеральдегид через ендиольную форму изомеризуется в дигидроксиацетон. В биохимических реакциях взаимопревращения глицеральдегида и дигидроксиацетона катализирует фермент триозофосфатизомераза. В щелочной среде глицеральдегид конденсируется с образованием смеси гексоз, при взаимодействии с дигидроксиацетоном образует гексулозы. С фенилгидразином легко образует озазоны.
При восстановлении глицеральдегида боргидридами или алюмогидридами щелочных металлов (натрия, лития, калия) образуется трехатомный спирт глицерин или глицерол (пропан-1,2,3-триол), образующийся также при восстановлении дигидроксиацетона.
При мягком окислении глицеральдегида образуется глицериновая кислота (2,3-дигидроксипропановая кислота).
Биологическая роль, получение и применение[править | править код]
Глицеральдегид, в виде глицеральдегид-3-фосфата (глицераль-3-фосфата) является ключевым интермедиатом метаболизма гексоз во многих биохимических процессах: гликолиз, глюконеогенез, фотосинтез. В ходе гликолиза глицеральдегид-3-фосфат катаболизируется с образованием пировиноградной кислоты при аэробном гликолизе, либо молочной кислоты при анаэробном гликолизе.
В лабораторных условиях рацемат глицеральдегида может быть получен химически путём при:
- мягком окисления глицерина пероксидом водорода в присутствии диоксида марганца как катализатора (при этом также образуется дигидроксиацетон);
- окислением акролеина пероксокислотами (например, надбензойной кислотой);
- окислением ацеталя акролеина перманганатом калия в щелочной среде (с последующим омылением ацеталя глицераля).
Энантиомеры глицеральдегида синтезируют окислением соответствующих моносахаридов:
- L-(-)-изомер — окислением L-сорбозы;
- D-(+)-изомер — окислением D-фруктозы или D-маннита.
Глицеральдегид находит ограниченное применение для синтеза других сахаров.[2]
См. также[править | править код]
Литература[править | править код]
- Каррер П. Курс органической химии. — М.: Химия, 1960. — 1216 с.
- Кочетков Н. К. Химия углеводов / Н. К. Кочетков, А. Ф. Бочков, Б. А. Дмитриев. — М.: Наука, 1967. — 672 с.
- Березин Б. Д. Курс современной органической химии: Учебное пособие / Б. Д. Березин. — М: Высшая школа, 1999. — 768 с.
Примечания[править | править код]
- ↑ Thisbe K. Lindhorst. Essentials of Carbohydrate Chemistry and Biochemistry (англ.). — 1st. — Wiley-VCH, 2007. — ISBN 3-527-31528-4.
- ↑ 1 2 Племенков В. В. Введение в химию природных соединений /В. В. Племенков . — Казань, 2001. — 376 с.
- ↑ Рабинович В. А. Краткий химический справочник / В. А. Рабинович, З. Я. Хавин. — 2-е изд. испр. и доп. — Л.: Химия, 1978. — 392 с.
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |
Это заготовка статьи по биохимии. Помогите Википедии, дополнив её. |

