Сложные эфиры

Сло́жные эфи́ры, или эсте́ры (от др.-греч. αἰθήρ — «эфир»), — производные кислородных кислот (как карбоновых, так и неорганических), имеющих общую формулу RkE(=O)l(OH)m, где l ≠ 0, формально являющиеся продуктами замещения атомов водорода в гидроксилах —OH кислотной функции на углеводородный остаток (алифатический, алкенильный, ароматический или гетероароматический); рассматриваются также как ацилпроизводные спиртов[1]. В номенклатуре IUPAC к сложным эфирам относят также ацилпроизводные халькогенидных аналогов спиртов (тиолов, селенолов и теллуролов)[2].
Отличаются от простых эфиров (этеров), у которых два углеводородных радикала соединены атомом кислорода (R1—O—R2).
Сложные эфиры карбоновых кислот
[править | править код]В случае эфиров карбоновых кислот выделяются два класса сложных эфиров:
- собственно сложные эфиры карбоновых кислот общей формулы R1—COO—R2, где R1 и R2 — углеводородные радикалы.
- ортоэфиры карбоновых кислот общей формулы R1—C(OR2)3, где R1 и R2 — углеводородные радикалы. Ортоэфиры карбоновых кислот являются функциональными аналогами кеталей и ацеталей общей формулы R—C(OR′)2—R″ — продуктов присоединения спиртов к карбонильной группе кетонов или альдегидов.
Циклические сложные эфиры оксикислот называются лактонами и выделяются в отдельную группу соединений.
Синтез
[править | править код]Основные методы получения сложных эфиров:
- Этерификация — взаимодействие кислот и спиртов в условиях кислотного катализа, например, получение этилацетата из уксусной кислоты и этилового спирта:
- .
- Частным случаем реакции этерификации является реакция переэтерификации сложных эфиров спиртами, карбоновыми кислотами или другими сложными эфирами:
- ,
- ,
- .
- Реакции этерификации и переэтерификации обратимы, сдвиг равновесия в сторону образования целевых продуктов достигается удалением одного из продуктов из реакционной смеси (чаще всего — отгонкой более летучих спирта, эфира, кислоты или воды; в последнем случае при относительно низких температурах кипения исходных веществ используется отгонка воды в составе азеотропных смесей).
- взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами, например, получение этилацетата из уксусного ангидрида и этилового спирта:
- .
- взаимодействие солей кислот с алкилгалогенидами:
- .
- Присоединение карбоновых кислот к алкенам в условиях кислотного катализа (в том числе и кислотами Льюиса):
- .
- ,
- ,
- .
- Алкилирование карбоновых кислот арилиакилтриазенами:
- .
Свойства и реакционная способность
[править | править код]Сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов — летучие бесцветные жидкости с характерным, зачастую фруктовым запахом. Сложные эфиры высших карбоновых кислот — бесцветные твердые вещества, температура плавления которых зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
В ИК-спектрах сложных эфиров присутствуют характеристические полосы карбоксильной группы — валентных колебаний связей C=O на 1750—1700 см−1 и С—О на 1275—1050 см−1.
Атом углерода карбонильной группы сложных эфиров электрофилен, вследствие этого для них характерны реакции замещения спиртового остатка, которые протекают по механизму присоединение–отщепление (сначала происходит присоединение нуклеофила по связи С=О и далее отщепление алкоксифрагмента:
Такие реакции с кислородсодержащими нуклеофилами (водой и спиртами) зачастую катализируются кислотами за счёт протонирования атома кислорода карбонила с образованием высокоэлектрофильного карбокатиона:
- ,
который далее реагирует с водой (гидролиз) или спиртом (переэтерификация). Гидролиз сложных эфиров в условиях кислотного катализа является обратимым, гидролиз же в щелочной среде необратим из-за образования карбоксилат-ионов RCOO−, не проявляющих электрофильных свойств.
Низшие сложные эфиры реагируют с аммиаком, образуя амиды, уже при комнатной температуре: так, например, этилхлорацетат реагирует с водным аммиаком, образуя хлорацетамид уже при 0 °C[3], в случае высших сложных эфиров аммонолиз идет при более высоких температурах.
Применение
[править | править код]Сложные эфиры широко используются в качестве растворителей, пластификаторов, ароматизаторов.
Эфиры муравьиной кислоты:
- HCOOCH3 — метилформиат, tкип = 32 °C; растворитель жиров, минеральных и растительных масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых уретанов, формамида.
- HCOOC2H5 — этилформиат, tкип = 53 °C; растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы придать ему характерный аромат; применяют в производстве витаминов B1, A, E.
- HCOOCH2CH(CH3)2 — изобутилформиат несколько напоминает запах ягод малины.
- HCOOCH2CH2CH(CH3)2 — изоамилформиат (изопентилформиат) растворитель смол и нитроцеллюлозы.
- HCOOCH2C6H5 — бензилформиат, tкип = 202 °C; имеет запах жасмина; используется как растворитель лаков и красителей.
- HCOOCH2CH2C6H5 — 2-фенилэтилформиат имеет запах хризантем.
Эфиры уксусной кислоты:
- CH3COOCH3 — метилацетат, tкип = 58 °C; по растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель, однако он обладает большей токсичностью, чем ацетон.
- CH3COOC2H5 — этилацетат, tкип = 78 °C; подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести).
- CH3COOC3H7 — н-пропилацетат, tкип = 102 °C; по растворяющей способности подобен этилацетату.
- CH3COOCH(CH3)2 — изопропилацетат, tкип = 88 °C; по растворяющим свойствам занимает промежуточное положение между этил- и пропилацетатом.
- CH3COOC5H11 — н-амилацетат (н-пентилацетат), tкип = 148 °C; напоминает по запаху грушу, применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
- CH3COOCH2CH2CH(CH3)2 — изоамилацетат (изопентилацетат), используется как компонент грушевой и банановой эссенций.
- CH3COOC8H17 — н-октилацетат имеет запах апельсинов.
Эфиры масляной кислоты:
- C3H7COOCH3 — метилбутират, tкип = 102,5 °C; по запаху напоминает ранет.
- C3H7COOC2H5 — этилбутират, tкип = 121,5 °C; имеет характерный запах ананасов.
- C3H7COOC4H9 — бутилбутират, tкип = 166,4 °C;
- C3H7COOC5H11 — н-амилбутират (н-пентилбутират) и C3H7COOCH2CH2CH(CH3)2 — изоамилбутират (изопентилбутират) имеют запах груш, а также служат растворителями в лаках для ногтей.
Эфиры изовалериановой кислоты:
- (CH3)2CHCH2COOCH2CH2CH(CH3)2 — изоамилизовалерат (изопентилизовалерат) имеет запах яблока.
Применение в медицине
[править | править код]В конце XIX — начале XX века, когда органический синтез делал свои первые шаги, множество сложных эфиров было синтезировано и испытано фармакологами. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Сложные эфиры неорганических кислот
[править | править код]В сложных эфирах неорганических (минеральных) кислот углеводородный радикал (например, алкил) замещает один или несколько атомов водорода неорганической оксокислоты, таким образом эфиры неорганических кислот могут быть как средними, так и кислыми.
Эфирами фосфорной, азотной, серной и др. кислот являются органические фосфаты, нитраты, сульфаты[англ.] и др. соответственно.
Ниже приведены примеры эфиров неорганических кислот:
| Кислота | Сложные эфиры | ||||
| Название | Формула | Название | Общая формула | Примеры | |
| Молекулярная | Структурная | ||||
| Фосфорная кислота | H3PO4 | Фосфорные эфиры (фосфаты) |
(RO)nP(O)(OH)3-n, где n = 1-3 |
 (случай n = 3) |
|
| Азотная кислота | HNO3 | Нитратные эфиры (нитраты) |
(RО)NO2 | 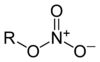
|
|
| Азотистая кислота | HNO2 | Нитритные эфиры (нитриты) |
(RO)N=O |
| |
| Серная кислота | H2SO4 | Сульфатные эфиры (сульфаты)[англ.] |
SO2(R1O)(OR2) | 
|
|
| Сернистая кислота | H2SO3 | Сульфитные эфиры (сульфиты) |
(R1O)S(O)(OR2) | ||
| Угольная кислота | H2CO3 | Угольные эфиры (карбонаты)[en] |
(R1O)C(O)(OR2) | 
|
|
| Борная кислота | H3BO3 | Борные эфиры (бораты) |
(RO)3B | 
|
|
Примечания
[править | править код]- ↑ «Эфиры» — статья в Малой советской энциклопедии; 2 издание; 1937—1947 гг.
- ↑ esters // IUPAG Gold Book. Дата обращения: 18 апреля 2013. Архивировано 21 октября 2012 года.
- ↑ W. A. Jacobs and M. Heidelberger. Chloroacetamide. Organic Syntheses, Coll. Vol. 1, p.153 (1941); Vol. 7, p.16 (1927). Дата обращения: 7 апреля 2011. Архивировано 14 декабря 2004 года.
Литература
[править | править код]- Менделеев Д. И., Монастырский Д. Н. Эфиры сложные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
![{\displaystyle {\mathsf {CH_{3}COOH+C_{2}H_{5}OH\ {\xrightarrow[{}]{H^{+}}}\ CH_{3}COOC_{2}H_{5}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee40e3e9e966af34181c602716ca32dcad33aa6d)











