Этиленхлоргидрин
| Этиленхлоргидрин | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
2-хлорэтанол | ||
| Традиционные названия |
этиленхлоргидрин, β-хлорэтиловый спирт, хлоргидрин этиленгликоля |
||
| Хим. формула | C2H5OCl | ||
| Физические свойства | |||
| Состояние | бесцветная вязкая жидкость, с приятным запахом | ||
| Молярная масса | 80,52 г/моль | ||
| Плотность | 1,205[1] | ||
| Энергия ионизации | 10,9 ± 0 эВ[3] и 10,52 эВ[4] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -69[2] | ||
| • кипения | 128,7[1] °C | ||
| • вспышки | 140 ± 1 ℉[3] | ||
| Пределы взрываемости | 4,9 ± 0 об.%[3] | ||
| Давление пара | 11 мм. рт ст. (20 °С) | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 14,31 ± 0,01[5] | ||
| Оптические свойства | |||
| Показатель преломления | 1,4420 | ||
| Структура | |||
| Дипольный момент | 5,9E−30 Кл·м[4] | ||
| Классификация | |||
| Рег. номер CAS | 107-07-3 | ||
| PubChem | 34 | ||
| Рег. номер EINECS | 203-459-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | KK0875000 | ||
| ChEBI | 28200 | ||
| Номер ООН | 1135 | ||
| ChemSpider | 21106015 | ||
| Безопасность | |||
| Предельная концентрация | 1 мг/м3 | ||
| ЛД50 | 84 мг/кг (мыши, накожно) | ||
| Токсичность | высокотоксичное вещество, смертельно опасно при ингаляционном воздействии. | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
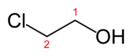
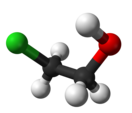
Этиленхлоргидрин (2-хлорэтанол, в просторечии — хлоргидрин этиленгликоля) — хлорорганическое соединение с формулой HOСН2—CH2Cl. Принадлежит к бифункциональным соединениям. Широко используется в органическом синтезе. Весьма токсичен. Относится ко II классу опасности.
История[править | править код]
Этиленхлоргидрин впервые был получен французским химиком А. Вюрцем в 1859 году нагреванием в запаянной трубке этиленгликоля, насыщенного хлористым водородом[6]. Он же описал примеры, показывающие его замечательную реакционную способность.
Физические свойства[править | править код]
Этиленхлоргидрин представляет собой бесцветную летучую вязкую жидкость, с приятным эфирным запахом, хорошо растворимую в воде, этаноле, диэтиловом эфире, ацетоне, 1,2-дихлорэтане и хлороформе, мало растворим в четырёххлористом углероде и углеводородах. Является прекрасным растворителем для самых различных соединений: от неорганических солей до эфиров целлюлозы[1]. С водой этиленхлоргидрин образует азеотропную смесь (42,3% по массе этиленхлоргидрина), кипящую при 97,85 °С[7][2]. Важнейшие физические показатели
- Температура кипения: 128,7 °С,
- температура плавления: —69 ° С
- плотность при 10° С: 1,202 г/см3, при 20° С - 1,205 г/см3
- давление паров: 11 мм рт. ст. (20° С).
Химические свойства[править | править код]
Этиленхлоргидрин обладает высокой реакционной способностью, которую следует приписать главным образом подвижности его галоидного атома[6].
Этиленхлоргидрин вступает в реакции, характерные как для спиртов, так и для галогензамещенных углеводородов[1].
Реакция дегидрохлорирования
Так в присутствии щелочей раствор этиленхлоргидрина легко гидролизуется до этиленгликоля[1]:
Реакция хлорирования
проходит при умеренных температурах (70—90 °С) в жидкой фазе, как и в случае с этанолом образуется хлораль и хлороводород, выход хлораля заметно увеличивается в присутствии воды[1].
Реакция окисления
Этиленхлоргидрин хорошо окисляется сильными окислителями такими, как азотная кислота или хромовый ангидрид[1]:
При этом образуется монохлоруксусная кислота.
Реакция гидрирования
При гидрировании этиленхлоргидрина в присутствии катализаторов (палладий на углекислом кальции, никель) или использование системы амальгама натрия + вода образуется этиловый спирт:
Реакция дегидратации
Кипячение этиленхлоргидрина с небольшим количеством концентрированной серной кислоты приводит к образованию бис(β-хлорэтилового) эфира[1]:
Реакция гидролиза
Этиленхлоргидрин при нагревании с водой в присутствии щелочных агентов легко гидролизуется до этиленгликоля[1]:
С алкоголятами этиленхлоргидрин образует моноэфир этиленгликоля[1]:
Реакция аминирования
При взаимодействии водного раствора аммиака с этиленхлоргидрином образуется смесь моно-, ди-, триэтаноламина[1]:
Реакция этерификации
Этиленхлоргидрин взаимодействует с карбоновыми кислотами и их хлорангидридами с образованием β-хлорэтиловых эфиров:
Аналогично с этиленхлоргидрином взаимодействуют хлорангидриды минеральных кислот:
Реакция обмена
Происходит с участием солей щелочных металлов:
где Ме — Na, K, X — F, Br, CN.
При этом реакция обмена хлора на фтор и бром протекает в растворе этиленгликоля при повышенной температуре; реакция обмена атома хлора на нитрильную группу идёт в присутствии катализатора — цианистой меди (CuCN).
Получение[править | править код]
В лабораториях этиленхлоргидрин получают нагреванием этиленгликоля с хлористым водородом:
2-хлорэтанол может быть получен реакцией этилена с хлорноватистой кислотой в водной среде:
- [8].
Этот способ получения этиленхлоргидрина применяется в промышленности.
Взаимодействие этиленоксида с хлористым водородом приводит к образованию этиленхлоргидрина, реакция сопровождается выделением тепла:
Также существует способ синтеза путём кипячения этиленгликоля с однохлористой серой, последующей фильтрацией смеси и ректификацией[1]:
Применение[править | править код]
Применяется как растворитель в органическом синтезе (растворяет ацетилцеллюлозу). Также применяется при синтезе оксирана
некоторых красителей, эпоксидных смол, пестицидов и лекарств, в том числе производных холина. Он же применяется в получении этиленгликоля и его производных, в частности динитрогликоля. Этиленхлоргидрин является также сырьём для получения иприта по реакции Мейера[1][2].
Этиленхлоргидрин является сырьём для получения этаноламинов, которые широко применяются при очистке технических газов от кислых примесей и в производстве моющих средств. Впервые промышленное применение этиленхлоргидрина было осуществлено для получения синтетического индиго[1].
Токсикология и безопасность[править | править код]
Общий характер действия.
Сильный яд, действующий на нервную систему, обмен веществ, вызывает поражение паренхиматозных органов, раздражает слизистые оболочки, легко проникает через кожу[2]. Особую опасность представляют пары этиленхлоргидрина.
Токсическое действие[править | править код]
Известно, что смертельно вдыхание концентрации 1—1,2 мг/л. при 2-часовой экспозиции. Головокружение и рвота, через несколько часов жжение в глазах, слабость, понос, сильная жажда, боль в области сердца, смерть в первые же сутки. Описано внезапное тяжёлое отравление после длительной работы в контакте с этиленхлоргидрином. Возникли рвота, коматозное состояние, цианоз, нарушение дыхания и понижение сухожильных рефлексов. Состояние улучшилось после введения раствора глюкозы и левулёзы, гидрокортизона, бикарбоната натрия, глюконата кальция. Выздоровление через неделю[2].
Действие на кожу[править | править код]
Обладает слабым раздражающим эффектом. Хорошо впитывается через кожу. Известны лёгкие и тяжёлые отравления человека через кожу. При попадании этиленхлоргидрина на 1/4 поверхности кожного покрова через 1 час тяжёлая рвота, чувство опьянения, через 5 часов нарушение сознания, исчезнувшее лишь после 6 суток лечения[2].
Безопасность[править | править код]
Взрыво- и пожароопасный продукт, т. всп. 55 °С, т. воспл. (в закрытом приборе) 58,9 °С, т. самовоспл. 425 °С; КПВ 4,9-15,9% (по объёму)[1]. Предельно допустимая концентрация 1 мг/м3[2].
Индивидуальная защита. Меры предупреждения.
Фильтрующий противогаз марки А, в случае высоких концентраций — изолирующий шланговый противогаз с принудительной подачей свежего воздуха. Самая тщательная защита кожи — перчатки (из полиэтилена, полихлорвинила, наиритного латекса и т.п.), нарукавники, передники, защитная обувь. Обязательное мытьё после работы. Не применять этиленхлоргидрин в качестве растворителя и во всех случаях, когда не обеспечена возможность полной герметизации производственных процессов. Постоянный контроль за концентрациями этиленхлоргидрина в рабочей зоне. Медицинское наблюдение за состоянием здоровья работающих[2].
Определение в воздухе[править | править код]
Основано на гидролизе этиленхлоргидрина до этиленгликоля и окислении последнего до формальдегида. Метод не специфичен в присутствии формальдегида, окиси этилена и этиленгликоля. Определению не мешают хлор, НСl, дихлорэтан, хлорекс. Чувствительность 0,5 мкг в анализируемом объёме[2].
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Ошин Л.А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с.
- ↑ 1 2 3 4 5 6 7 8 9 Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. / Под ред. засл. деят. науки проф. Н. В. Лазарева и докт. мед. наук Э. Н. Левиной. — Изд. 7-е, пер. и доп. — Л.: «Химия», 1976. — Т. I. — С. 395-396. — 592 с. — 49 000 экз.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0268.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Ballinger P., Long F. A. Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds 1,2 (англ.) // Journal of the American Chemical Society / P. J. Stang — ACS, 1960. — Vol. 82, Iss. 4. — P. 795—798. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA01489A008
- ↑ 1 2 Динцес А.И. Основы технологии нефтехимического синтеза. — 1960. — 852 с.
- ↑ Бродович А.И. Этилен коксового газа как сырьё для органического синтеза. — М.: Металлургиздат, 1963. — 326 с.
- ↑ Зыков Д,Д. Общая химическая технология органических веществ. — второе издание. — М., 1966. — 608 с.



![{\displaystyle {\mathsf {ClCH_{2}CH_{2}OH+3Cl_{2}{\xrightarrow[{}]{[t<90^{o}C]}}CCl_{3}CHO+4HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d39770729c8ddd04cd40b796ff5d658e9602946f)
![{\displaystyle {\mathsf {ClCH_{2}CH_{2}OH+3/2O_{2}{\xrightarrow[{-H_{2}O}]{CrO_{3}/HNO_{3}}}CH_{2}ClCOOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/94813a70ca8297ac53759e399d11fcfe17272974)
![{\displaystyle {\mathsf {ClCH_{2}CH_{2}OH{\xrightarrow[{}]{[H_{2};kat:Pd+CaCO_{3};Na/Hg+H_{2}O]}}CH_{3}CH_{2}OH+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a5ba6c739da5168cbbe034faacfe30efcb007ae)
![{\displaystyle {\mathsf {2ClCH_{2}CH_{2}OH{\xrightarrow[{}]{[H_{2}SO_{4}]}}(ClCH_{2}CH_{2})_{2}O+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/76491982bf751107be7c8277a61c48a35d850a83)
![{\displaystyle {\mathsf {ClCH_{2}CH_{2}OH+H_{2}O{\xrightarrow[{}]{[NaHCO_{3},NaOH]}}HOCH_{2}CH_{2}OH+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c21839a144e71cb7aec521d6deac818e42415eb2)











