Вирусы: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Minina (обсуждение | вклад) |
Minina (обсуждение | вклад) |
||
| Строка 616: | Строка 616: | ||
== Применение == |
== Применение == |
||
=== В науках о жизни и медицине === |
=== В науках о жизни и медицине === |
||
[[Файл:Influenza virus research.jpg|left|мини|[[Учёный]], изучающий вирус гриппа [[H5N1]]]] |
|||
Вирусы имеют важное значение для исследований в [[Молекулярная биология|молекулярной]] и [[Клеточная биология|клеточной биологии]], так как они представляют собой простые системы, которые можно использовать для управления и изучения функций [[Клетка (биология)|клеток]]<ref>Collier p.8</ref>. Изучение и использование вирусов дало ценную информацию о различных аспектах клеточной биологии<ref>Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James.[http://www.ncbi.nlm.nih.gov/books/bv.fcgi?highlight=Viruses&rid=mcb.section.1408#1422 Viruses:Structure, Function, and Uses] Retrieved on September 16, 2008</ref>. К примеру, вирусы применялись в [[Генетика|генетических]] исследованиях, и они помогли нам прийти к пониманию ключевых механизмов [[Молекулярная биология|молекулярной генетики]], как то: [[репликация ДНК]], [[Транскрипция (биология)|транскрипция]], [[процессинг РНК]], [[Трансляция (биология)|трансляция]], транспорт [[Белок|белков]]. |
Вирусы имеют важное значение для исследований в [[Молекулярная биология|молекулярной]] и [[Клеточная биология|клеточной биологии]], так как они представляют собой простые системы, которые можно использовать для управления и изучения функций [[Клетка (биология)|клеток]]<ref>Collier p.8</ref>. Изучение и использование вирусов дало ценную информацию о различных аспектах клеточной биологии<ref>Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James.[http://www.ncbi.nlm.nih.gov/books/bv.fcgi?highlight=Viruses&rid=mcb.section.1408#1422 Viruses:Structure, Function, and Uses] Retrieved on September 16, 2008</ref>. К примеру, вирусы применялись в [[Генетика|генетических]] исследованиях, и они помогли нам прийти к пониманию ключевых механизмов [[Молекулярная биология|молекулярной генетики]], как то: [[репликация ДНК]], [[Транскрипция (биология)|транскрипция]], [[процессинг РНК]], [[Трансляция (биология)|трансляция]], транспорт [[Белок|белков]]. |
||
| Строка 637: | Строка 638: | ||
Из-за своих размеров, формы и хорошо изученной химической структуры вирусы использовались как шаблоны для организации материалов на наноуровне. Примером такой недавней работы могут служить исследования, проведённые [[Исследовательская лаборатория Наваля|Исследовательской лабораторией Наваля]] в [[Вашингтон (округ Колумбия)|Вашингтоне (округ Колумбия)]] с использованием [[Вирус мозаики коровьего гороха|вируса мозаики коровьего гороха]] ({{lang-en|Cowpea Mosaic Virus (CPMV)}}) для усиления сигналов в [[сенсор]]ах с [[ДНК-микрочип]]ами. В данном случае вирусные частицы разделяли частицы [[Флуоресценция|флуоресцентных]] красителей, которые использовались для передачи сигнала, предотвращая, таким образом, скопление нефлуоресцентных [[димер]]ов, выступающих как гасители сигнала<ref>{{cite journal|author=Soto CM, Blum AS, Vora GJ, ''et al.''|title=Fluorescent signal amplification of carbocyanine dyes using engineered viral nanoparticles|journal=J. Am. Chem. Soc.|volume=128|issue=15|pages=5184–9|year=2006|pmid=16608355|doi=10.1021/ja058574x}}</ref>. Другим примером использования ''CPMV'' является применение его как наноразмерного образца для молекулярной [[Электроника|электроники]]<ref>{{cite journal | author = Blum AS, Soto CM, Wilson CD ''et al.'' | year = 2005 | title = An Engineered Virus as a Scaffold for Three-Dimensional Self-Assembly on the Nanoscale | url = | journal = Small | volume = 7 | issue = | page = 702 |doi=10.1002/smll.200500021 | pmid=17193509}}</ref>. |
Из-за своих размеров, формы и хорошо изученной химической структуры вирусы использовались как шаблоны для организации материалов на наноуровне. Примером такой недавней работы могут служить исследования, проведённые [[Исследовательская лаборатория Наваля|Исследовательской лабораторией Наваля]] в [[Вашингтон (округ Колумбия)|Вашингтоне (округ Колумбия)]] с использованием [[Вирус мозаики коровьего гороха|вируса мозаики коровьего гороха]] ({{lang-en|Cowpea Mosaic Virus (CPMV)}}) для усиления сигналов в [[сенсор]]ах с [[ДНК-микрочип]]ами. В данном случае вирусные частицы разделяли частицы [[Флуоресценция|флуоресцентных]] красителей, которые использовались для передачи сигнала, предотвращая, таким образом, скопление нефлуоресцентных [[димер]]ов, выступающих как гасители сигнала<ref>{{cite journal|author=Soto CM, Blum AS, Vora GJ, ''et al.''|title=Fluorescent signal amplification of carbocyanine dyes using engineered viral nanoparticles|journal=J. Am. Chem. Soc.|volume=128|issue=15|pages=5184–9|year=2006|pmid=16608355|doi=10.1021/ja058574x}}</ref>. Другим примером использования ''CPMV'' является применение его как наноразмерного образца для молекулярной [[Электроника|электроники]]<ref>{{cite journal | author = Blum AS, Soto CM, Wilson CD ''et al.'' | year = 2005 | title = An Engineered Virus as a Scaffold for Three-Dimensional Self-Assembly on the Nanoscale | url = | journal = Small | volume = 7 | issue = | page = 702 |doi=10.1002/smll.200500021 | pmid=17193509}}</ref>. |
||
=== Искусственные вирусы === |
=== Искусственные вирусы === |
||
Многие вирусы могут быть получены ''de novo'', то есть с нуля, а первый искусственный вирус был получен в [[2002 год]]у<ref>{{cite journal |author=Cello J, Paul AV, Wimmer E |title=Chemical synthesis of poliovirus cDNA: generation of infectious virus in the absence of natural template |journal=Science |volume=297 |issue=5583 |pages=1016–8 |year=2002 |pmid=12114528 |doi=10.1126/science.1072266}}</ref>. Несмотря на некоторые неправильные трактовки, при этом синтезируется не сам вирус как таковой, а его [[ДНК]]-геном (в случае [[ДНК-содержащие вирусы|ДНК-вирусов]]) или [[Комплементарность (биология)|комплементарная]] ДНК-копия его [[геном]]а (в случае [[РНК-содержащие вирусы|РНК-вирусов]]). У многих семейств вирусов голая искусственная ДНК или [[РНК]] (последняя получается путём обратной переделки синтетической комплементарной ДНК), будучи введённой в [[Клетка (биология|клетку]], проявляет [[Инфекция|инфекционные]] свойства. Иными словами, они содержат всю необходимую информацию для образования новых вирусов. Эта технология в настоящее время используется для разработки [[Вакцина|вакцин]] нового типа<ref name=Coleman>{{cite journal |author= Coleman JR, Papamichail D, Skiena S, Futcher B, Wimmer E, Mueller S |title=Virus attenuation by genome-scale changes in codon pair bias |journal=Science |volume=320 |issue=5884 |pages=1784–7 |year=2008 |pmid=18583614|pmc=2754401 |doi= 10.1126/science.1155761}}</ref>. Возможность создавать искусственные вирусы имеет далеко идущие последствия, поскольку вирус не может вымереть, пока известна его геномная последовательность и имеются чувствительные к нему клетки. В наши дни полные геномные последовательности 2408 различных вирусов (в том числе оспы) находятся в публичном доступе в онлайн-базе данных, поддерживаемой [[ |
Многие вирусы могут быть получены ''de novo'', то есть с нуля, а первый искусственный вирус был получен в [[2002 год]]у<ref>{{cite journal |author=Cello J, Paul AV, Wimmer E |title=Chemical synthesis of poliovirus cDNA: generation of infectious virus in the absence of natural template |journal=Science |volume=297 |issue=5583 |pages=1016–8 |year=2002 |pmid=12114528 |doi=10.1126/science.1072266}}</ref>. Несмотря на некоторые неправильные трактовки, при этом синтезируется не сам вирус как таковой, а его [[ДНК]]-геном (в случае [[ДНК-содержащие вирусы|ДНК-вирусов]]) или [[Комплементарность (биология)|комплементарная]] ДНК-копия его [[геном]]а (в случае [[РНК-содержащие вирусы|РНК-вирусов]]). У многих семейств вирусов голая искусственная ДНК или [[РНК]] (последняя получается путём обратной переделки синтетической комплементарной ДНК), будучи введённой в [[Клетка (биология|клетку]], проявляет [[Инфекция|инфекционные]] свойства. Иными словами, они содержат всю необходимую информацию для образования новых вирусов. Эта технология в настоящее время используется для разработки [[Вакцина|вакцин]] нового типа<ref name=Coleman>{{cite journal |author= Coleman JR, Papamichail D, Skiena S, Futcher B, Wimmer E, Mueller S |title=Virus attenuation by genome-scale changes in codon pair bias |journal=Science |volume=320 |issue=5884 |pages=1784–7 |year=2008 |pmid=18583614|pmc=2754401 |doi= 10.1126/science.1155761}}</ref>. Возможность создавать искусственные вирусы имеет далеко идущие последствия, поскольку вирус не может вымереть, пока известна его геномная последовательность и имеются чувствительные к нему клетки. В наши дни полные геномные последовательности 2408 различных вирусов (в том числе [[Натуральная оспа|оспы]]) находятся в публичном доступе в онлайн-базе данных, поддерживаемой [[Национальными институтами здравоохранения США|Национальные институты здравоохранения США]]<ref>{{cite web|author=Genomes |url=http://www.ncbi.nlm.nih.gov/genomes/GenomesHome.cgi?taxid=10239 |title=NIH viral genome database |publisher=Ncbi.nlm.nih.gov |date= |accessdate=2012-05-07}}</ref>. |
||
=== Вирусы как оружие === |
|||
{{См. также|Биологическое оружие}} |
|||
Способность вирусов вызывать опустошительные [[Эпидемия|эпидемии]] среди людей порождает беспокойство, что вирусы могут использоваться как [[биологическое оружие]]. Дополнительные опасения вызвало успешное воссоздание вредоностного вируса [[грипп]]а 1918 в лаборатории<ref>Shors p. 331</ref>. [[Вирус оспы]] на всём протяжении истории опустошал множество стран вплоть до его окончательного искоренения. Официально образцы вируса оспы хранятся лишь в двух местах в мире — в двух лабораториях в [[Россия|России]] и [[США]]<ref name="pmid18844596">{{cite journal|author = Artenstein AW, Grabenstein JD|title = Smallpox vaccines for biodefense: need and feasibility|journal = Expert Review of Vaccines|volume = 7|issue = 8|pages = 1225–37|year = 2008|pmid = 18844596|doi = 10.1586/14760584.7.8.1225}}</ref>. Опасения, что он может быть использован как оружие, не являются в полной мере беспочвенными<ref name="pmid18844596"/>; [[вакцина]] против оспы иногда имеет тяжёлые побочные эффекты — в последние годы до официально объявленного искоренения вируса больше людей серьёзно заболели из-за вакцины, чем от вируса<ref name="pmid12911836">{{cite journal |
|||
|author=Aragón TJ, Ulrich S, Fernyak S, Rutherford GW |
|||
|title=Risks of serious complications and death from smallpox vaccination: a systematic review of the United States experience, 1963–1968 |
|||
|journal=BMC public health |
|||
|volume=3 |
|||
|page=26 |
|||
|year=2003 |
|||
|pmid=12911836 |
|||
|doi=10.1186/1471-2458-3-26 |
|||
|pages=26 |
|||
|pmc=194634}}</ref>, поэтому [[вакцинация]] против оспы больше не практикуется повсеместно<ref name="pmid15578369">{{cite journal |
|||
|author=Weiss MM, Weiss PD, Mathisen G, Guze P |
|||
|title=Rethinking smallpox |
|||
|journal=Clin. Infect. Dis. |
|||
|volume=39 |
|||
|issue=11 |
|||
|pages=1668–73 |
|||
|year=2004 |
|||
|pmid=15578369 |
|||
|doi=10.1086/425745}}</ref>. По этой причине большая часть современного населения [[Земля|Земли]] пррактически не имеет общепризнанной устойчивости к [[Натуральная оспа|оспе]]<ref name="pmid18844596"/>. |
|||
== В массовой культуре == |
== В массовой культуре == |
||
Версия от 10:32, 27 января 2013
Эту страницу в данный момент активно редактирует участник Minina. |
| Вирусы | ||||||||
|---|---|---|---|---|---|---|---|---|
 Ротавирус | ||||||||
| Научная классификация | ||||||||
|
Группа: Вирусы |
||||||||
| Международное научное название | ||||||||
| Viruses [1] | ||||||||
| Отряды | ||||||||
|
||||||||
| ||||||||
Ви́рус (лат. virus — яд) — субклеточный инфекционный агент, который может воспроизводиться только внутри живых клеток организма. Они поражают все типы организмов, от растений и животных до бактерий и архей[3] (вирусы бактерий обычно называют бактериофагами).
Со времени опубликования в 1892 году статьи Дмитрия Ивановского, описывающей небактериального патогена растений табака, и открытия в 1898 году Мартином Бейеринком вируса табачной мозаики[4] более 5 тысяч вирусов были детально описаны[5], хотя существуют ещё миллионы вирусов различных типов[6]. Вирусы обнаружены почти в каждой экосистеме на Земле, являясь одной из наиболее многочисленных форм жизни[7][8]. Изучением вирусов занимается наука вирусология, раздел микробиологии.
Вирусные частицы (называемые вирионами) состоят из двух или трёх частей: генетического материала в виде молекулы ДНК или РНК, длинных молекул, несущих генетическую информацию (некоторые, например мимивирусы, имеют оба типа молекул); белковой оболочки (капсида), защищающей эти молекулы; в некоторых случаях присутствует дополнительный липидный слой, покрывающий белковую оболочку, когда вирус находится вне клетки. Наличие капсида отличает вирусы от вирусоподобных инфекционных нуклеиновых кислот — вироидов. Классифицируют ДНК-содержащие вирусы и РНК-содержащие вирусы, на чём основана классификация вирусов по Балтимору. Ранее к вирусам также ошибочно относили прионы, однако впоследствии оказалось, что эти возбудители представляют собой особые инфекционные белки и не содержат нуклеиновых кислот. Форма вирусов варьирует от простой спиральной и икосаэдрической до более сложных структур. Размеры среднего вируса составляют около одной сотой размеров средней бактерии. Большинство вирусов слишком малы, чтобы быть отчётливо различимыми в световом микроскопе.
Вирусы являются облигатными паразитами, так как не способны размножаться вне клетки. Вне клетки вирусные частицы не проявляют признаки живого и ведут себя как частицы органических полимеров. От живых организмов-внутриклеточных паразитов отличаются полным отсутствием основного и энергетического обмена, и отсутствием сложнейшего элемента живых систем — аппарата трансляции (синтеза белка), степень сложности которого превышает таковую самих вирусов.
Несмотря на некоторые общие закономерности строения и стратегии развития (связанные с функциональной общностью), вирусы не имеют общего происхождения, однако, существуют и другие точки зрения.[9] Это подтверждается тем, что геномы вирусов, инфицирующих далёкие между собой группы организмов, структурно родственны, но при том имеют общую структуру генов и регуляторных элементов, кодируют структурно близкие белки, имеют общие механизмы регуляции экспрессии генов. Обнаружены также вирусы, поражающие другие вирусы (вирусы-сателлиты).
Появление вирусов на эволюционном древе жизни неясно: некоторые из них могли образоваться из плазмид, небольших кусочков ДНК, способных передаваться от одной клетки к другой, в то время как другие могли появиться из бактерий. В эволюции вирусы являются важным средством горизонтального переноса генов, обуславливающего генетическое разнообразие[10].
Вирусы распространяются многими способами; вирусы растений могут передаваться от растения к растению насекомыми, питающимися растительными соками, к примеру, тлями; вирусы животных способны переноситься кровососущими насекомыми. Такие организмы известны как переносчики. Вирус гриппа распространяется при кашле и чихании (то есть воздушно-капельным путём). Норовирус и ротавирус, обычно вызывающие вирусные гастроэнтериты, передаются фекально-оральным путём при контакте с заражённой пищей или водой. ВИЧ является одним из нескольких вирусов, передающихся половым путём и при переливании заражённой крови. Ряд хозяйских клеток, которые может поражать вирус, называется рядом хозяев или специфичностью к хозяевам. Он может быть узок или, если вирус поражает многие виды, широк[11].
У животных вирусные инфекции вызывают иммунный ответ, чаще всего уничтожающий болезнетворного вируса. Иммунный ответ может также вызываться вакцинами, дающими приобретённый активный иммунитет против конкретной вирусной инфекции. Однако некоторым вирусам, в том числе и возбудителям СПИДа и вирусных гепатитов удаётся ускользнуть от иммунного ответа, вызывая хроническую болезнь. Антибиотики не действуют на вирусы, однако было разработано несколько противовирусных препаратов.
Этимология названия
Слово «вирус», образованное от лат. virus — «яд», впервые было использовано в английском языке в 1392 году[12]. Слово «вирулентный», восходящее к лат. virulentus – «ядовитый», датируется 1400 годом[13]. Значение слова «вирус» как агента, могущего вызывать инфекционную болезнь, впервые было применено в 1728 году[12] до открытия вирусов Дмитрием Ивановским в 1892 году. Множественное число – «вирусы». Прилагательное «вирусный» относится к 1948 году[14]. Термин «вирион» (множественное число – «вирионы»), датируемый 1959 годом[15], применяется для обозначения единичной стабильной вирусной частицы, покинувшей клетку и полностью способной инфицировать другие клетки того же типа[16].
История исследований

Луи Пастер не был способен найти агент, вызывающий бешенство, и предполагал, что этот патоген слишком мал, чтобы быть видным в микроскоп[17]. В 1884 году французский микробиолог Шарль Шамберлан изобрёл фильтр (сейчас известный как фильтр Шамберлана или фильтр Шамберлана-Пастера), поры которого по размеру меньше бактерий. Таким образом, с его помощью можно избежать бактериального загрязнения[18]. В 1892 году русский биолог Дмитрий Ивановский использовал этот фильтр для изучения того, что сейчас известно как вирус табачной мозаики. Его эксперименты показали, что перетёртый экстракт заражённых растений табака сохраняет инфекционные свойства и после фильтрации. Ивановский предположил, что инфекция может вызываться токсином, выделяемым бактериями, однако он не развил эту идею[19]. В то время считалось, что любой инфекционный агент поглощается фильтрами и может быть выращен в питательной среде — таков один из постулатов микробной теории болезней[4]. В 1898 году датский микробиолог Мартин Бейеринк повторил эти эксперименты и убедился, что прошедший сквозь фильтр инфекционный материал есть не что иное, как новая форма инфекционных агентов[20]. Он подметил, что агент размножался только в делящихся клетках, однако в его экспериментах не показано, что он состоит из частей. Бейеринк назвал его Contagium vivum fluidum (дословно «растворимый живущий микроб») и вновь ввёл в употребление слово «вирус»[19]. Он утверждал, что по своей природе вирус однороден. Эта теория впоследствии была опровергнута Уэнделлом Стэнли, доказавшим, что вирус состоит из отдельных частей[19]. В том же году Фридрих Лёффлер и Пауль Фрош обнаружили первый вирус животных – вирус ящура (афтовирус), пропустив его через схожий фильтр[21].
В начале XX века английский бактериолог Фредерик Туэрт открыл группу вирусов, инфицирующих бактерии (сейчас они известны как бактериофаги[22] или просто фаги), а французско-канадский микробиолог Феликс Д’Эрель описал вирусы, которые, будучи добавленными к бактериям на агар, образуют вокруг себя пространство с мёртвыми бактериями. Он аккуратно разбавил суспензию из этих вирусов и установил наибольшее разведение (наименьшую концентрацию вирусов), при которой не все бактерии погибают, но тем не менее образуются отдельные области с мёртвыми организмами. Подсчитав число таких областей и приумножив их при помощи разбавления, ему удалось определить число вирусов в первоначальной суспензии[23]. Фаги были объявлены потенциальным средством от болезней, таких как тиф и холера, однако это было забыто в связи с открытием уникальных свойств пенициллина. Изучение фагов показало их способность включать и выключать некоторые гены, а также открыло возможность использовать их как удобный механизм для введения в бактериальный геном чужеродных генов.
К концу XIX века было известно, что вирусы обладают инфекционными свойствами, способны проходить через фильтры и обладают избирательностью в отношении хозяев. В то время были известны только вирусы животных и растений. В 1906 году Росс Грэнвилл Харрисон изобрёл метод выращивания тканей в лимфе, и в 1913 году Штейнард, Израэли и Ламберт использовали этот метод при выращивании вируса коровьей оспы на фрагментах ткани роговицы морских свинок[24]. В 1928 году Г. Б. Мэйтланд и М. К. Мэйтланд выращивали вирус коровьей оспы на суспензии из измельчённой куриных почек. Этот метод до конца 1950-х годов не применялся широко, когда полиовирус выращивали в широких масштабах для производства вакцины[25].
Другое крупное достижение было сделано в 1931 году, когда американский патолог Эрнест Уильям Гудпасчур вырастил вирус гриппа и несколько других вирусов на оплодотворённых куриных яйцах[26]. В 1949 году Джон Франклин Эндерс, Томас Уэллер и Фредерик Роббинс вырастили полиовирус на культуре клеток зародыша человека. Это был первый вирус, выращенный не на тканях животных или яйцах. Эта работа дала возможность Джонасу Солку создать эффективную полиовакцину (вакцину против полиомиелита)[27].
Первые изображения вирусов были получены после изобретения электронного микроскопа немецкими инженерами Эрнстом Руской и Максом Кноллем[28]. В 1935 году американский биохимик и вирусолог Уэнделл Мередит Стэнли тщательно изучил вирус табачной мозаики и обнаружил, что он по большей части состоит из белка[29]. Спустя короткое время этот вирус был разделён на белковую и РНК-составляющую[30]. Вирус табачной мозаики первым был кристаллизован, и поэтому его структура могла быть детально показана. Первая рентгенография кристаллизованного вируса была получена Берналем и Фэнкухеном в 1941 году. На основании этих изображений Розалинд Франклин в 1955 году открыла полную структуру ДНК вируса[31]. В том же году Хайнц Френкель-Конрат и Робли Уилльямс показали, что отдельная РНК вируса табачной мозаики и его белковая оболочка способны к самосборке в функциональный вирус. Возможно, этот простой механизм лежит в основе создания вирусов вне хозяйских клеток[32].
Вторая половина XX века стала золотым веком вирусологии. В то время было открыто свыше 2000 видов вирусов животных, растений и бактерий[33]. В 1957 году были открыты лошадиный артеривирус и возбудитель коровьей вирусной диареи (пестивирус). В 1963 году Барух Бламберг открыл вирус гепатита B[34], а в 1965 году Хоуард Темин описал первый ретровирус. В 1970 году Хоуард Темин и Дейвид Балтимор независимо друг от друга описали обратную транскриптазу, ключевой фермент, с помощью которого ретровирусы транслируют свою РНК на ДНК клетки-хозяина[35]. В 1983 году группа учёных во главе с Люком Монтанье из Института Пастера во Франции выделили первый ретровирус, известный сейчас как ВИЧ[36].
В 2002 году в Нью-Йоркском университете был создан первый синтетический вирус (вирус полиомиелита)[37].
Происхождение
Вирусы найдены везде, где есть жизнь, и, вероятно, вирусы существуют с момента появления первых живых клеток[38]. Происхождение вирусов не ясно, поскольку они не оставляют окаменелостей, так что для сравнений ДНК или РНК вирусов были использованы молекулярные технологии. Они являются важными средствами определения того, как появились вирусы[39].
Существует три основные гипотезы, объясняющие происхождение вирусов[40][41]:
- Регрессивная гипотеза
Согласно этой гипотезе, вирусы некогда были мелкими клетками, паразитующими в более крупных клетках. Некоторые бактерии, а именно риккетсии и хламидии, представляют собой клеточные организмы, которые, тем не менее, подобно вирусам могут размножаться только внутри родительской клетки. Они поддерживают эту гипотезу, а их зависимость от паразитизма предположительно связана с утратой генов, ответственных за выживание вне хозяйской клетки. Эту гипотезу также называют дегенеративной гипотезой[42][43] или гипотезой редукции[44].
- Гипотеза клеточного происхождения
Некоторые вирусы могли появиться из фрагментов ДНК или РНК, которые «откололись» от генов более крупного организма. Отделившаяся ДНК может происходить от плазмид (отдельно отстоящих фрагментов ДНК, могущих перемещаться между клетками) или от транспозонов (молекул ДНК, реплицирующихся и перемещающихся с место на место внутри генома)[45]. Однажды названные «прыгающими генами», транспозоны являются примерами мобильных генетических элементов, и они могли дать начало некоторым вирусам. Они были открыты Барбарой Мак-Клинток в 1950 году в кукурузе[46]. Эту гипотезу также называют гипотезой кочевания[42][47] или гипотезой отделения[44].
- Гипотеза коэволюции
Эта гипотеза предполагает, что вирусы произошли от комплекса молекул белков и нуклеиновых кислот в то же время, что и первые на Земле живые клетки, и являются зависимыми от клеточной жизни вот уже миллиарды лет. Вироиды – это молекулы РНК, которые не рассматриваются в составе вирусов, потому что у них нет белковой оболочки. Тем не менее, некоторые характеристики сближают их с некоторыми вирусами, а потому их рассматривают в числе субвирусных частиц[48]. Вироиды являются важными патогенами растений[49]. Они не кодируют собственные белки, однако взаимодействуют с хозяйской клеткой и используют её для осуществления репликации своей РНК[50]. Вирус гепатита D имеет геном, схожий с геномом вироидов и также содержащий РНК, но имеет отличную от капсида вируса гепатита B белковую оболочку (этим он отличен от вироидов) и не может размножаться самостоятельно. Поэтому он является дефектным вирусом и не может реплицироваться без помощи вируса гепатита B[51]. Вирофаг Спутник схожим образом зависим от мимивируса, поражающего простейшее Acanthamoeba castellanii[52]. Эти вирусы зависят от присутствия в хозяйской клетке другого вируса и называются вирусами-сателлитами. Возможно, они являются промежуточным звеном между вирусами и вироидами[53][54].
В прошлом каждая из этих гипотез имела проблемы: регрессивная гипотеза не объясняет, почему даже мельчайшие клеточные паразиты никак не походят на вирусы. Гипотеза отделения не даёт объяснения появлению капсида и других структур вирусной частицы. Гипотеза коэволюции противоречит определению вирусов как неклеточных частиц, зависимых от хозяйских клеток[44]. В настоящее время вирусы считаются древними организмами, появившимися ещё до разделения клеточной жизни на три домена[55]. Это открытие показало современным вирусологам необходимость пересмотра этих трёх классических гипотез[55].
Убедительность гипотезы мира РНК[56] и компьютерные исследования последовательностей вирусной и хозяйской ДНК дают лучшее понимание эволюционных взаимоотношений между различными группами вирусов и могут помочь определить предков современных вирусов. Но такие анализы не дали подтверждений, какая из этих трёх гипотез верна[56]. Однако представляется маловероятным, чтобы все современные вирусы имели общего предка, и, возможно, в прошлом вирусы возникали огромное число раз по одному или нескольким механизмам[57].
Прионы – это инфекционные белковые молекулы, не содержащие ДНК или РНК[58]. Они вызывают такие заболевания, как почесуха овец, губчатая энцефалопатия крупного рогатого скота и хроническая слабость (англ. chronic wasting disease) у оленей. У человека к прионным болезням относят куру, болезнь Крейтцфельдта-Якоба и синдром Герстмана-Штраусслера-Шейнкера[59]. Они также способны образовывать собственные копии. Дело в том, что некоторые белки могут существовать в двух различных формах: нормальной и прионной, а прион изменяет нормальную форму хозяйского белка в прионную. Этим начинается цепь реакций, где каждый прионный белок перестраивает многие хозяйские белки в прионы, и эти новые прионы, в свою очередь, также переделывают даже большее число белков в прионы. Все известные прионные заболевания смертельны. Хотя прионы фундаментально отличаются от вирусов и вироидов, их открытие даёт основание для теории, согласно которой вирусы могли произойти от самовоспроизводящихся молекул[60].
Следует также отметить, что некоторые вирусные белки не обнаруживают гомологии с белками бактерий, архей и эукариот, что свидетельствует о сравнительно давнем обособлении этой группы.
Микробиология
Вирусы как форма жизни
Существует два мнения на эту проблему. Согласно первому, вирусы представляют собой форму жизни, а второе гласит, что они являются органическими структурами, взаимодействующими с живыми организмами. Их характеризовали как «организмы на границе живого»[21]. Вирусы схожи с живыми организмами в том, что они имеют свой набор генов и эволюционируют путём естественного отбора[61], а также в том, что они способны размножаться, создавая собственные множественные копии путём самосборки. Хотя они имеют гены, они лишены клеточного строения, а эту черту нередко рассматривают как фундаментальное свойство живой материи. У вирусов нет собственного обмена веществ, а для образования новых веществ им необходима хозяйская клетка. По этой причине они не способны размножаться вне хозяйской клетки[62], хотя такие бактерии, как риккетсии и хламидии, несмотря на это, считаются живыми организмами[63][64]. Общепринятые формы жизни для размножения используют клеточное деление (которое обеспечивается чётко отрегулированными клеточными циклами), в то время как вирусы запускают самопроизвольную сборку вирусных частиц в хозяйской клетке. Тем не менее, они отличаются от простого независимого роста кристаллов тем, что наследуют генетические мутации, будучи объектами естественного отбора. Самосборка вирусных частиц в клетках даёт почву для изучения механизма происхождения жизни, так как даёт дополнительное подкрепление гипотезы, что жизнь могла начаться в виде самособирающихся органических молекул[3].
Структура

А. Вирус, не имеющий липидной оболочки (например, пикорнавирус).
B. Оболочечный вирус (например, герпесвирус).
Цифрами обозначены: (1) капсид, (2) геномная нуклеиновая кислота, (3) капсомер, (4) нуклеокапсид, (5) вирион, (6) липидная оболочка, (7) мембранные белки оболочки.
Вирусы демонстрируют огромное разнообразие форм и размеров. В общем, вирусы значительно мельче бактерий. Большинство изученных вирусов имеют диаметр в пределах от 20 до 300 нм. Некоторые филовирусы имеют суммарную длину до 1400 нм, но их диаметр составляет лишь 80 нм[65]. Большинство вирусов невозможно увидеть в световой микроскоп, поэтому, чтобы увидеть вирионы, используют электронные сканирующие и транслирующие микроскопы[66]. Чтобы вирусы резко выделялись от окружающего фона, применяют метод электроноплотных «пятен». Они представляют собой растворы солей тяжёлых металлов, таких как вольфрам, которые рассеивают электроны на покрываемой поверхности. Когда вирионы покрыты «пятном» (положительное контрастирование), их детали видны хорошо. В случае отрицательного контрастирования контрастируют только фон[67].
Зрелая вирусная частица, известная как вирион, состоит из нуклеиновой кислоты, покрытой защитной белковой оболочкой – капсидом. Капсид складывается из одинаковых белковых субъединиц, называемых капсомерами[68]. Вирусы могут также иметь липидную оболочку поверх капсида (суперкапсид), образованную из мембраны хозяйской клетки. Капсид состоит из белков, кодируемых вирусным геномом, а его форма лежит в основе различения вирусов по морфологическому признаку[69][70]. Кодируемые вирусом белки в процессе самосборки объединяются, формируя капсид, но для этого им необходим вирусный геном. Комплексные вирусы, кроме того, кодируют специальные белки, помогающие в сборке капсида. Белки, объединяющиеся с нуклеиновыми кислотами, известны как нуклеопротеины, а само объединение белков вирусного капсида с вирусной нуклеиновой кислотой называется нуклеокапсидом. Капсид и структуру вируса в целом можно механически (физически) исследовать при помощи сканирующего атомно-силового микроскопа[71][72].
Форма
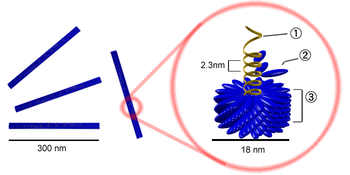
Цифрами обозначены: (1) РНК-геном вируса, (2) капсомер, состоящий всего из одного протомера, (3) зрелый участок капсида.
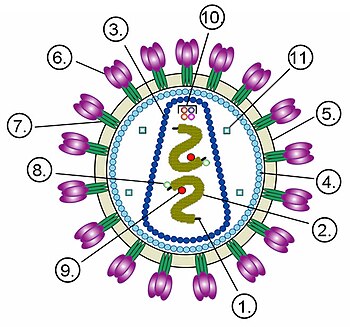
Цифрами обозначены: (1) РНК-геном вируса, (2) нуклеокапсид, (3) капсид, (4) белковый матрикс, подстилающий (5) липидную мембрану, (6) gp120 — гликопротеин, с помощью которого происходит связывание вируса с клеточной мембраной, (7) gp41 —гликопротеин.
Цифрами 8—11 обозначены белки, входящие в состав вириона и необходимые вирусу на ранних стадиях инфекции: (8) — интеграза, (9) — обратная транскриптаза, (10) — Vif, Vpr, Nef и p7, (11) — протеаза.
В целом, существует четыре морфологических типа капсидов вирусов:
- Спиральные
Эти вирусы состоят из одного типа капсомеров, сложенных вокруг центральной оси, образуя спиральную структуру, которая может иметь в центре углубление или полую трубку. Такая организация встречается у веревковидных и нитевидных вирусов: они могут быть очень короткими и плотными или длинными и очень гибкими. Генетический материал, как правило, представлен одноцепочечной РНК (в некоторых случаях – одноцепочечной ДНК) и удерживается в белковой спирали взаимодействиями между отрицательными зарядами на нуклеиновых кислотах и положительными зарядами на белках. В целом, длина спирального капсида зависит от длины окружённой им нуклеиновой кислоты, а диаметр определяется размером и расположением капсомеров. Примером спирального вируса может служить вирус табачной мозаики[73].
- Икосаэдрические

Большинство вирусов животных имеют икосаэдрическую или почти сферическую форму с икосаэдрической симметрией. Правильный икосаэдр является оптимальной формой для закрытого капсида, сложенного из одинаковых субъединиц. Минимальное необходимое число одинаковых капсомеров – 12, каждый капсомер состоит из пяти идентичных субъединиц. Многие вирусы, такие как ротавирус, имеют более двенадцати капсомеров и приобретают сферическую форму, но с сохранением икосаэдрической симметрии. Капсомеры, находящиеся в вершинах, окружены пятью другими капсомерами и называются пентонами. Капсомеры с треугольных граней имеют 6 соседей-капсомеров и называются гексонами[74]. Гексоны, по существу, являются плоскими, а пентоны, образущие 12 вершин, - изогнутыми. Один и тот же белок может выступать субъединицей и пентомеров, и гексамеров, или же они состоят из различных белков.
- Продолговатые
Эти капсиды представляют икосаэдры, вытянутые вдоль оси, большей обычной в пять раз и как правило располагаются в головках бактериофагов[75].
- Комплексные
Эти вирусы имеют капсиды ни чисто спиральной, ни чисто икосаэдрической формы, а также могут образовывать наружные структуры, такие как белковые хвосты или комплексные наружные стенки. Некоторые бактериофаги, такие как фаг Т4, имеют комплексную структуру, состоящую из икосаэдрической головки, соединённой со спиральным хвостом, который может иметь шестигранное основание с торчащими наружу белковыми нитями. Этот хвост действует наподобие молекулярного шприца, прикрепляясь к хозяйской бактериальной клетке и затем впрыскивая вирусный геном в клетку[76].
Вирусная оболочка

Некоторые вирусы сооружают себе оболочку из модифицированной клеточной мембраны (наружной мембраны, окружающей инфицированную клетку, или внутренней, такой как ядерная мембрана или эндоплазматический ретикулум), приобретая, таким образом, поверх капсида двойной слой липидов, известный как вирусная оболочка (суперкапсид). Эта мембрана испещрена белками, кодируемыми вирусными геномом и хозяйским геномом; сама же липидная мембрана, в также любые углеводы происходят целиком из хозяйской клетки. Такую стратегию использую вирус гриппа и ВИЧ. Инфективность большинства вирусов, имеющих оболочку, зависит от неё[77].
Поксвирусы представляют собой крупные комплексные вирусы с необычной морфологией. Вирусный геном связан с белками в центральной дисковидной структуре, известной как нуклеоид. Нуклеоид окружён мембраной и двумя боковыми телами неизвестной функции. Вирус имеет наружную оболочку с толстым белковым слоем, прилегающим к поверхности. Весь вирион слегка плейоморфен (то есть способен изменять форму и размер в зависимости от условий) и может принимать форму от овальной до блоковидной[78]. Мимивирус является крупнейшим описанными вирусом, с капсидом диаметром 400 нм. Белковые филаменты, отходящие от поверхности, достигают 100 нм в длину. В электронный микроскоп его капсид выглядит шестиугольным, поэтому, возможно, он имеет икосаэдрическую форму[79]. В 2011 году исследователи обнаружили ещё более крупный вирус на океаническом дне вблизи побережья Чили. Первоначально названный Megavirus chilensis, он может быть виден даже в обычный оптический микроскоп[80].
Геном
| Свойства | Параметры |
|---|---|
| Нуклеиновая кислота |
|
| Форма |
|
| Количество цепей |
|
| Полярность |
|
У вирусов наблюдается огромное разнообразие структур геномов; как у группы, у них наблюдается большее геномное разнообразие, чем у растений, животных, архей или бактерий. Существуют миллионы различных типов вирусов[6], но только 5000 из них были детально описаны[5]. Вирус, содержащий только ДНК или только РНК, называется ДНК-содержащим и РНК-содержащим вирусом соответственно. Подавляющее большинство вирусов содержат РНК. Вирусы растений чаще всего имеют одноцепочечную РНК, а бактериофаги, как правило, обладают двухцепочечными ДНК[81].
Вирусный геном может быть кольцевым, как у полиомавирусов, или линейным, как у аденовирусов. Тип нуклеиновой кислоты не имеет отношения к форме генома. У РНК-содержащих вирусов и некоторых ДНК-содержащих вирусов геном часто разделён на отдельные части, в связи с чем он называется сегментированным. У РНК-вирусов каждый сегмент часто кодирует только один белок, и они обычно встречаются вместе под одним капсидом. Однако всем сегментам вовсе не обязательно быть в одном вирионе, чтобы вирус был заразным, как это демонстрируют вирус бромной мозаики и некоторые другие растительные вирусы[65].
Вирусный геном, в независимости от типа нуклеиновый кислоты, бывает либо одноцепоченым, либо двухцепочечным. Одноцепочечный геном состоит из неспаренной нуклеиновой кислоты, аналогично одной половинке лестницы, распиленной посередине. Двухцепочечный геном включает пару комплементарных нуклеиновых кислот (по аналогии с лестницей он представляет собой целую лестницу). Вирусы некоторых семейств, как, например, представители семейства Hepadnaviridae, содержат частично одноцепочечный и частично двуцепочечный геном[81].
Для большинства РНК-содержащих вирусов и некоторых вирусов с одноцепочечной ДНК одиночные цепи определяют как положительной (плюс-цепь) или отрицательной (минус-цепь) полярности в зависимости от того, комплементарны ли они вирусной мРНК. Положительная вирусная РНК имеет тот же знак, что и вирусная мРНК, а потому по меньшей мере часть её может незамедлительно начать транслироваться хозяйской клеткой. Отрицательная вирусная РНК комплементарна мРНК, поэтому до начала трансляции она должна быть «переделана» в положительную РНК при помощи фермента РНК-зависимой РНК-полимеразы. Номенклатура для одноцепочечных ДНК-содержащих вирусов сходна с таковой для РНК: кодирующая цепь комплементарна мРНК (-), а некодирующая является её копией (+)[81]. Однако несколько типов одноцепочечных ДНК- и РНК-содержащих вирусов имеют двойную полярность, то есть транскрипции может подвергаться любая цепь. Таковы, например, геминивирусы, одноцепочечные ДНК-содержащие вирусы растений, и аренавирусы, одноцепочечные РНК-содержащие вирусы животных[82].
Размер генома широко варьирует у различных видов. Наименьший вирусный геном у одноцепочечного ДНК-содержащего цирковируса, семейство Circoviridae. Его геном кодирует лишь два белка и содержит только 2000 пар оснований. Самый крупный геном у мимивируса, он содержит свыше 1,2 млн пар оснований и кодирует более тысячи белков[83]. В общем, РНК-содержащие вирусы имеют меньший геном, чем ДНК-содержащие, из-за большего количества ошибок во время репликации, и наибольший размер генома у них, таким образом, ограничен[39] . Не будь его, ошибки в геноме во время репликации сделали бы вирус нежизнеспособным и неконкурентоспособным. Чтобы скомпенсировать это, РНК-вирусы часто имеют сегментированные геномы (геном разделён на небольшие молекулы) — это уменьшает вероятность того, что ошибка в одном из сегментов окажется фатальна для всего генома. Напротив, ДНК-содержащие вирусы обычно имеют более крупные геномы благодаря лучшей работе их ферментов, осуществляющих репликацию[84]. Одноцепочечные ДНК-содержащие вирусы являются исключением из этого правила — количество мутаций в их геномах приближается к таковому у одноцепочечных РНК-содержащих вирусов[85].
Генетические изменения происходят у вирусов по разным механизмам. В их число входит дрейф генов, при котором отдельные основания в РНК или ДНК мутируют в другие. Большинство этих точечных мутаций являются «тихими» — они не меняют белок, кодируемый генами, но в других случаях в результате таких изменений вирус может приобрести эволюционные преимущества, такие как устойчивость к противовирусным препаратам[86]. Антигенное перемещение имеет место тогда, когда в геноме вируса происходят масштабные изменения. Это может быть результатом рекомбинации или реассортимента – перемешивания генов. Когда это случается с вирусом гриппа, результатом может стать пандемия[87]. РНК-вирусы часто существуют как квазивиды или смесь вирусов одного вида, но с чуть различающимися нуклеотидными последовательностями в геноме. Такие квазивиды являются главной мишенью для естественного отбора[88].
Сегментированный геном даёт эволюционные преимущества; различные штаммы вируса с сегментированными геномами могут перетасовывать и комбинировать гены и производить потомков с уникальными характеристиками. Это называется вирусным реассортиментом[89].
Генетическая рекомбинация — это процесс, при котором цепь ДНК разрывается, и обрывки потом присоединяются к концам различных молекул ДНК. Это может происходить, когда вирусы поражают клетку одновременно. Изучения эволюции вирусов показали, что у изученных видов рекомбинация имела широкое распространение[90]. Рекомбинация характерна как для РНК-, так и для ДНК-содержащих вирусов[91][92].
Жизненный цикл

Вирусы не размножаются клеточным делением, поскольку не имеют клеточного строения. Вместо этого они используют метаболизм и аппарат хозяйской клетки для образования множественных копий самих себя, и их сборка происходит внутри клетки.
Условно процесс вирусного инфицирования в масштабах одной клетки можно разбить на несколько взаимоперекрывающихся этапов:
- Прикрепление к клеточной мембране — так называемая адсорбция. Включает образование специфической связи между белками вирусного капсида и специфическими рецепторами на поверхности хозяйской клетки. Специфичность определяется тем, насколько много хозяев может быть у вируса. Например, ВИЧ поражает только человеческие лейкоциты. Это связано с тем, что оболочечный гликопротеин gp120 специфически взаимодействует с молекулой CD4 — хемокиновым рецептором, который обычно встречается на поверхности CD4+ T-лимфоцитов. Этот механизм появился для того, чтобы вирус инфицировал только клетки, способные осуществить их репликацию. Прикрепление к рецептору вызывает растворение вирусной оболочки или изменения в не покрытых оболочкой поверхностных белках вируса, благодаря которым вирус может проникнуть в клетку.
- Проникновение в клетку. На следующем этапе вирусу необходимо доставить внутрь клетки свою генетическую информацию. Некоторые вирусы переносят также собственные белки, необходимые для её реализации (особенно это характерно для вирусов, содержащих негативные РНК). Различные вирусы для проникновения в клетку используют разные стратегии: например, пикорнавирусы впрыскивают свою РНК через плазматическую мембрану, а вирионы ортомиксовирусов захватываются клеткой в ходе эндоцитоза, попадают в кислую среду лизосом, где происходит их окончательное созревание (депротеинизация вирусной частицы), после чего РНК в комплексе с вирусными белками преодолевает лизосомальную мембрану и попадает в цитоплазму. Вирусы также различаются по локализации их репликации, часть вирусов (например, те же пикорнавирусы) размножается в цитоплазме клетки, а часть (например, ортомиксовирусы) в её ядре. Инфекции растительных и грибных клеток отличаются от таковых у животных клеток. Растения имеют прочную клеточную стенку, состоящую из целлюлозы, а грибы – из хитина, так что большинство вирусов могут проникнуть в них только после повреждения клеточной стенки[93]. Однако почти все вирусы растений (включая вирус табачной мозаики) могут двигаться от клетки к клетке в форме одноцепочечных нуклеопротеиновых комплексов через поры, именуемые плазмодесмами[94]. Бактерии, как и растения, имеют крепкую клеточную стенку, которую вирусу, чтобы попасть внутрь, приходится повредить. Но в связи с тем, что клеточная стенка бактерий намного тоньше таковой у растений из-за их очень малых размеров, у некоторых вирусов появились механизмы, впрыскивающие вирусный геном в бактериальную клетку через клеточную стенку, в то время как капсид остаётся снаружи[95].
- Лишение оболочек представляет собой процесс, в ходе которого вирус лишается капсида. Это достигается при помощи вирусных ферментов или ферментов хозяйской клетки, а может быть и результатом простой диссоциации. В конечном счёте вирусная геномная нуклеиновая кислота освобождается.
- Перепрограммирование клетки. При заражении вирусом в клетке активируются специальные механизмы противовирусной защиты. Заражённые клетки начинают синтезировать сигнальные молекулы — интерфероны, переводящие окружающие здоровые клетки в противовирусное состояние и активирующие системы иммунитета. Повреждения, вызываемые размножением вируса в клетке, могут быть обнаружены системами внутреннего клеточного контроля, и такая клетка должна будет «покончить жизнь самоубийством» в ходе процесса, называемого апоптозом или программируемой клеточной смерти. От способности вируса преодолевать системы противовирусной защиты напрямую зависит его выживание. Неудивительно, что многие вирусы (например, пикорнавирусы, флавивирусы) в ходе эволюции приобрели способность подавлять синтез интерферонов, апоптозную программу и так далее. Кроме подавления противовирусной защиты, вирусы стремятся создать в клетке максимально благоприятные условия для развития своего потомства. Хрестоматийным примером перепрограммирования систем клетки-хозяина является трансляция РНК энтеровирусов (семейство пикорнавирусы). Вирусная протеаза расщепляет клеточный белок eIF4G, необходимый для инициации трансляции подавляющего большинства клеточных мРНК (транслирующихся по так называемому кэп-зависимому механизму). При этом инициация трансляции РНК самого вируса происходит другим способом (IRES-зависимый механизм), для которого вполне достаточно отрезанного фрагмента eIF4G. Таким образом, вирусные РНК приобретают эксклюзивные «права» и не конкурируют за рибосомы с клеточными.
- Персистенция. Некоторые вирусы могут переходить в латентное состояние (так называемая персистенция для вирусов эукариот или лизогения для бактериофагов — вирусов бактерий), слабо вмешиваясь в процессы, происходящие в клетке, и активироваться лишь при определённых условиях. Так построена, например, стратегия размножения некоторых бактериофагов — до тех пор, пока заражённая клетка находится в благоприятной среде, фаг не убивает её, наследуется дочерними клетками и нередко интегрируется в клеточный геном. Однако при попадании заражённой лизогенным фагом бактерии в неблагоприятную среду, возбудитель захватывает контроль над клеточными процессами так, что клетка начинает производить материалы, из которых строятся новые фаги (так называемая литическая стадия). Клетка превращается в фабрику, способную производить многие тысячи фагов. Зрелые частицы, выходя из клетки, разрывают клеточную мембрану, тем самым убивая клетку. С персистенцией вирусов (например, паповавирусов) связаны некоторые онкологические заболевания.
- Репликация у вирусов включает, прежде всего, умножение генома. Репликация состоит из синтеза вирусной мРНК по «начальным» генам (с исключениями для положительных РНК-содержащих вирусов), синтез вирусного белка, возможно, соединение вирусных белков, затем следует репликация вирусного генома, запускаемая экспрессией генов, кодирующих начальные или регуляторные белки. Вслед за этим может последовать (у комплексных вирусов с крупными геномами) ещё один или несколько кругов дополнительного синтеза мРНК: «поздняя» экспрессия генов приводит к синтезу, по сути, структурных или вирионных белков.
- Вслед за этим происходит самосборка вирусных частиц, позже происходят некоторые модификации белков. У вирусов, таких как ВИЧ, такая модификация (иногда называемая созреванием) происходит после выхода вируса из хозяйской клетки[96].
- Выход из клетки. Вирусы могут покинуть клетку после лизиса, процесса, в ходе которого клетка погибает из-за разрыва мембраны и клеточной стенки, если такая есть. Эта особенность есть у многих бактериальных и некоторых животных вирусов. Некоторые вирусы подвергаются лизогенному циклу, где вирусный геном включается путём генетической рекомбинации в специальное место хромосомы клетки-хозяйки. Тогда вирусный геном называется провирусом, или, в случае бактериофага, профагом[97]. Когда клетка делится, вирусный геном также удваивается. В пределах клетки вирус в основном не проявляет себя; однако в некоторый момент провирус или профаг может вызвать активацию вируса, который может вызвать лизис хозяйских клеток[98].
Следует сказать, что активно размножающийся вирус не всегда убивает клетку-хозяина. Оболочечные вирусы, в том числе ВИЧ, обычно отделяются от клетки путём отпочковывания. В ходе этого процесса вирус обзаводится своей оболочкой, которая представляет собой модифицированный фрагмент хозяйской клеточной мембраны или другой внутренней мембраны[99]. Таким образом, клетка может продолжать жить и продуцировать вирус.
Особенности жизненного цикла различных групп вирусов
Генетический материал заключён в вирусных частицах, и способ, который используется для репликации, значительно отличается у различных вирусов.
- ДНК-содержащие вирусы. Репликация генома у большинства ДНК-содержащих вирусов происходит в клеточном ядре. Если клетка имеет соотвествующий рецептор на своей поверхности, эти вирусы поступают в клетку либо путём непосредственного слияния с клеточной мембраной (напр. вирус герпеса), либо – что бывает чаще — через эндоцитоз через рецептор. Большинство ДНК-вирусов полностью зависят от аппарата синтеза ДНК или РНК хозяйской клетки и аппарата процессинга РНК. Однако вирусы с крупными геномами могут сами кодировать большую часть белков, входящих в состав этих аппаратов. У эукариот вирусному геному, чтобы попасть в этот аппарат, нужно пересечь ядерную мембрану клетки, в то время как у бактерий ему достаточно просто проникнуть в клетку[100].
- РНК-содержащие вирусы. Репликация обычно происходит в цитоплазме. РНК-вирусы можно подразделить на 4 группы в зависимости от способа их репликации. Полярность (то, может ли или нет цепь нуклеиновой кислоты непосредственно использоваться рибосомами для синтеза РНК) у одноцепочечных РНК-вирусов сильно определяет механизм репликации. Другим важным критерием служит то, является ли геном одноцепочечным или двуцепочечным. Все РНК-вирусы используют собственный фермент РНК-репликазу для создания копий своих геномов[101].
- Вирусы, использующие обратную транскрипцию. Эти вирусы имеют одноцепочечную РНК (Retroviridae, Metaviridae, Pseudoviridae) или двуцепочечную ДНК (Caulimoviridae и Hepadnaviridae) в своих частицах. Вирусы с обратной транскрипцией, имеющие РНК в геномах (ретровирусы), используют промежуточную ДНК для репликации, а содержащие ДНК (параретровирусы) – промежуточную РНК. В обоих случаях используется фермент обратная транскриптаза, или РНК-зависимая ДНК-полимераза. Этот фермент осуществляет обращение нуклеиновой кислоты. Ретровирусы присоединяются к ДНК, создаваемой в процессе обратной транскрипции в хозяйском геноме, как провирусы в качестве части репликационного процесса. Параретровирусы же этого не делают, хотя объединённые копии геномов, особенно растительных параретровирусов, могут вызвать инфекцию[102]. Они восприимчивы к противововирусным аппаратам, подавляющим обратную транскриптазу, в том числе к зидовудину и ламивидину. К первой группе относится ВИЧ, он является ретровирусом. Во вторую же группу включаются вирусы семейства Hepadnaviridae, в которое входит вирус гепатита B[103].
Действие на хозяйскую клетку
Диапазон структурных и биохимических эффектов, оказываемых вирусом на хозяйскую клетку, очень широк[104]. Они называются цитопатическими эффектами[105]. Большинство вирусных инфекций являются результатом гибели хозяйских клеток. Причинами гибели могут быть клеточный лизис, изменения поверхности клеточной мембраны и апоптоз[106]. Часто гибель клетки вызывается прекращением её нормальной активности из-за подавления её специфическими для каждого вируса белками, не все из которых входят в состав вирусной частицы[107].
Некоторые вирусы не вызывают никаких видимых изменений в поражённой клетке. Клетки, в которых вирус находится в состоянии латентности и инактивирован, имеют мало признаков инфекции и нормально функционируют[108]. Это является причиной хронических инфекций, и вирус при них бездействует многие месяцы или годы. Так часто бывает, например, с вирусом герпеса[109][110]. Некоторые вирусы, например вирус Эпштейна-Барр, может вызывать быстрое размножение клеток без появления злокачественности[111], в то время как другие, такие как папилломавирусы, могут вызвать рак[112].
Диапазон хозяев
Вирусы, несомненно, являются самой многочисленной формой жизни на Земле, и по этому показателю они превосходят все организмы, вместе взятые[113] . Они поражают все типы клеточных организмов, включая животных, растений, бактерий и грибов[5]. Тем не менее, различные типы вирусов могут поражать только ограниченный диапазон хозяев, многие вирусы видоспецифичны. Некоторые, как, например, вирус оспы, могут поражать только один вид – в данном случае людей[114]. Тогда говорят, что вирус имеет узкий ряд хозяев. Другие вирусы, как, например, вирус бешенства, может поражать различные виды млекопитающих, то есть, он имеет широкий ряд хозяев[115]. Вирусы растений безвредны для животных, а большинство вирусов остальных животных безопасны для человека[116]. Диапазон хозяев некоторых бактериофагов ограничивается одним штаммом бактерий, и они могут использоваться для мечения вызывающих вспышки инфекций бактерий методом, называемым фаговым мечением[117].
Классификация
В таксономии живой природы вирусы выделяются в отдельный таксон Vira, образующий в классификации Systema Naturae 2000 вместе с доменами Bacteria, Archaea и Eukaryota корневой таксон Biota. В течение XX века в систематике выдвигались предложения о создании выделенного таксона для неклеточных форм жизни (Aphanobionta Novak, 1930; надцарство Acytota Jeffrey, 1971; Acellularia), однако такие предложения не были кодифицированы.
Главной задачей классификации является описание разнообразия вирусов и группировка их на основании общих свойств. В 1962 году Андре Львов, Роберт Хорн и Пауль Турнье были первыми, кто разработал основные принципы классификации вирусов на основании Линнеевской иерархической системы[118]. Основными таксонами в этой системе являются царство, класс, порядок, семейство, род и вид. Вирусы были разделены на группы по общим свойствам (но не таковым у их хозяев) и типу нуклеиновых кислот в геномах[119]. Позднее был создан Международный комитет по таксономии вирусов. Однако в таксономии вирусов не применяются понятия «класс» и «царство», поскольку их малый размер генома и высокая доля мутаций делает сложным объединить их в группы старше порядка. По существу, классификация вирусов по Балтимору является дополнением более традиционной классификации.
Систематику и таксономию вирусов в настоящий момент кодифицирует и поддерживает Международный Комитет по Таксономии Вирусов (International Committee on Taxonomy of Viruses, ICTV), поддерживающий также и таксономическую базу The Universal Virus Database ICTVdB.
Классификация ICTV
Международный комитет по таксономии вирусов разработал современную классификацию вирусов и выделил основные свойства вирусов, имеющие больший вес для классификации с сохранением единообразия семейств.
Была разработана объединённая таксономия (универсальная система для классификации вирусов). Седьмой отчёт ICTV закрепил для первых пор понятие о виде вируса как о низшем таксоне в иерархии вирусов[120]. Однако к настоящему моменту была изучена лишь небольшая часть от общего разнообразия вирусов, анализ образцов вирусов из человеческого организма выявил, что около 20% последовательностей вирусных нуклеиновых кислот ещё не было рассмотрено ранее, а образцы из окружающей среды, например, морской воды и океанского дна, показали, что подавляющее большинство последовательностей являются совершенно новыми[121].
Основными таксономическими единицами являются:
- Отряд (-virales)
- Семейство (-viridae)
- Подсемейство (-virinae)
- Семейство (-viridae)
Современная классификация ICTV (2011) включает 6 порядков вирусов: Caudovirales, Herpesvirales, Mononegavirales, Nidovirales, Picornavirales и Tymovirales. Существование седьмого порядка, Ligamenvirales, пока ещё было только предположено. Классификация не выделяет подвиды, штаммы и изоляты. Всего насчитывается 6 порядков, 87 семейств, 19 подсемейств, 349 родов, около 2284 видов и свыше 3000 ещё не классифицированных вирусов[122][123][124].
Классификация по Балтимору

Лауреат Нобелевской премии биолог Дейвид Балтимор разработал классификацию вирусов по Балтимору[35][125]. Классификация ICTV в настоящее время объединяется с классификацией по Балтимору, составляя современную систему классификации вирусов[126][127][128].
Классификация вирусов по Балтимору основывается на механизме образования мРНК. Вирусы должны синтезировать мРНК из собственных геномов для образования белков и репликации своей нуклеиновой кислоты, однако каждое семейство вирусов имеет собственный механизм осуществления этого. Вирусные геномы могут быть одноцепоченые (оц) или двухцепочечные (дц), ДНК- или РНК-содержащие, могут использовать или не использовать обратную транскриптазу. Кроме того, одноцепочечные РНК-вирусы могут иметь положительную (+) или отрицательную (-) цепь РНК в составе своего генома.
Эта система включает в себя семь основных групп[125][35]:
- (I) Вирусы, содержащие двуцепочечную ДНК и не имеющие РНК-стадии (например, герпесвирусы, поксвирусы, паповавирусы, мимивирус).
- (II) Вирусы, содержащие одноцепочечную молекулу ДНК (например, парвовирусы). В этом случае ДНК всегда положительной полярности.
- (III) Вирусы, содержащие двуцепочечную РНК (например, ротавирусы).
- (IV) Вирусы, содержащие одноцепочечную молекулу РНК положительной полярности (например, пикорнавирусы, флавивирусы).
- (V) Вирусы, содержащие одноцепочечную молекулу РНК негативной или двойной полярности (например, ортомиксовирусы, филовирусы).
- (VI) Вирусы, содержащие одноцепочечную положительную молекулу РНК и имеющие в своем жизненном цикле стадию синтеза ДНК на матрице РНК, ретровирусы (например, ВИЧ).
- (VII) Вирусы, содержащие двуцепочечную ДНК и имеющие в своём жизненном цикле стадию синтеза ДНК на матрице РНК, ретроидные вирусы (например, вирус гепатита B).
Дальнейшее деление производится на основе таких признаков как структура генома (наличие сегментов, кольцевая или линейная молекула), генетическое сходство с другими вирусами, наличие липидной оболочки, таксономическая принадлежность организма-хозяина и так далее.
Роль вирусов в биосфере
Вирусы являются одной из самых распространённых форм существования органической материи на планете по численности. Они играют важную роль в регуляции численности популяций некоторых видов живых организмов (например, вирус дикования с периодом в несколько лет сокращает численность песцов в несколько раз).
Иногда вирусы образуют с животными симбиоз[129][130]. Так, например, яд некоторых паразитических ос содержит структуры, называемые поли-ДНК-вирусами (Polydnavirus, PDV), имеющие вирусное происхождение.
Однако основная роль вирусов в биосфере всё-таки связана с их деятельностью в водах океанов и морей.
Роль в водных экосистемах
Чайная ложка морской воды содержит около миллиона вирусов[131]. Они необходимы для регуляции пресноводных и морских экосистем[132]. Большая часть этих вирусов является бактериофагами, безвредными для растений и животных. Они поражают и разрушают бактерии в водном микробном сообществе, таким образом, участвуя в важном процессе круговорота углерода в морской среде. Органические молекулы, освободившиеся из бактериальных клеток благодаря вирусам, стимулируют рост новых бактерий и водорослей[133].
Микроорганизмы составляют более 90% биомассы в море. Было приблизительно установлено, что каждый день вирусы убивают около 20% этой биомассы, а количество вирусов в океанах в 15 раз превышает число бактерий и архей. Вирусы являются главными агентами, вызывающими быстрое прекращение цветения воды[134], убивающего другую жизнь в море[135], за счёт гибели вызывающих его водорослей. Численность водорослей убывает в направлении от берега и с увеличением глубины, поскольку там меньше хозяйских организмов[136].
Значение морских вирусов очень велико. Регулируя процесс фотосинтеза, они играют второстепенную роль в сокращении количества углекислого газа в атмосфере приблизительно на 3 гигатонны углерода в год[136].
Как и другие организмы, морские млекопитающие восприимчивы к вирусным инфекциям. В 1988 и 2002 годах тысячи обыкновенных тюленей были убиты парамиксовирусом Phocine distemper virus[137]. В популяциях морских млекопитающих циркулирует множество других вирусов, в том числе калицивирусы, герпесвирусы, аденовирусы и парвовирусы[136].
Роль в эволюции
Вирусы являются важным естественным средством переноса генов между различными видами, что вызывает генетическое разнообразие и направляет эволюцию[10]. Считается, что вирусы сыграли центральную роль в ранней эволюции, ещё до расхождения бактерий, архей и эукариот во времена последнего универсального общего предка жизни на Земле[138]. Вирусы и по сей день остаются одним из крупнейших живых хранилищ неисследованного генетического разнообразия на Земле[136].
Вирусы имеют генетические связи с представителями флоры и фауны Земли. Согласно последним исследованиям, геном человека более чем на 32 % состоит из информации, кодируемой вирус-подобными элементами и транспозонами. С помощью вирусов может происходить так называемый горизонтальный перенос генов (ксенология), то есть передача генетической информации не от непосредственных родителей к своему потомству, а между двумя неродственными (или даже относящимися к разным видам) особями. Так, в геноме высших приматов существует ген, кодирующий белок синцитин, который, как считается, был привнесён ретровирусом.
Применение
В науках о жизни и медицине

Вирусы имеют важное значение для исследований в молекулярной и клеточной биологии, так как они представляют собой простые системы, которые можно использовать для управления и изучения функций клеток[139]. Изучение и использование вирусов дало ценную информацию о различных аспектах клеточной биологии[140]. К примеру, вирусы применялись в генетических исследованиях, и они помогли нам прийти к пониманию ключевых механизмов молекулярной генетики, как то: репликация ДНК, транскрипция, процессинг РНК, трансляция, транспорт белков.
Генетики часто используют вирусы как векторы для ввода генов в изучаемые клетки. Это позволяет заставить клетку производить чуждые вещества, а также изучить эффект от ввода нового гена в геном. Аналогично в виротерапии вирусы используют как векторы для лечения различных болезней, так как они избирательно действуют на клетки и ДНК. Это даёт надежды, что вирусы смогут помочь в борьбе с раком и найдут своё применение в генотерапии. Некоторое время восточноевропейские учёные прибегали к фаговой терапии как к альтернативе антибиотикам, и интерес к таким методам возрастает, поскольку в настоящее время у некоторых патогенных бактерий обнаружена высокая устойчивость к антибиотикам[141].
Образование клетками ксеногенных (т.е. чужеродных) белков под влиянием вирусов лежит в основе нескольких современных промышленных способов получения белков, например, антигенов и антител для вакцин. Недавно промышленным способом были получены некоторые вирусные векторы и лекарственные белки, в настоящее время они проходят клинические и доклинические испытания[142].
В материаловедении и нанотехнологиях
Современные тренды в нанотехнологиях обещают принести значительно более разностороннее применение вирусам. С точки зрения материаловедов, вирусы можно рассматривать как органические наночастицы. Их поверхность несёт специальные приспособления, предназначенные для пересечения биологических барьеров хозяйской клетки. Точно определены форма и размер вирусов, а также количество и природа функциональных групп на их поверхности. По существу, вирусы часто используются в материаловедении как «подмости» для ковалентно связанных поверхностных модификаций. Одним из примечательных качеств вирусов является то, что они специально «подогнаны» направленной эволюцией под хозяйские клетки. Мощные методы, разработанные биологами, легли в основу инженерных приёмов в наноматериалах, открыв тем самым широкую сферу применения вирусов, выходящую далеко за пределы биологии и медицины[143].
Из-за своих размеров, формы и хорошо изученной химической структуры вирусы использовались как шаблоны для организации материалов на наноуровне. Примером такой недавней работы могут служить исследования, проведённые Исследовательской лабораторией Наваля в Вашингтоне (округ Колумбия) с использованием вируса мозаики коровьего гороха (англ. Cowpea Mosaic Virus (CPMV)) для усиления сигналов в сенсорах с ДНК-микрочипами. В данном случае вирусные частицы разделяли частицы флуоресцентных красителей, которые использовались для передачи сигнала, предотвращая, таким образом, скопление нефлуоресцентных димеров, выступающих как гасители сигнала[144]. Другим примером использования CPMV является применение его как наноразмерного образца для молекулярной электроники[145].
Искусственные вирусы
Многие вирусы могут быть получены de novo, то есть с нуля, а первый искусственный вирус был получен в 2002 году[146]. Несмотря на некоторые неправильные трактовки, при этом синтезируется не сам вирус как таковой, а его ДНК-геном (в случае ДНК-вирусов) или комплементарная ДНК-копия его генома (в случае РНК-вирусов). У многих семейств вирусов голая искусственная ДНК или РНК (последняя получается путём обратной переделки синтетической комплементарной ДНК), будучи введённой в клетку, проявляет инфекционные свойства. Иными словами, они содержат всю необходимую информацию для образования новых вирусов. Эта технология в настоящее время используется для разработки вакцин нового типа[147]. Возможность создавать искусственные вирусы имеет далеко идущие последствия, поскольку вирус не может вымереть, пока известна его геномная последовательность и имеются чувствительные к нему клетки. В наши дни полные геномные последовательности 2408 различных вирусов (в том числе оспы) находятся в публичном доступе в онлайн-базе данных, поддерживаемой Национальные институты здравоохранения США[148].
Вирусы как оружие
Способность вирусов вызывать опустошительные эпидемии среди людей порождает беспокойство, что вирусы могут использоваться как биологическое оружие. Дополнительные опасения вызвало успешное воссоздание вредоностного вируса гриппа 1918 в лаборатории[149]. Вирус оспы на всём протяжении истории опустошал множество стран вплоть до его окончательного искоренения. Официально образцы вируса оспы хранятся лишь в двух местах в мире — в двух лабораториях в России и США[150]. Опасения, что он может быть использован как оружие, не являются в полной мере беспочвенными[150]; вакцина против оспы иногда имеет тяжёлые побочные эффекты — в последние годы до официально объявленного искоренения вируса больше людей серьёзно заболели из-за вакцины, чем от вируса[151], поэтому вакцинация против оспы больше не практикуется повсеместно[152]. По этой причине большая часть современного населения Земли пррактически не имеет общепризнанной устойчивости к оспе[150].
В массовой культуре
В литературе
В кинематографе
- В фантастическом фильме ужасов «Обитель зла» и его продолжениях. Изобретённый Т-вирус может реанимировать мёртвые клетки и вызывать мутации в организме. Сначала он распространился по Муравейнику, затем по Раккун-сити и по всему миру.
- В фантастическом фильме ужасов «28 дней спустя» и его продолжениях.
- В сюжете фильма-катастрофы «Эпидемия» присутствует вымышленный вирус «мотаба», описание которого напоминает реальный вирус Эбола.
- В фильме «Добро пожаловать в Зомбилэнд».
- В фильме «Лиловый шар».
- В фильме «Носители».
- В фильме «Я — Легенда».
- В фильме «Заражение».
- В фильме «Репортаж».
- В фильме «Карантин».
- В фильме «Карантин 2: Терминал».
- В сериале «Регенезис».
- В телесериале «Сверхъестественное» - вирус кроатон
- В телесериале «Ходячие мертвецы».
- В телесериале «Закрытая школа». Изобретённый вирус произошёл в Китае. Симптомы: кашель с кровью, временная, а затем постоянная потеря зрения, потом смерть. Вирус в некоторых случаях может взаимодействовать с антидотом который его блокирует и вызывать побочные эффекты.
В мультипликации
В последние годы вирусы нередко становятся «героями» мультфильмов и мультсериалов, среди которых следует назвать, например, «Осмозис Джонс» (США), 2001), «Оззи и Дрикс» (США, 2002—2004 гг.) и «Вирус атакует» (Италия, 2011).
Примечания
- ↑ На английском языке. В латинском языке вопрос о множественном числе данного слова является спорным. Слово лат. virus принадлежит редкой разновидности II склонения, словам среднего рода на -us: Nom.Acc.Voc. virus, Gen. viri, Dat.Abl. viro. Так же склоняются лат. vulgus и лат. pelagus; в классической латыни множественное число зафиксировано только у последнего: лат. pelage, форма древнегреческого происхождения, где η<εα.
- ↑ Таксономия вирусов на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ 1 2 Koonin EV, Senkevich TG, Dolja VV (2006). "The ancient Virus World and evolution of cells". Biol. Direct. 1: 29. doi:10.1186/1745-6150-1-29. PMC 1594570. PMID 16984643.
{{cite journal}}: Указан более чем один параметр|pages=and|page=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 Dimmock p. 4
- ↑ 1 2 3 Dimmock p. 49
- ↑ 1 2 Breitbart M, Rohwer F (2005). "Here a virus, there a virus, everywhere the same virus?". Trends Microbiol. 13 (6): 278—84. doi:10.1016/j.tim.2005.04.003. PMID 15936660.
- ↑ Ошибка в сносках?: Неверный тег
<ref>; для сносокLawrenceне указан текст - ↑ Edwards RA, Rohwer F (2005). "Viral metagenomics". Nat. Rev. Microbiol. 3 (6): 504—10. doi:10.1038/nrmicro1163. PMID 15886693.
- ↑ Study of giant viruses shakes up tree of life (англ.)
- ↑ 1 2 Canchaya C, Fournous G, Chibani-Chennoufi S, Dillmann ML, Brüssow H (2003). "Phage as agents of lateral gene transfer". Curr. Opin. Microbiol. 6 (4): 417—24. doi:10.1016/S1369-5274(03)00086-9. PMID 12941415.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Shors pp. 49–50
- ↑ 1 2 Harper D. virus (2011). Дата обращения: 23 декабря 2011. Архивировано 20 января 2013 года.
- ↑ Harper D. virulent (2011). Дата обращения: 23 декабря 2011. Архивировано 20 января 2013 года.
- ↑ Harper D. viral (2011). Дата обращения: 23 декабря 2011. Архивировано 20 января 2013 года.
- ↑ Harper D. virion (2011). Дата обращения: 24 декабря 2011. Архивировано 20 января 2013 года.
- ↑ Casjens S. Desk Encyclopedia of General Virology / Mahy BWJ and Van Regenmortel MHV. — Boston : Academic Press, 2010. — P. 167. — ISBN 0-12-375146-2.
- ↑ Bordenave G (2003). "Louis Pasteur (1822–1895)". Microbes and Infection / Institut Pasteur. 5 (6): 553—60. doi:10.1016/S1286-4579(03)00075-3. PMID 12758285.
- ↑ Shors pp. 76–77
- ↑ 1 2 3 Collier p. 3
- ↑ Dimmock p.4–5
- ↑ 1 2 Fenner F. Desk Encyclopedia of General Virology / Mahy B. W. J. and Van Regenmortal M. H. V.. — 1. — Oxford, UK : Academic Press, 2009. — P. 15. — ISBN 0-12-375146-2.
- ↑ Shors p. 589
- ↑ D'Herelle F (2007). "On an invisible microbe antagonistic toward dysenteric bacilli: brief note by Mr. F. D'Herelle, presented by Mr. Roux". Research in Microbiology. 158 (7): 553—4. doi:10.1016/j.resmic.2007.07.005. PMID 17855060.
- ↑ Steinhardt E, Israeli C, Lambert R.A. (1913). "Studies on the cultivation of the virus of vaccinia". J. Inf Dis. 13 (2): 294—300. doi:10.1093/infdis/13.2.294.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Collier p. 4
- ↑ Goodpasture EW, Woodruff AM, Buddingh GJ (1931). "The cultivation of vaccine and other viruses in the chorioallantoic membrane of chick embryos". Science. 74 (1919): 371—372. doi:10.1126/science.74.1919.371. PMID 17810781.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Rosen, FS (2004). "Isolation of poliovirus—John Enders and the Nobel Prize". New England Journal of Medicine. 351 (15): 1481—83. doi:10.1056/NEJMp048202. PMID 15470207.
- ↑ From Nobel Lectures, Physics 1981–1990, (1993) Editor-in-Charge Tore Frängsmyr, Editor Gösta Ekspång, World Scientific Publishing Co., Singapore.
- In 1887, Buist visualised one of the largest, Vaccinia virus, by optical microscopy after staining it. Vaccinia was not known to be a virus at that time. (Buist J.B. Vaccinia and Variola: a study of their life history Churchill, London)
- ↑ Stanley WM, Loring HS (1936). "The isolation of crystalline tobacco mosaic virus protein from diseased tomato plants". Science. 83 (2143): 85. doi:10.1126/science.83.2143.85. PMID 17756690.
- ↑ Stanley WM, Lauffer MA (1939). "Disintegration of tobacco mosaic virus in urea solutions". Science. 89 (2311): 345—347. doi:10.1126/science.89.2311.345. PMID 17788438.
- ↑ Creager AN, Morgan GJ (2008). "After the double helix: Rosalind Franklin's research on Tobacco mosaic virus". Isis. 99 (2): 239—72. doi:10.1086/588626. PMID 18702397.
- ↑ Dimmock p. 12
- ↑ Norrby E (2008). "Nobel Prizes and the emerging virus concept". Arch. Virol. 153 (6): 1109—23. doi:10.1007/s00705-008-0088-8. PMID 18446425.
- ↑ Collier p. 745
- ↑ 1 2 3 Temin HM, Baltimore D (1972). "RNA-directed DNA synthesis and RNA tumor viruses". Adv. Virus Res. 17: 129—86. doi:10.1016/S0065-3527(08)60749-6. PMID 4348509.
{{cite journal}}:|access-date=требует|url=(справка) Ошибка в сносках?: Неверный тег<ref>: название «pmid4348509» определено несколько раз для различного содержимого - ↑ Barré-Sinoussi, F.; et al. (1983). "Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)". Science. 220 (4599): 868—871. doi:10.1126/science.6189183. PMID 6189183.
{{cite journal}}: Явное указание et al. в:|author=(справка) - ↑ Cello J, Paul AV, Wimmer E (2002). "Chemical synthesis of poliovirus cDNA: generation of infectious virus in the absence of natural template". Science. 297 (5583): 1016—8. doi:10.1126/science.1072266. PMID 12114528.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Iyer LM, Balaji S, Koonin EV, Aravind L (2006). "Evolutionary genomics of nucleo-cytoplasmic large DNA viruses". Virus Res. 117 (1): 156—84. doi:10.1016/j.virusres.2006.01.009. PMID 16494962.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 Sanjuán R, Nebot MR, Chirico N, Mansky LM, Belshaw R (2010). "Viral mutation rates". Journal of Virology. 84 (19): 9733—48. doi:10.1128/JVI.00694-10. PMC 2937809. PMID 20660197.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Shors pp. 14–16
- ↑ Collier pp. 11–21
- ↑ 1 2 Dimmock p. 16
- ↑ Collier p. 11
- ↑ 1 2 3 Mahy WJ & Van Regenmortel MHV (eds). Desk Encyclopedia of General Virology. — Oxford : Academic Press, 2009. — P. 24. — ISBN 0-12-375146-2.
- ↑ Shors p. 574
- ↑ McClintock, B. (1950). "The origin and behavior of mutable loci in maize". Proc Natl Acad Sci U S A. 36 (6): 344—55. doi:10.1073/pnas.36.6.344. PMC 1063197. PMID 15430309.
- ↑ Collier pp. 11–12
- ↑ Dimmock p. 55
- ↑ Shors 551–3
- ↑ Tsagris EM, de Alba AE, Gozmanova M, Kalantidis K (2008). "Viroids". Cell. Microbiol. 10 (11): 2168. doi:10.1111/j.1462-5822.2008.01231.x. PMID 18764915.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Shors p. 492–3
- ↑ La Scola B, Desnues C, Pagnier I, Robert C, Barrassi L, Fournous G, Merchat M, Suzan-Monti M, Forterre P, Koonin E, Raoult D (2008). "The virophage as a unique parasite of the giant mimivirus". Nature. 455 (7209): 100—4. doi:10.1038/nature07218. PMID 18690211.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Collier p. 777
- ↑ Dimmock p. 55–7
- ↑ 1 2 Mahy WJ & Van Regenmortel MHV (eds). Desk Encyclopedia of General Virology. — Oxford : Academic Press, 2009. — P. 28. — ISBN 0-12-375146-2.
- ↑ 1 2 Mahy WJ & Van Regenmortel MHV (eds). Desk Encyclopedia of General Virology. — Oxford : Academic Press, 2009. — P. 26. — ISBN 0-12-375146-2.
- ↑ Dimmock pp. 15–16
- ↑ Liberski PP (2008). "Prion diseases: a riddle wrapped in a mystery inside an enigma". Folia Neuropathol. 46 (2): 93—116. PMID 18587704.
- ↑ Belay ED and Schonberger LB. Desk Encyclopedia of Human and Medical Virology. — Boston : Academic Press, 2009. — P. 497–504. — ISBN 0-12-375147-0.
- ↑ Lupi O, Dadalti P, Cruz E, Goodheart C (2007). "Did the first virus self-assemble from self-replicating prion proteins and RNA?". Med. Hypotheses. 69 (4): 724—30. doi:10.1016/j.mehy.2007.03.031. PMID 17512677.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Holmes EC (2007). "Viral evolution in the genomic age". PLoS Biol. 5 (10): e278. doi:10.1371/journal.pbio.0050278. PMC 1994994. PMID 17914905.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Wimmer E, Mueller S, Tumpey TM, Taubenberger JK (2009). "Synthetic viruses: a new opportunity to understand and prevent viral disease". Nature Biotechnology. 27 (12): 1163—72. doi:10.1038/nbt.1593. PMC 2819212. PMID 20010599.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Horn M (2008). "Chlamydiae as symbionts in eukaryotes". Annual Review of Microbiology. 62: 113—31. doi:10.1146/annurev.micro.62.081307.162818. PMID 18473699.
- ↑ Ammerman NC, Beier-Sexton M, Azad AF (2008). "Laboratory maintenance of Rickettsia rickettsii". Current Protocols in Microbiology. Chapter 3: Unit 3A.5. doi:10.1002/9780471729259.mc03a05s11. PMC 2725428. PMID 19016440.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 Collier pp. 33–55
- ↑ Collier pp. 33–37
- ↑ Kiselev NA, Sherman MB, Tsuprun VL (1990). "Negative staining of proteins". Electron Microsc. Rev. 3 (1): 43—72. doi:10.1016/0892-0354(90)90013-I. PMID 1715774.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Collier p. 40
- ↑ Caspar DL, Klug A (1962). "Physical principles in the construction of regular viruses". Cold Spring Harb. Symp. Quant. Biol. 27: 1—24. PMID 14019094.
- ↑ Crick FH, Watson JD (1956). "Structure of small viruses". Nature. 177 (4506): 473—5. doi:10.1038/177473a0. PMID 13309339.
- ↑ Falvo, M.R. (1997). "Manipulation of individual viruses: friction and mechanical properties". Biophysical Journal. 72 (3): 1396—1403. doi:10.1016/S0006-3495(97)78786-1. PMC 1184522. PMID 9138585.
{{cite journal}}: Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ Kuznetsov, Yu. G. (2001). "Imaging of viruses by atomic force microscopy". J Gen Virol. 82 (9): 2025—2034. PMID 11514711.
{{cite journal}}: Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ Collier p. 37
- ↑ Collier pp. 40, 42
- ↑ Casens, S. Desk Encyclopedia of General Virology. — Boston : Academic Press, 2009. — P. 167–174. — ISBN 0-12-375146-2.
- ↑ Rossmann MG, Mesyanzhinov VV, Arisaka F, Leiman PG (2004). "The bacteriophage T4 DNA injection machine". Curr. Opin. Struct. Biol. 14 (2): 171—80. doi:10.1016/j.sbi.2004.02.001. PMID 15093831.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Collier pp. 42–43
- ↑ Long GW, Nobel J, Murphy FA, Herrmann KL, Lourie B (1970). "Experience with electron microscopy in the differential diagnosis of smallpox". Appl Microbiol. 20 (3): 497—504. PMC 376966. PMID 4322005.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Suzan-Monti M, La Scola B, Raoult D (2006). "Genomic and evolutionary aspects of Mimivirus". Virus Research. 117 (1): 145—155. doi:10.1016/j.virusres.2005.07.011. PMID 16181700.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ World’s biggest virus discovered in ocean depths near Chile. Дата обращения: 12 октября 2011.
- ↑ 1 2 3 Collier pp. 96–99
- ↑ Saunders, Venetia A.; Carter, John. Virology: principles and applications. — Chichester : John Wiley & Sons, 2007. — P. 72. — ISBN 0-470-02387-2.
- ↑ Van Etten JL, Lane LC, Dunigan DD (2010). "DNA viruses: the really big ones (giruses)". Annual Review of Microbiology. 64: 83—99. doi:10.1146/annurev.micro.112408.134338. PMC 2936810. PMID 20690825.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Pressing J, Reanney DC (1984). "Divided genomes and intrinsic noise". J Mol Evol. 20 (2): 135—46. doi:10.1007/BF02257374. PMID 6433032.
- ↑ Duffy S, Holmes EC (2009). "Validation of high rates of nucleotide substitution in geminiviruses: phylogenetic evidence from East African cassava mosaic viruses". The Journal of General Virology. 90 (Pt 6): 1539—47. doi:10.1099/vir.0.009266-0. PMID 19264617.
- ↑ Pan XP, Li LJ, Du WB, Li MW, Cao HC, Sheng JF (2007). "Differences of YMDD mutational patterns, precore/core promoter mutations, serum HBV DNA levels in lamivudine-resistant hepatitis B genotypes B and C". J. Viral Hepat. 14 (11): 767—74. doi:10.1111/j.1365-2893.2007.00869.x. PMID 17927612.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Hampson AW, Mackenzie JS (2006). "The influenza viruses". Med. J. Aust. 185 (10 Suppl): S39—43. PMID 17115950.
- ↑ Metzner KJ (2006). "Detection and significance of minority quasispecies of drug-resistant HIV-1". J HIV Ther. 11 (4): 74—81. PMID 17578210.
- ↑ Goudsmit, Jaap. Viral Sex. Oxford Univ Press, 1998.ISBN 978-0-19-512496-5 ISBN 0-19-512496-0
- ↑ Worobey M, Holmes EC (1999). "Evolutionary aspects of recombination in RNA viruses". J. Gen. Virol. 80 ( Pt 10): 2535—43. PMID 10573145.
- ↑ Lukashev AN (2005). "Role of recombination in evolution of enteroviruses". Rev. Med. Virol. 15 (3): 157—67. doi:10.1002/rmv.457. PMID 15578739.
- ↑ Umene K (1999). "Mechanism and application of genetic recombination in herpesviruses". Rev. Med. Virol. 9 (3): 171—82. doi:10.1002/(SICI)1099-1654(199907/09)9:3<171::AID-RMV243>3.0.CO;2-A. PMID 10479778.
- ↑ Dimmock p. 70
- ↑ Boevink P, Oparka KJ (2005). "Virus-host interactions during movement processes". Plant Physiol. 138 (4): 1815—21. doi:10.1104/pp.105.066761. PMC 1183373. PMID 16172094.
- ↑ Dimmock p. 71
- ↑ Barman S, Ali A, Hui EK, Adhikary L, Nayak DP (2001). "Transport of viral proteins to the apical membranes and interaction of matrix protein with glycoproteins in the assembly of influenza viruses". Virus Res. 77 (1): 61—9. doi:10.1016/S0168-1702(01)00266-0. PMID 11451488.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Shors pp. 60, 597
- ↑ Dimmock, Chapter 15, Mechanisms in virus latentcy, pp.243–259
- ↑ Dimmock 185–187
- ↑ Shors p. 54; Collier p. 78
- ↑ Collier p. 79
- ↑ Staginnus C, Richert-Pöggeler KR (2006). "Endogenous pararetroviruses: two-faced travelers in the plant genome". Trends in Plant Science. 11 (10): 485—91. doi:10.1016/j.tplants.2006.08.008. PMID 16949329.
- ↑ Collier pp. 88–89
- ↑ Collier pp. 115–146
- ↑ Collier p. 115
- ↑ Roulston A, Marcellus RC, Branton PE (1999). "Viruses and apoptosis". Annu. Rev. Microbiol. 53: 577—628. doi:10.1146/annurev.micro.53.1.577. PMID 10547702.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Alwine JC (2008). "Modulation of host cell stress responses by human cytomegalovirus". Curr. Top. Microbiol. Immunol. 325: 263—79. doi:10.1007/978-3-540-77349-8_15. PMID 18637511.
- ↑ Sinclair J (2008). "Human cytomegalovirus: Latency and reactivation in the myeloid lineage". J. Clin. Virol. 41 (3): 180—5. doi:10.1016/j.jcv.2007.11.014. PMID 18164651.
- ↑ Jordan MC, Jordan GW, Stevens JG, Miller G (1984). "Latent herpesviruses of humans". Ann. Intern. Med. 100 (6): 866—80. PMID 6326635.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Sissons JG, Bain M, Wills MR (2002). "Latency and reactivation of human cytomegalovirus". J. Infect. 44 (2): 73—7. doi:10.1053/jinf.2001.0948. PMID 12076064.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Barozzi P, Potenza L, Riva G, Vallerini D, Quadrelli C, Bosco R, Forghieri F, Torelli G, Luppi M (2007). "B cells and herpesviruses: a model of lymphoproliferation". Autoimmun Rev. 7 (2): 132—6. doi:10.1016/j.autrev.2007.02.018. PMID 18035323.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Subramanya D, Grivas PD (2008). "HPV and cervical cancer: updates on an established relationship". Postgrad Med. 120 (4): 7—13. doi:10.3810/pgm.2008.11.1928. PMID 19020360.
- ↑ Crawford, Dorothy H. Viruses: A Very Short Introduction. — Oxford University Press, USA, 2011. — P. 16. — ISBN 0-19-957485-5.
- ↑ Shors p. 388
- ↑ Shors p. 353
- ↑ Dimmock p. 272
- ↑ Baggesen DL, Sørensen G, Nielsen EM, Wegener HC (2010). "Phage typing of Salmonella Typhimurium – is it still a useful tool for surveillance and outbreak investigation?". Eurosurveillance. 15 (4): 19471. PMID 20122382.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Lwoff A, Horne RW, Tournier P (1962). "A virus system". C. R. Hebd. Seances Acad. Sci. (фр.). 254: 4225—7. PMID 14467544.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Lwoff A, Horne R, Tournier P (1962). "A system of viruses". Cold Spring Harb. Symp. Quant. Biol. 27: 51—5. PMID 13931895.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Fields p. 27
- Как отмечается там, «вид вирусов представляет собой политетический класс вирусов, которые вместе образуют единую линию поколений и занимают особенную экологическую нишу». «Политетический» класс — это таксономическая группа, члены которой имеют несколько общих свойств, хотя и не обязательно имеют все одинаковые свойства. Этим вид вирусов отличается от вышестоящих вирусных таксонов, которые являются «универсальными» классами и имеют набор свойств, обязательных для каждого их члена.
- ↑ Delwart EL (2007). "Viral metagenomics". Rev. Med. Virol. 17 (2): 115—31. doi:10.1002/rmv.532. PMID 17295196.
- ↑ King AMQ, Lefkowitz E, Adams MJ, Carstens EB. Virus Taxonomy: Ninth Report of the International Committee on Taxonomy of Viruses. — Elsevier, 2011. — P. 6. — ISBN 0-12-384684-6.
- ↑ Virus Taxonomy 2009. International Committee on Taxonomy of Viruses. Retrieved on December 24, 2011.
- ↑ ICTV Master Species List 2009
- Этот Exsel-файл содержит официальный список видов вирусов ICTV на 2009 год и списки всех утверждённых вирусных таксонов. Эта версия была выпущена 24 августа 2011 года и проверена 24 декабря того же года
- ↑ 1 2 Baltimore D (1974). "The strategy of RNA viruses". Harvey Lect. 70 Series: 57—74. PMID 4377923. Ошибка в сносках?: Неверный тег
<ref>: название «pmid4377923» определено несколько раз для различного содержимого - ↑ van Regenmortel MH, Mahy BW (2004). "Emerging issues in virus taxonomy". Emerging Infect. Dis. 10 (1): 8—13. PMID 15078590.
- ↑ Mayo MA (1999). "Developments in plant virus taxonomy since the publication of the 6th ICTV Report. International Committee on Taxonomy of Viruses". Arch. Virol. 144 (8): 1659—66. doi:10.1007/s007050050620. PMID 10486120.
- ↑ de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H (2004). "Classification of papillomaviruses". Virology. 324 (1): 17—27. doi:10.1016/j.virol.2004.03.033. PMID 15183049.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ ScienceNow — «Ancient Virus Gave Wasps Their Sting»
- ↑ Элементы — новости науки: Наездники подавляют иммунную защиту своих жертв при помощи прирученных вирусов
- ↑ Shors p. 4
- ↑ Shors p. 5
- ↑ Shors p. 593
- ↑ Suttle CA (2005). "Viruses in the sea". Nature. 437 (7057): 356—61. doi:10.1038/nature04160. PMID 16163346.
- ↑ Все параметры шаблона {{cite web}} должны иметь имя. Harmful Algal Blooms: Red Tide: Home. www.cdc.gov. Дата обращения: 23 октября 2009.
- ↑ 1 2 3 4 Suttle CA (2007). "Marine viruses—major players in the global ecosystem". Nature Reviews. Microbiology. 5 (10): 801—12. doi:10.1038/nrmicro1750. PMID 17853907.
- ↑ Hall, A. J., Jepson, P. D., Goodman, S. J. & Harkonen, T. "Phocine distemper virus in the North and European Seas — data and models, nature and nurture". Biol. Conserv. 131, 221–229 (2006)
- ↑ Forterre P, Philippe H (1999). "The last universal common ancestor (LUCA), simple or complex?". The Biological Bulletin. 196 (3): 373—5, discussion 375–7. doi:10.2307/1542973. PMID 11536914.
- ↑ Collier p.8
- ↑ Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James.Viruses:Structure, Function, and Uses Retrieved on September 16, 2008
- ↑ Matsuzaki S, Rashel M, Uchiyama J, Sakurai S, Ujihara T, Kuroda M, Ikeuchi M, Tani T, Fujieda M, Wakiguchi H, Imai S (2005). "Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases". Journal of Infection and Chemotherapy : Official Journal of the Japan Society of Chemotherapy. 11 (5): 211—9. doi:10.1007/s10156-005-0408-9. PMID 16258815.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Gleba, YY; Giritch, A. Plant Viral Vectors for Protein Expression // Recent Advances in Plant Virology. — Caister Academic Press, 2011. — ISBN 978-1-904455-75-2.
- ↑ Fischlechner M, Donath E (2007). "Viruses as Building Blocks for Materials and Devices". Angewandte Chemie International Edition. 46 (18): 3184. doi:10.1002/anie.200603445. PMID 17348058.
{{cite journal}}: Указан более чем один параметр|pages=and|page=(справка) - ↑ Soto CM, Blum AS, Vora GJ; et al. (2006). "Fluorescent signal amplification of carbocyanine dyes using engineered viral nanoparticles". J. Am. Chem. Soc. 128 (15): 5184—9. doi:10.1021/ja058574x. PMID 16608355.
{{cite journal}}: Явное указание et al. в:|author=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Blum AS, Soto CM, Wilson CD; et al. (2005). "An Engineered Virus as a Scaffold for Three-Dimensional Self-Assembly on the Nanoscale". Small. 7: 702. doi:10.1002/smll.200500021. PMID 17193509.
{{cite journal}}: Явное указание et al. в:|author=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Cello J, Paul AV, Wimmer E (2002). "Chemical synthesis of poliovirus cDNA: generation of infectious virus in the absence of natural template". Science. 297 (5583): 1016—8. doi:10.1126/science.1072266. PMID 12114528.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Coleman JR, Papamichail D, Skiena S, Futcher B, Wimmer E, Mueller S (2008). "Virus attenuation by genome-scale changes in codon pair bias". Science. 320 (5884): 1784—7. doi:10.1126/science.1155761. PMC 2754401. PMID 18583614.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Genomes. NIH viral genome database. Ncbi.nlm.nih.gov. Дата обращения: 7 мая 2012.
- ↑ Shors p. 331
- ↑ 1 2 3 Artenstein AW, Grabenstein JD (2008). "Smallpox vaccines for biodefense: need and feasibility". Expert Review of Vaccines. 7 (8): 1225—37. doi:10.1586/14760584.7.8.1225. PMID 18844596.
- ↑ Aragón TJ, Ulrich S, Fernyak S, Rutherford GW (2003). "Risks of serious complications and death from smallpox vaccination: a systematic review of the United States experience, 1963–1968". BMC public health. 3: 26. doi:10.1186/1471-2458-3-26. PMC 194634. PMID 12911836.
{{cite journal}}: Указан более чем один параметр|pages=and|page=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Weiss MM, Weiss PD, Mathisen G, Guze P (2004). "Rethinking smallpox". Clin. Infect. Dis. 39 (11): 1668—73. doi:10.1086/425745. PMID 15578369.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка)
См. также
Литература
- Букринская А. Г. Вирусология. — М.: Медицина, 1986. — 336 с.
- Mayo M. A., Pringle C. R. Virus taxonomy — 1997 // Journal of General Virology. — 1998. — № 79. — С. 649—657.
Ссылки
- «Таинственные соседи». Статья «Lenta.ru» от 28.10.2010 г.
- «Нобелевский комитет поразили вирусы». Статья газеты «Коммерсантъ» № 181(3998) от 07.10.2008 г.
- The Universal Virus Database ICTVdB
- ICTVNet
Шаблон:Link FA Шаблон:Link FA Шаблон:Link FA Шаблон:Link FA Шаблон:Link GA