Вирус иммунодефицита человека: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
→Открытие ВИЧ: здоровы были все носители. у больных СПИДом выделить вирус тогда не удалось. |
Sirozha (обсуждение | вклад) |
||
| Строка 60: | Строка 60: | ||
Терапию назначают при снижении иммунитета и/или высокой вирусной нагрузке. В случае, если число CD4+ лимфоцитов велико и вирусная нагрузка низкая, терапию не назначают. После назначения терапии лекарства нужно принимать ежедневно в одно и то же время и пожизненно, что создает неудобства для пациентов. Также следует учитывать высокую стоимость месячного курса лекарств. В 2014 необходимые лекарства получали менее половины из 9,5 млн человек, нуждающихся в противовирусной терапии<ref>{{cite web|url=http://www.avert.org/starting-monitoring-switching-hiv-treatment.htm|title=Starting, Monitoring & Switching HIV Treatment|publisher=AVERT|accessdate=2014-07-21}}</ref>. |
Терапию назначают при снижении иммунитета и/или высокой вирусной нагрузке. В случае, если число CD4+ лимфоцитов велико и вирусная нагрузка низкая, терапию не назначают. После назначения терапии лекарства нужно принимать ежедневно в одно и то же время и пожизненно, что создает неудобства для пациентов. Также следует учитывать высокую стоимость месячного курса лекарств. В 2014 необходимые лекарства получали менее половины из 9,5 млн человек, нуждающихся в противовирусной терапии<ref>{{cite web|url=http://www.avert.org/starting-monitoring-switching-hiv-treatment.htm|title=Starting, Monitoring & Switching HIV Treatment|publisher=AVERT|accessdate=2014-07-21}}</ref>. |
||
После проникновения вируса в клетку [[Ферменты|фермент]] [[обратная транскриптаза]] синтезирует [[провирус]]ную ДНК, которую затем фермент [[интеграза]] встраивает в [[геном]] клетки человека<ref name=compendia /> |
После проникновения вируса в клетку [[Ферменты|фермент]] [[обратная транскриптаза]] синтезирует [[провирус]]ную ДНК, которую затем фермент [[интеграза]] встраивает в [[геном]] клетки человека<ref name=compendia />. В настоящее время идёт поиск безопасных способов редактирования генома человека и исключения из него [[провирус]]ной ДНК<ref>{{cite web|url=http://arvt.ru/news/2014-06-22-CRISPR-Cas9-CCR5-delta32.html|title=Генетический ластик для ВИЧ|publisher=Фонд развития межсекторного социального партнерства|accessdate=2014-07-21}}</ref><ref>{{Cite pmid|24927590}}</ref>. В 2014 году был предложен метод удаления генома ВИЧ-1 из зараженных клеток при помощи [[CRISPR|Cas9]] путем снижения экспрессии генов и репликации вируса, а также иммунизации неинфицированных клеток. Описанный подход может привести к разработке способа полного избавления от ВИЧ/СПИД<ref>{{Cite pmid|25049410}}</ref><ref>{{cite web|url=http://www.nkj.ru/news/24712/|title=Клетки человека избавили от ВИЧ|date=2014-07-25|author=Кирилл Стасевич|work=[[Наука и жизнь]]|publisher=nkj.ru|accessdate=2014-07-27|lang=ru}}</ref>. |
||
== Классификация == |
== Классификация == |
||
Версия от 17:40, 5 августа 2014
- Эта статья о патогене — вирусе иммунодефицита человека. О заболевании — статья ВИЧ-инфекция. О терминальной стадии болезни — статья СПИД.
| Вирус иммунодефицита человека | ||||||
|---|---|---|---|---|---|---|
![Стилизованное изображение сечения ВИЧ[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ea/Human_Immunodeficency_Virus_-_stylized_rendering.jpg/275px-Human_Immunodeficency_Virus_-_stylized_rendering.jpg) Стилизованное изображение сечения ВИЧ[1] | ||||||
| Научная классификация | ||||||
|
Реалм: Царство: Pararnavirae Тип: Artverviricota Класс: Порядок: Семейство: Подсемейство: Род: Группа: Primate lentivirus group |
||||||
| Международное научное название | ||||||
| Primate lentivirus group | ||||||
| Виды | ||||||
|
||||||
| Группа по Балтимору | ||||||
| VI: оцРНК-ОТ-вирусы | ||||||
| ||||||
Ви́рус иммунодефици́та челове́ка — ретровирус из рода лентивирусов, вызывающий ВИЧ-инфекцию[3][4].
Вирус поражает клетки иммунной системы, имеющие на своей поверхности рецепторы CD4: Т-хелперы, моноциты, макрофаги, клетки Лангерганса[5], дендритные клетки, клетки микроглии[6]. В результате работа иммунной системы угнетается, развивается синдром приобретённого иммунного дефицита (СПИД). Организм человека теряет возможность защищаться от инфекции, в результате чего возникают вторичные оппортунистические заболевания (инфекции и опухоли), которые не характерны для людей с нормальным иммунным статусом[7][8][7][9][10][11][12]. В отсутствие специфичной антиретровирусной терапии смерть пациента наступает не в результате размножения вируса в CD4+ клетках, а по причине развития оппортунистических заболеваний.
Открытие ВИЧ


В 1981 году появились две научные статьи о необычных случаях развития пневмоцистной пневмонии и саркомы Капоши у гомосексуальных мужчин[15][16]. До этого оба заболевания встречались редко и были характерны для совершенно разных групп пациентов: саркомой Капоши в основном болели пожилые мужчины средиземноморского происхождения, а пневмоцистной пневмонией — пациенты с лейкозом после интенсивной химиотерапии. Появление этих заболеваний, свидетельствующих о тяжёлом иммунодефицитном состоянии, у молодых людей, не входящих в соответствующие группы риска, наблюдалось впервые[16]. Затем обнаружили такие же симптомы среди наркопотребителей, больных гемофилией A[17] и гаитян[18][19]. Также было обнаружено, что все пациенты имели очень низкое количество CD4-положительных иммунных клеток[20][21][16].
В июле 1982 года для обозначения этого состояния был предложен термин синдром приобретённого иммунного дефицита (СПИД, AIDS)[22]. В сентябре 1982 года СПИДу было дано полноценное определение на основании наблюдения ряда оппортунистических инфекций у четырёх групп пациентов, указанных выше[23][16].
В период с 1981 по 1984 год вышло несколько работ, связывающих вероятность развития СПИДа с анальным сексом или с влиянием наркотиков[24][25][26][27][28][29]. Параллельно велись работы над гипотезой о возможной инфекционной природе СПИДа.
Вирус иммунодефицита человека независимо открыли в 1983 году в двух лабораториях: Институте Пастера во Франции под руководством Люка Монтанье и Национальном институте рака в США под руководством Роберта Галло?!. Результаты исследований, в которых из тканей пациентов впервые удалось выделить новый ретровирус, были опубликованы 20 мая 1983 года в журнале Science[30][31]. В этих статьях исследователи сообщили об обнаружении нового вируса (который первоначально отнесли к группе HTLV) и выдвинули предположение, что он может вызывать синдром приобретенного иммуного дефицита[16].
4 мая 1984 исследователи сообщили о выделении вируса, носившего на тот момент название HTLV-III, из лимфоцитов 26 из 72 обследованных больных в стадии СПИДа и 18 из 21 больного в стадии пре-СПИДа. Ни у кого из 115 гетеросексуальных индивидов контрольной группы вирус обнаружить не удалось. Исследователи отметили, что малый процент выделения вируса из крови больных вызван малым количеством Т4-лимфоцитов, в которых размножается вирус[32]. Также исследователи сообщили об обнаружении антител против вируса[33], об идентификации ранее описанных у других вирусов и прежде неизвестных антигенов HTLV-III[34], о наблюдении размножения вируса в популяции лимфоцитов[35][16].
В 1986 было обнаружено, что вирусы, открытые в 1983 французскими и американскими исследователями, генетически идентичны. Первоначальные названия вирусов были упразднены и предложено одно общее название — вирус иммунодефицита человека[36]. В 2008 году Люк Монтанье и Франсуаза Барр-Синусси были удостоены Нобелевской премии в области физиологии или медицины «за открытие вируса иммунодефицита человека»[37].
ВИЧ-инфекция
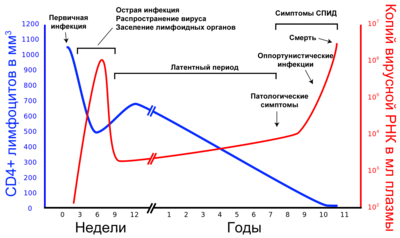
Заражение
Вирус передаётся через прямой контакт крови или повреждённой слизистой оболочки здорового человека с биологическими жидкостями заражённого человека: кровью, спермой, секретом влагалища, предсеменной жидкостью и грудным молоком. Передача вируса может происходить при незащищённом анальном, вагинальном или оральном сексе[39][40], переливании крови, использовании заражённых игл и шприцев (особенно потребителями инъекционных наркотиков)[41]; между матерью и ребёнком во время беременности, родов[42][43] или при грудном вскармливании[44] через указанные выше биологические жидкости. Вирус не передаётся бытовым путём, а также через слюну[45], слёзы[45] и укусы насекомых[46].
Эпидемиология
По данным на 2011 год, в мире за всё время ВИЧ-инфекцией заболели 60 миллионов человек, из них: 25 миллионов умерли, а 35 миллионов живут с ВИЧ-инфекцией[47]. Из которых более двух третей проживают в Африке к югу от пустыни Сахара[48]. Эпидемия началась здесь в конце 1970-х — начале 1980-х, центром считают полосу от Западной Африки до Индийского океана, затем эпидемия перекинулась южнее. За исключением стран Африки, быстрее всего вирус распространяется сегодня в Центральной Азии и Восточной Европе, с 1999 по 2002 годы количество инфицированных здесь почти утроилось. Эпидемическая ситуация в этих регионах сдерживалась до конца 1990-х, затем количество заражённых стало резко расти — в основном за счёт инъекционных наркоманов. Значительно ниже среднего ВИЧ-инфекция распространена в Восточной Азии, Северной Африке и на Ближнем Востоке. В масштабе планеты эпидемическая ситуация стабилизировалась, количество новых случаев ВИЧ-инфекции снизилось с 3,5 миллионов в 1997 году до 2,7 миллионов в 2007 году)[48]. По данным на конец 2013 года, в России 645 тысяч человек живут с ВИЧ-инфекцией, за период с 1986 по 2013 год умерло от разных причин 153 тысячи ВИЧ-инфицированных граждан России[49].
Диагностика
Обязательная проверка донорской крови в развитых странах в значительной степени сократила возможность передачи вируса при её использовании. Тестирование на ВИЧ беременных женщин позволяет своевременно начать приём лекарств и родить здорового ребёнка. Анализ крови позволяет обнаружить антитела к белкам вируса (ИФА), белки вируса (вестерн-блот), РНК вируса (ОТ-ПЦР)[50]. Определение вирусной нагрузки (подсчёт количества копий РНК вируса в миллилитре плазмы крови) позволяет судить о стадии заболевания и эффективности лечения[51][52].
Известно, что принудительное тестирование населения бесперспективно с точки зрения сдерживания эпидемии и нарушает права человека. В России проведение теста без согласия человека является незаконным[53], однако существуют ситуации, в которых предоставление результатов тестирования на ВИЧ является обязательным, но не насильственным (донорство, трудоустройство медицинских работников, для иностранных граждан, получающих разрешение на пребывание в РФ, в местах лишения свободы при наличии клинических показаний)[54].
Лечение
Из 35 миллионов человек, живущих с ВИЧ-инфекцией, часть остаётся в живых благодаря антиретровирусной терапии. Антиретровирусные препараты мешают ВИЧ размножаться в клетках иммунной системы человека, блокируя внедрение вирионов в клетки и нарушая на разных этапах процесс сборки новых вирусных частиц. Своевременно начатое лечение антиретровирусными препаратами в сотни раз снижает риск развития СПИДа и последующей смерти[55][56][57]. Антиретровирусные препараты у части пациентов вызывают побочные эффекты, в некоторых случаях даже требующие сменить схему лечения (набор принимаемых лекарств).
Терапию назначают при снижении иммунитета и/или высокой вирусной нагрузке. В случае, если число CD4+ лимфоцитов велико и вирусная нагрузка низкая, терапию не назначают. После назначения терапии лекарства нужно принимать ежедневно в одно и то же время и пожизненно, что создает неудобства для пациентов. Также следует учитывать высокую стоимость месячного курса лекарств. В 2014 необходимые лекарства получали менее половины из 9,5 млн человек, нуждающихся в противовирусной терапии[58].
После проникновения вируса в клетку фермент обратная транскриптаза синтезирует провирусную ДНК, которую затем фермент интеграза встраивает в геном клетки человека[59]. В настоящее время идёт поиск безопасных способов редактирования генома человека и исключения из него провирусной ДНК[60][61]. В 2014 году был предложен метод удаления генома ВИЧ-1 из зараженных клеток при помощи Cas9 путем снижения экспрессии генов и репликации вируса, а также иммунизации неинфицированных клеток. Описанный подход может привести к разработке способа полного избавления от ВИЧ/СПИД[62][63].
Классификация
Вирус иммунодефицита человека относят к семейству ретровирусов (Retroviridae), роду лентивирусов (Lentivirus). Название Lentivirus происходит от латинского слова lente — медленный. Такое название отражает одну из особенностей вирусов этой группы, а именно — медленную и неодинаковую скорость развития инфекционного процесса в макроорганизме. Для лентивирусов также характерен длительный инкубационный период[64].
Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок у ВИЧ составляет 10−3 — 10−4 ошибок на геном на цикл репликации, что на несколько порядков больше аналогичной величины у эукариот. Размер генома ВИЧ составляет примерно 104 нуклеотидов. Из этого следует, что практически каждый вирус хотя бы на один нуклеотид отличается от своего предшественника. В природе ВИЧ существует в виде множества квазивидов, являясь при этом одной таксономической единицей[65][66][67]. В процессе исследования ВИЧ были обнаружены варианты, которые значительно отличались друг от друга по структуре генома. В современной классификации различают два основных типа — ВИЧ-1 и ВИЧ-2. Эти вирусы предположительно возникли в результате независимой передачи людям SIV (вируса иммунодефицита обезьян) шимпанзе и мангабеев соответственно[68].
И ВИЧ-1, и ВИЧ-2 способны вызывать серьёзный иммунодефицит, однако клиническое течение болезни несколько различается. Известно, что ВИЧ-2 менее патогенен и передается с меньшей вероятностью, чем ВИЧ-1. Вероятно, это связано с тем, что ВИЧ-2-инфекция характеризуется более низким числом вирусных частиц на миллилитр крови. Отмечено, что инфекция ВИЧ-2, обеспечивает носителю небольшую защиту от заражения ВИЧ-1. Однако описаны случаи двойной инфекции, причём заражение может происходить в любом порядке. Инфекция ВИЧ-2 реже заканчивается развитием СПИД. Есть сведения о несколько большей частоте развития саркомы Капоши, кандидоза ротовой полости и хронической лихорадки при ВИЧ-1/СПИД. При ВИЧ-2/СПИД чаще развивается энцефалит, хроническая или бактериальная диарея, серьёзные цитомегаловирусные инфекции и холангит[68]. К роду Lentivirus также относят виды, вызывающие схожие заболевания у обезъян, кошек, лошадей, овец и тд.[7][69][70].
ВИЧ-1
ВИЧ-1 описан в 1983 году и является наиболее распространённым и патогенным типом ВИЧ[71]. ВИЧ-1 далее классифицируют на главную (группу М) и несколько побочных групп. По некоторым данным, группы образовались при независимой в результате нескольких независимых случаев передачи SIV человеку[72].
- Вирусы группы М являются причиной более 90 % случаев ВИЧ-инфекции/СПИДа. Группу М классифицируют не несколько клад, называемых подтипами, также обозначаемых буквами:
- Подтип A широко распространён в Западной Африке[73];
- Подтип B доминирует в Европе, Северной и Южной Америке, Японии, Тайланде, Австралии[74];
- Подтип C преобладает в Южной и Восточной Африке, Индии, Непале, некоторых частях Китая[74];
- Подтип D обнаружен только в Восточной и Центральной Африке[74];
- Подтип E не был выявлен в нерекомбинантном виде, лишь совместно с подтипом А как CRF01_AE.[74];
- Подтип F выявлен в Центральной Африке, Южной Америке и Восточной Европе[75];
- Подтип G и рекомбинантная форма CRF02_AG выявлены в Африке и Центральной Европе[75];
- Подтип H обнаружен только в Центральной Африке[75];
- Подтип I был предложен для описания штамма-продукта множественной рекомбинации CRF04_cpx нескольких подтипов[76];
- Подтип J распространён в Северной, Центральной и Западной Африке и Карибском бассейне[77];
- Подтип K обнаружен только в Конго и Камеруне[75].
- Группа N обозначает штаммы не М и не О, описана в 1998 году и обнаружена только в Камеруне. С 2006 года выявлены лишь 10 заражений вирусами группы N[78].
- Группа O (англ. Outlier) обнаружена в Центральной и Западной Африке. Наиболее распространена в Камеруне, где в 1997 году более 2 % пациентов были заражены вирусом группы О[79]. Вирусы этой группы не определялись ранними версиями тест-систем на ВИЧ-1, современные тесты определяют вирусы и группы О, и группы N[80].
- Группа P — в 2009 году была определена нуклеотидная последовательность РНК ВИЧ, значительно сходная с вирусом иммунодефицита обезьян, описанным у горилл (SIVgor), но не с SIV, характерным для шимпанзе (SIVcpz). Вирус был выделен из образцов, полученных от женщины камерунского происхождения, проживающей во Франции[81][82][83].
ВИЧ-2
ВИЧ-2 идентифицирован в 1986 году[84], генетически очень близок к T-лимфотропному вирусу SIVsmm мангабеев, и в меньшей степени к вирусу ВИЧ-1. Геномы ВИЧ-1 и ВИЧ-2 имеют гомологию консервативных генов gag и pol около 60 %, и до 45 % генов белков оболочки[85]. По состоянию на 2010 год, описано 8 групп ВИЧ-2, лишь группы A и B являются эпидемическими. Вирусы группы А распространены в Западной Африке, Анголе, Мозамбик, Бразилии, Индии и малораспространены в США и Европе. Вирусы группы В распространены в Западной Африке[86][87].
В 1986—88 годы были описаны редкие разновидности ВИЧ (ВИЧ-3 и ВИЧ-4), которые в настоящее время не классифицируют как самостоятельные типы или штаммы[88][89]. ВИЧ-3 не реагировал с антителами против других известных групп, а также обладал значительными отличиями в структуре генома, современное наименование этой разновидности — ВИЧ-1 подтип O[71].
Глобальная эпидемия ВИЧ-инфекции главным образом обусловлена распространением ВИЧ-1. ВИЧ-2 распространён преимущественно в Западной Африке, а также Анголе, Мозамбик, Бразилии и Индии. Редко встречается в Европе и США[90][91]. ВИЧ-3 и ВИЧ-4 не играют заметной роли в распространении эпидемии.
В подавляющем большинстве случаев, если не оговорено иначе, под ВИЧ подразумевают ВИЧ-1[92].
Строение вириона

Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100—120 нанометров[93]. Это приблизительно в 60 раз меньше диаметра эритроцита[94].
В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов. Капсид зрелого вириона, состоящий из белка р24, имеет форму усечённого конуса[59].
Внутри капсида находится белково-нуклеиновый комплекс: две нити вирусной РНК, прочно связанные с белком нуклеокапсида p7, ферменты (обратная транскриптаза, протеаза, интеграза)[59]. С капсидом также ассоциированы белки Nef и Vif (7-20 молекул Vif на вирион). Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr[39]:8-11. Сам капсид образуют около 2,000 молекул вирусного белка p24. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связазны около 200 копий клеточного фермента пептидилпролилизомеразы[англ.], необходимого для сборки вириона[95].
Капсид окружен оболочкой, образованной около 2,000 молекул матриксного белка p17[59]. Матриксная оболочка в свою очередь окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами фосфолипидов, захваченными вирусом во время его отпочковывания из клетки, в которой он сформировался[96]. В липидную мембрану встроены 72 гликопротеиновых комплекса Env, каждый из которых образован тремя молекулами трансмембранного гликопротеина (gp41 или TM), служащими «якорем» комплекса, и тремя молекулами поверхностного гликопротеина (gp120 или SU)[95]. С помощью белка gp120 вирус присоединяется к рецептору CD4 и корецептору, находящихся на поверхности Т-лимфоцитов человека. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60-100:1[39]:11. Белки gp41 и в особенности gp120 интенсивно изучаются в качестве возможных мишеней для разработки лекарств и вакцины против ВИЧ. В липидной мембране вируса также находятся мембранные белки клеток, в том числе человеческие лейкоцитарные антигены (HLA) классов I, II и молекулы адгезии[97][59].
Функции важных структурных белков ВИЧ-1[59][97]
| Сокращение | Описание | Функции |
|---|---|---|
| gp41 (TM, transmembrane) | Трансмембранный гликопротеин массой 41 кДа | Располагается во внешнем слое липидной мембраны, играет роль «якоря», удерживающего молекулы белка gp120 |
| gp120 (SU, surface) | Гликопротеин массой 120 кДа | Наружный белок вириона. Нековалентно связан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3 — 5 молекул gp120. Способен связывать рецептор CD4. Играет важную роль в процессе проникновения вируса в клетку. |
| p24 (CA, capsid) | Белок массой 24 кДа | Образует капсид вируса |
| p17 (MA, matrix) | Матриксный белок массой 17 кДа | Около двух тысяч молекул этого белка образуют слой толщиной 5 — 7 нм, располагающийся между внешней оболочкой и капсидом вируса. |
| p7 (NC, nucleocapsid) | Нуклеокапсидный белок массой 7 кДа | Входит в состав капсида вируса. Образует комплекс с вирусной РНК. |
Геном и кодируемые белки
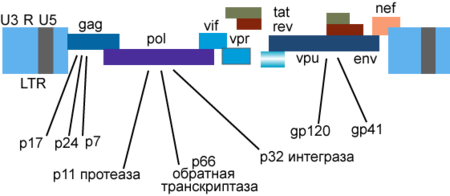
Генетический материал ВИЧ представлен двумя не связанными нитями положительно-смысловой (+)РНК[95]. Геном ВИЧ-1 имеет длину 9,000 нуклеотидов. Концы генома представлены длинными концевыми повторами (LTR), которые управляют продукцией новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки.
9 генов ВИЧ-1 кодируют, по крайней мере, 15 белков[98]. Ген pol — кодирует ферменты: обратную транскриптазу (RT), интегразу (IN) и протеазу (PR). Ген gag — кодирует полипротеин Gag/p55, расщепляемый вирусной протеазой (PR) до структурных белков p6, p7, p17, p24. Ген env — кодирует белок gp160, расщепляемый клеточной эндопротеазой фурином на структурные белки gp41 и gp120[39]:8-12. Другие шесть генов — tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2) — кодируют белки, отвечающие за способность ВИЧ-1 инфицировать клетки и производить новые копии вируса. Репликация ВИЧ-1 in vitro возможна без генов nef, vif, vpr, vpu, однако данные белки необходимы для полноценной инфекции in vivo[99][100][101].
Gag
Полипротеин-предшественник Gag/p55 синтезируется с полноразмерной геномной РНК (которая в данном случае служит в качестве мРНК) в процессе стандартной кэп-зависимой трансляции, но синтез возможен и с помощью IRES, расположенного в 5'-нетранслируемой области мРНК. Локализация отдельных белков Gag, на которые расщепляется Gag/p55, следующая: p17…p24…p2…p7…p1…p6[39]:8. (р1 и р2 — соединительные пептиды; другие продукты расщепления Gag/p55 описаны выше.) Нерасщеплённый протеазой Gag/p55 содержит три основных домена: домен мембранной локализации (М, membrane targeting), домен взаимодействия (I, interaction) и «поздний» домен (L, late). Домен М, расположенный внутри области p17/МА, миристилируется (добавляются остатки миристиновой кислоты) и направляет Gag/p55 к плазматической мембране. Домен I, находящийся внутри области p7/NC, отвечает за межмолекулярные взаимодействия отдельных мономеров Gag/p55. Домен L, также локализованный в области p7/NC, опосредует отпочковывание вирионов от плазматической мембраны; в этом процессе участвует также р6 область полипротеина Gag/p55[39]:8.
Vpu
Двумя важными функциями белка Vpu являются: 1) разрушение клеточного рецептора CD4 в эндоплазматическом ретикулуме путём привлечения убиквитин-лигазных комплексов, и 2) стимуляция выделения дочерних вирионов из клетки, путём инактивации интерферон-индуцируемого трансмембранного белка CD317/BST-2, получившего также название «tetherin» за его способность подавлять выделение вновь образовавшихся дочерних вирионов посредством их удержания на поверхности клетки[99][100][102][103][104][105].
Vpr
Белок Vpr необходим для репликации вируса в неделящихся клетках, в том числе макрофагах. Этот белок, наряду с другими клеточными и вирусными белками, активирует длинные концевые повторы генома ВИЧ. Белок Vpr играет важную роль в переносе провируса в ядро и вызывает задержку деления клетки в периоде G2[106].
Vif
Белок Vif играет важную роль в поддержке репликации вируса. Штаммы, лишённые этого белка, не реплицируются в CD4+ лимфоцитах, некоторых линиях T-лимфоцитов («недоступных клетках») и макрофагах. Эти штаммы способны проникать в клетки-мишени и начинать обратную транскрипцию, однако синтез провирусной ДНК остаётся незавершенным[106].
Nef
Белок Nef выполняет несколько функций. Он подавляет экспрессию молекул CD4 и HLA классов I и II на поверхности инфицированных клеток, и тем самым позволяет вирусу ускользать от атаки цитотоксических T-лимфоцитов CD8 и от распознавания лимфоцитами CD4. Белок Nef может также угнетать активацию T-лимфоцитов, связывая различные белки — компоненты систем внутриклеточной передачи сигнала[106].
У инфицированных вирусом иммунодефицита обезьян макак-резус активная репликация вируса и прогрессирование болезни возможны только при интактном гене nef. Делеции гена nef были обнаружены в штаммах ВИЧ, выделенных у группы австралийцев с длительным непрогрессирующим течением инфекции[107]. Однако у части из них со временем появились признаки прогрессирования инфекции, в том числе снижение числа лимфоцитов CD4. Таким образом, хотя делеции гена nef и могут замедлять репликацию вируса, гарантией от того, что заражение ВИЧ-инфекцией не произойдет, они не являются.[108]
Tat и Rev
Регуляторные белки Tat и Rev накапливаются в ядре клетки и связывают определённые участки вирусной РНК: первый — трансактивируемый регуляторный элемент (TAR) в области длинных концевых повторов, второй — Rev-чувствительный регуляторный элемент (RRE) в области гена env. Белок Tat активирует транскрипцию промоторной области длинных концевых повторов и необходим для репликации вируса почти во всех культурах клеток. Белок Tat нуждается в клеточном кофакторе — циклине T1. Белки Tat и Rev стимулируют транскрипцию провирусной ДНК в РНК, элонгацию РНК и транспорт РНК из ядра в цитоплазму и необходимы для трансляции. Белок Rev обеспечивает также транспорт компонентов вируса из ядра и переключение синтеза регуляторных белков вируса на синтез структурных[106].
Жизненный цикл

1. Взаимодействие вирусного белка gp120 с клеточным рецептором CD4.
2. Конформационные изменения вирусного белка gp120 обеспечивают связывание с клеточным рецептором CCR5.
3. Дальние концы вирусного белка gp41 проникают в плазматическую мембрану клетки.
4. Вирусный белок gp41 подвергается значительным конформационным изменениям, складывается пополам и образует спираль, что приводит к сближению и слиянию мембран вириона и клетки
С помощью поверхностного гликопротеина gp120 вирус присоединяется к CD4-рецептору и одному из двух корецепторов, находящихся в клеточной мембране (см. схему). Для Т-лимфоцитов корецептором является CXCR-4, а для макрофагов — CCR-5[109][110]. Цитоплазматическая мембрана клетки и мембрана вируса сливаются, вирус проникает внутрь клетки, где высвобождается вирусная РНК, и происходит обратная транскрипция — синтез ДНК на основе матрицы одноцепочечной геномной РНК вируса, катализируемая ферментом обратная транскриптаза[111]. Синтезированная ДНК транспортируется внутрь ядра клетки и встраивается в хромосому хозяина под действием фермента интеграза. Человеческая РНК-полимераза в ядре клетки синтезирует геномную РНК и информационную РНК (мРНК) вируса. Синтезированные РНК транспортируются обратно в цитоплазму, где на матрице мРНК на рибосомах синтезируются вирусные ферменты, структурные и регуляторные белки. Геномная РНК вируса, а также вирусные белки транспортируются к местам сборки вирионов. Новые вирусные частицы отпочковываются от поверхности клетки, захватывая часть её мембраны, и выходят в кровяное русло, а клетка хозяина, несущая рецептор CD4+, погибает[112][113].
В период острой фазы ВИЧ-инфекции отсутствие специфического иммунного ответа позволяет вирусу активно реплицироваться и достигать высоких концентраций в крови. Вирус заселяет органы лимфатической системы, CD4-лимфоциты, CD8-лимфоциты и макрофаги, а также другие клетки: альвеолярные макрофаги лёгких, клетки Лангерганса, фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты мозга, эпителиальные клетки кишки[114][115]. В лимфоидной ткани ВИЧ размножается на протяжении всего заболевания, поражая макрофаги, активированные и покоящиеся CD4+ лимфоциты, фолликулярные дендритные клетки[116][117]. Количество клеток, содержащих провирусную ДНК, в лимфоидной ткани в 5—10 раз выше, чем среди клеток крови, а репликация ВИЧ в лимфоидной ткани на 1—2 порядка выше, чем в крови. Резервуаром ВИЧ служат лимфатические узлы[118] и конкретно дендритныe клетки, в которых вирус сохраняется длительное время после периода острой виремии.[109]
Для активации CD8+ лимфоцитов и образования антиген-специфических цитотоксических T-лимфоцитов необходима презентация пептидного антигена в комплексе с человеческим лейкоцитарным антигеном класса I. Дендритные клетки, необходимыe для начала первичных антиген-специфичных реакций, захватывают антигены, перерабатывают и переносят их на свою поверхность, где эти антигены, в комплексе с дополнительными стимулирующими молекулами, активируют T-лимфоциты. Зараженные клетки часто не выделяют дополнительных стимулирующих молекул и поэтому не способны вызвать образование достаточного числа B- и T-лимфоцитов, функция которых зависит от дендритных клеток.[119]
После завершения обратной транскрипции в CD4+ лимфоците вирусный геном представлен провирусной невстроенной ДНК. Для встраивания провирусной ДНК в геном клетки-хозяина и для образования новых вирусов необходима активация T-лимфоцитов. Контакт CD4+ лимфоцитов и антиген-представляющих клеток в лимфоидной ткани, наличие вирусов на поверхности фолликулярных дендритных клеток и присутствие провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНОα) способствуют размножению ВИЧ в инфицированных клетках. Именно поэтому лимфоидная ткань служит самой благоприятной средой для репликации ВИЧ.[119]
Происхождение

HIV — вирус иммунодефицита человека
SIV — вирус иммунодефицита обезьян
Методом молекулярной филогении показано, что вирус иммунодефицита человека образовался в конце девятнадцатого или в начале двадцатого века[120][121][122][123][124].
Оба типа вируса иммунодефицита человека ВИЧ-1 и ВИЧ-2 возникли в Западной и Центральной Африке южнее Сахары и передались от обезьян к людям в результате зоонозиса. ВИЧ-1 возник на юге Камеруна через эволюцию эндемичного для этой местности вируса иммунодефицита обезьян SIV-cpz, который заражает диких шимпанзе подвида Pan troglodytes troglodytes[125][126]. ВИЧ-1, как полагают, перешел видовой барьер по крайней мере трижды и породил три группы вирусов: M, N и О[127].
ВИЧ-2 возник на территории Западной Африки (от южного Сенегала до запада Берега Слоновой Кости) через эволюцию вируса иммунодефицита обезьян SIV-smm, который заражает тёмно-коричневых мангобеев (Cercocebus atys) и узконосых обезьян[128]. Однако некоторые широконосые обезьяны, такие как ночные обезьяны являются устойчивыми к ВИЧ-1, возможно, из-за геномного слияния двух вирусных генов устойчивости[129].
Существует доказательство того, что те люди, которые участвуют в промыслах в качестве охотников на диких животных или поставщиков мяса в западной и центральной Африке, обычно приобретают вирус иммунодефицита обезьян[130]. Однако, вирус иммунодефицита обезьян — слабый вирус, он, как правило, подавляется иммунной системой человека в течение недели после заражения. Считается, что необходимо несколько передач вируса от человека к человеку в быстрой последовательности, чтобы вирусу хватило времени мутировать в ВИЧ[131]. Кроме того, благодаря относительно низкой скорости передачи от человека к человеку, вирус иммунодефицита обезьян может распространяться среди населения только в присутствии одного или более рискованных каналов передачи, которые, как полагают, отсутствовали в Африке до XX века. Предполагаемые высокорискованные каналы передачи, которые позволили вирусу приспособиться к людям и распространиться по всему обществу, зависят от предполагаемых сроков перехода от животного к человеку. Генетические исследования показывают, что последний общий предок ВИЧ-1 группы М датируют около 1910 года[132]. Сторонники этой даты связывают ВИЧ с появлением колониализма и роста больших колониальных африканских городов, что привело к социальным изменениям, включая более высокую степень беспорядочности половых отношений, распространение проституции и сопутствующее появление с высокой частотой язв половых органов (например, в результате сифилиса)[133]. Существует доказательство того, что скорость передачи ВИЧ во время вагинального полового акта, достаточно низкая при обычных условиях, может быть увеличена в десятки, если не в сотни раз, в том случае, если один из партнёров страдает от ЗППП в присутствии половых язв. О степени распространённости таких заболеваний в колониальных городах в начале 1900-х можно судить по следующим цифрам: в 1928 году по меньшей мере 45 % жительниц восточного Леопольдвиля (ныне — Киншаса) были проститутками, а в 1933 году около 15 % всех жителей этого же города были заражены одной из форм сифилиса[133].
Альтернативная точка зрения гласит, что небезопасная медицинская практика в Африке в годы после Второй мировой войны, такая как использование нестерильных многоразовых шприцов при массовых вакцинациях, инъекциях антибиотиков и противомалярийных средств, была началом, которое позволило вирусу приспосабливаться к людям и распространяться[87][134][135].
В результате ретроанализа образцов крови взятых после Второй мировой войны зафиксирован самый ранний документальный случай наличия ВИЧ в организме человека, кровь у которого взяли в 1959 году[136]. Вирус, возможно, присутствовал в Соединённых Штатах уже в 1966 году[137], но подавляющее большинство случаев заражения ВИЧ, идентифицированных за пределами тропической Африки, можно проследить до одного неустановленного человека, который заразился ВИЧ на Гаити, а затем перенес инфекцию в США около 1969 года[138].
Устойчивость к ВИЧ
Описаны случаи устойчивости людей к ВИЧ: проникновение вируса в иммунную клетку связано с его взаимодействием с поверхностным рецептором: белком CCR5, делеция (утеря участка гена) CCR5-дельта32 приводит к невосприимчивости её носителя к ВИЧ. Предполагается, что эта мутация возникла примерно две с половиной тысячи лет назад и со временем распространилась в Европе. Сейчас к ВИЧ фактически устойчив в среднем 1 % жителей Европы, 10-15 % европейцев имеют частичную сопротивляемость к ВИЧ[139]. Учёные Ливерпульского университета объясняют такую неравномерность тем, что мутация CCR5 усиливает сопротивляемость к бубонной чуме. Поэтому после эпидемий «чёрной смерти» 1347 года (а в Скандинавии ещё и 1711 года) доля этого генотипа выросла. Мутация в гене CCR2 также уменьшает шанс проникновения ВИЧ в клетку и приводит к задержке развития СПИД. Существует небольшой процент людей (около 10 % всех ВИЧ-положительных), в крови которых присутствует вирус, однако СПИД у них не развивается в течение долгого времени. Их называют нонпрогрессорами.[140][141]
Обнаружено, что одним из главных элементов антивирусной защиты человека и других приматов является белок TRIM5a, способный распознавать капсид вирусных частиц и препятствовать размножению вируса в клетке. Данный белок у человека и других приматов имеет различия, которые обуславливают врожденную устойчивость шимпанзе к ВИЧ и родственным ему вирусам, а у человека — врожденную устойчивость к вирусу PtERV1[142].
Другой важный элемент антивирусной защиты — интерферон-индуцируемый трансмембранный белок CD317/BST-2 (англ. bone marrow stromal antigen 2), получивший также название «tetherin» за его способность подавлять выделение вновь образовавшихся дочерних вирионов посредством их удержания на поверхности клетки[102][103][143]. CD317 — трансмембранный белок 2го типа с необычной топологией — трансмембранный домен рядом с N-концом и гликозилфосфатидилинозитол (GPI) на С-конце; между ними расположен внеклеточный домен[144]. Показано, что CD317 непосредственно взаимодействует со зрелыми дочерними вирионами, «привязывая» их к поверхности клетки[145]. Для объяснения механизма такого «привязывания» предложено четыре альтернативных модели, согласно которым две молекулы CD317 формируют параллельный гомодимер; один или два гомодимера связываются одновременно с одним вирионом и клеточной мембраной. При этом с мембраной вириона взаимодействуют либо оба мембранных «якоря» (трансмембранный домен и GPI) одной из молекул CD317, либо один из них[145]. Спектр активности CD317 включает, по крайней мере, четыре семейства вирусов: ретровирусы, филовирусы, аренавирусы и герпесвирусы[143]. Активность данного клеточного фактора ингибируется белками Vpu ВИЧ-1, Env ВИЧ-2 и SIV, Nef SIV, гликопротеином оболочки вируса Эбола и белком К5 герпесвируса саркомы Капоши[99][100][104][105][143][146][147]. Обнаружен кофактор белка CD317 — клеточный белок ВСА2 (Breast cancer-associated gene 2; Rabring7, ZNF364, RNF115) — Е3 убиквитин-лигаза класса RING. BCA2 усиливает интернализацию вирионов ВИЧ-1, «привязанных» белком CD317 к клеточной поверхности, в CD63+ внутриклеточные везикулы с их последующим разрушением в лизосомах[148].
Примечания
- ↑ James E. Rickman. Human genes may predict AIDS progression rate. Los Alamos National Laboratory News Bulletin (14 июля 2003). Архивировано 23 марта 2004 года.
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Weiss RA (May 1993). "How does HIV cause AIDS?". Science. 260 (5112): 1273—9. Bibcode:1993Sci...260.1273W. doi:10.1126/science.8493571. PMID 8493571.
- ↑ Douek DC, Roederer M, Koup RA (2009). "Emerging Concepts in the Immunopathogenesis of AIDS". Annu. Rev. Med. 60: 471—84. doi:10.1146/annurev.med.60.041807.123549. PMC 2716400. PMID 18947296.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Kawamura T., Kurtz S. E., Blauvelt A., Shimada S. The role of Langerhans cells in the sexual transmission of HIV. (англ.) // Journal of dermatological science. — 2005. — Vol. 40, no. 3. — P. 147—155. — doi:10.1016/j.jdermsci.2005.08.009. — PMID 16226431.
- ↑ Kramer-Hämmerle S., Rothenaigner I., Wolff H., Bell J. E., Brack-Werner R. Cells of the central nervous system as targets and reservoirs of the human immunodeficiency virus. (англ.) // Virus research. — 2005. — Vol. 111, no. 2. — P. 194—213. — doi:10.1016/j.virusres.2005.04.009. — PMID 15885841.
- ↑ 1 2 3 NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome
- ↑ Alimonti JB, Ball TB, Fowke KR (2003). "Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS". J. Gen. Virol. 84 (7): 1649—1661. doi:10.1099/vir.0.19110-0. PMID 12810858.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ UNAIDS, WHO. 2007 AIDS epidemic update (PDF) 10 (декабрь 2007). Дата обращения: 12 марта 2008.
- ↑ Holmes CB, Losina E, Walensky RP, Yazdanpanah Y, Freedberg KA (2003). "Review of human immunodeficiency virus type 1-related opportunistic infections in sub-Saharan Africa". Clin. Infect. Dis. 36 (5): 656&dash, 662. doi:10.1086/367655. PMID 12594648.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Guss DA (1994). "The acquired immune deficiency syndrome: an overview for the emergency physician, Part 1". J. Emerg. Med. 12 (3): 375—384. doi:10.1016/0736-4679(94)90281-X. PMID 8040596.
- ↑ Guss DA (1994). "The acquired immune deficiency syndrome: an overview for the emergency physician, Part 2". J. Emerg. Med. 12 (4): 491—497. doi:10.1016/0736-4679(94)90346-8. PMID 7963396.
- ↑ Department of Health and Human Services. Centers for Disease Control and Prevention’s Public Health Image Library (PHIL), image #948.Проверено 27 июля 2012.
- ↑ Public Health Image Library Scanning electron micrograph of HIV-1 virions budding from a cultured lymphocyte. See PHIL 10000 for a colorized view of this image, and PHIL 14270, for a black and white version, both viewed at a lower magnigication
- ↑ Pneumocystis pneumonia--Los Angeles. (англ.) // MMWR. Morbidity and mortality weekly report. — 1981. — Vol. 30, no. 21. — P. 250—252. — PMID 6265753.
- ↑ 1 2 3 4 5 6 History of AIDS Up to 1986. AVERT. Дата обращения: 21 июля 2014.
- ↑ "Pneumocystis carinii pneumonia among persons with hemophilia A". MMWR Morb. Mortal. Wkly. Rep. 31 (27): 365—7. July 1982. PMID 6815443.
- ↑ "Opportunistic infections and Kaposi's sarcoma among Haitians in the United States". MMWR Morb. Mortal. Wkly. Rep. 31 (26): 353—4, 360—1. July 1982. PMID 6811853.
- ↑ Cohen J (2006). "HIV/AIDS: Latin America & Caribbean. HAITI: making headway under hellacious circumstances". Science. 313 (5786): 470—3. doi:10.1126/science.313.5786.470b. PMID 16873641.
- ↑ Centers for Disease Control (CDC) (1982). "Persistent, generalized lymphadenopathy among homosexual males". MMWR Morb Mortal Wkly Rep. 31 (19): 249—251. PMID 6808340. Дата обращения: 31 августа 2011.
- ↑ Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, Dauguet C, Axler-Blin C, Vézinet-Brun F, Rouzioux C, Rozenbaum W, Montagnier L (1983). "Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)". Science. 220 (4599): 868—871. Bibcode:1983Sci...220..868B. doi:10.1126/science.6189183. PMID 6189183.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ The history of AIDS 1981—1986. AVERT. Дата обращения: 21 июля 2014.
- ↑ Update on acquired immune deficiency syndrome (AIDS)--United States. (англ.) // MMWR. Morbidity and mortality weekly report. — 1982. — Vol. 31, no. 37. — P. 507—508. — PMID 6815471.
- ↑ Gottlieb M. S., Schroff R., Schanker H. M., Weisman J. D., Fan P. T., Wolf R. A., Saxon A. Pneumocystis carinii pneumonia and mucosal candidiasis in previously healthy homosexual men: evidence of a new acquired cellular immunodeficiency. (англ.) // The New England journal of medicine. — 1981. — Vol. 305, no. 24. — P. 1425—1431. — doi:10.1056/NEJM198112103052401. — PMID 6272109.
- ↑ Durack D. T. Opportunistic infections and Kaposi's sarcoma in homosexual men. (англ.) // The New England journal of medicine. — 1981. — Vol. 305, no. 24. — P. 1465—1467. — doi:10.1056/NEJM198112103052408. — PMID 6272112.
- ↑ Goedert J. J., Neuland C. Y., Wallen W. C., Greene M. H., Mann D. L., Murray C., Strong D. M., Fraumeni J. F. Jr., Blattner W. A. Amyl nitrite may alter T lymphocytes in homosexual men. (англ.) // Lancet. — 1982. — Vol. 1, no. 8269. — P. 412—416. — PMID 6121088.
- ↑ Jaffe H. W., Choi K., Thomas P. A., Haverkos H. W., Auerbach D. M., Guinan M. E., Rogers M. F., Spira T. J., Darrow W. W., Kramer M. A., Friedman S. M., Monroe J. M., Friedman-Kien A. E., Laubenstein L. J., Marmor M., Safai B., Dritz S. K., Crispi S. J., Fannin S. L., Orkwis J. P., Kelter A., Rushing W. R., Thacker S. B., Curran J. W. National case-control study of Kaposi's sarcoma and Pneumocystis carinii pneumonia in homosexual men: Part 1. Epidemiologic results. (англ.) // Annals of internal medicine. — 1983. — Vol. 99, no. 2. — P. 145—151. — PMID 6603806.
- ↑ Mathur-Wagh U., Enlow R. W., Spigland I., Winchester R. J., Sacks H. S., Rorat E., Yancovitz S. R., Klein M. J., William D. C., Mildvan D. Longitudinal study of persistent generalised lymphadenopathy in homosexual men: relation to acquired immunodeficiency syndrome. (англ.) // Lancet. — 1984. — Vol. 1, no. 8385. — P. 1033—1038. — PMID 6143974.
- ↑ Newell G. R., Adams S. C., Mansell P. W., Hersh E. M. Toxicity, immunosuppressive effects and carcinogenic potential of volatile nitrites: possible relationship to Kaposi's sarcoma. (англ.) // Pharmacotherapy. — 1984. — Vol. 4, no. 5. — P. 284—291. — PMID 6150466.
- ↑ Barré-Sinoussi F., Chermann J. C., Rey F., Nugeyre M. T., Chamaret S., Gruest J., Dauguet C., Axler-Blin C., Vézinet-Brun F., Rouzioux C., Rozenbaum W., Montagnier L. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). (англ.) // Science (New York, N.Y.). — 1983. — Vol. 220, no. 4599. — P. 868—871. — PMID 6189183.
- ↑ Gallo R. C., Sarin P. S., Gelmann E. P., Robert-Guroff M., Richardson E., Kalyanaraman V. S., Mann D., Sidhu G. D., Stahl R. E., Zolla-Pazner S., Leibowitch J., Popovic M. Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS). (англ.) // Science (New York, N.Y.). — 1983. — Vol. 220, no. 4599. — P. 865—867. — PMID 6601823.
- ↑ Gallo R. C., Salahuddin S. Z., Popovic M., Shearer G. M., Kaplan M., Haynes B. F., Palker T. J., Redfield R., Oleske J., Safai B. Frequent detection and isolation of cytopathic retroviruses (HTLV-III) from patients with AIDS and at risk for AIDS. (англ.) // Science (New York, N.Y.). — 1984. — Vol. 224, no. 4648. — P. 500—503. — doi:10.1126/science.6200936. — PMID 6200936.
- ↑ Sarngadharan M. G., Popovic M., Bruch L., Schüpbach J., Gallo R. C. Antibodies reactive with human T-lymphotropic retroviruses (HTLV-III) in the serum of patients with AIDS. (англ.) // Science (New York, N.Y.). — 1984. — Vol. 224, no. 4648. — P. 506—508. — PMID 6324345.
- ↑ Schüpbach J., Popovic M., Gilden R. V., Gonda M. A., Sarngadharan M. G., Gallo R. C. Serological analysis of a subgroup of human T-lymphotropic retroviruses (HTLV-III) associated with AIDS. (англ.) // Science (New York, N.Y.). — 1984. — Vol. 224, no. 4648. — P. 503—505. — PMID 6200937.
- ↑ Popovic M., Sarngadharan M. G., Read E., Gallo R. C. Detection, isolation, and continuous production of cytopathic retroviruses (HTLV-III) from patients with AIDS and pre-AIDS. (англ.) // Science (New York, N.Y.). — 1984. — Vol. 224, no. 4648. — P. 497—500. — PMID 6200935.
- ↑ Coffin J., Haase A., Levy J. A., Montagnier L., Oroszlan S., Teich N., Temin H., Toyoshima K., Varmus H., Vogt P. What to call the AIDS virus? (англ.) // Nature. — 1986. — Vol. 321, no. 6065. — P. 10. — PMID 3010128.
- ↑ The Nobel Prize in Physiology or Medicine 2008 Press Release. — «Harald zur Hausen, Françoise Barré-Sinoussi, Luc Montagnier». Дата обращения: 21 июля 2014.
- ↑ Based on Figure 1 in Pantaleo, G; et al. (1993). "New concepts in the immunopathogenesis of human immunodeficiency virus infection". New England Journal of Medicine. 328 (5): 327-335. PMID 8093551.
{{cite journal}}: Неизвестный параметр|day=игнорируется (справка); Неизвестный параметр|month=игнорируется (справка); Явное указание et al. в:|first=(справка) Also available via Figure 4 in The relationship between the human immunodeficiency virus and the acquired immunodeficiency syndrome. US National Institute of Allergy and Infectious Diseases. Архивировано 30 ноября 2009 года. Supporting data for this disease course is available in Piutak, M; et al. (1993). "High levels of HIV-1 in plasma during all stages of infection determined by competitive PCR". Science. 259 (510): 1749–54. PMID 8096089.{{cite journal}}: Неизвестный параметр|day=игнорируется (справка); Неизвестный параметр|month=игнорируется (справка); Явное указание et al. в:|first=(справка) - ↑ 1 2 3 4 5 6 Levy J.A. HIV and the pathogenesis of AIDS. — USA: American Society for Microbiology, 2007. — ISBN 978-1-55581-393-2.
- ↑ Rothenberg R. B., Scarlett M., del Rio C., Reznik D., O'Daniels C. Oral transmission of HIV. (англ.) // AIDS (London, England). — 1998. — Vol. 12, no. 16. — P. 2095—2105. — PMID 9833850.
- ↑ Jpnh G Bartlett. [hopkons-hivguide.org Карманный справочник. Лечение ВИЧ-инфекции и СПИДа у взрослых]. — Медицинская школа Университета Джона Хопкинса, 2008. — 138 с.
- ↑ Cooper E. R., Charurat M., Mofenson L., Hanson I. C., Pitt J., Diaz C., Hayani K., Handelsman E., Smeriglio V., Hoff R., Blattner W. Combination antiretroviral strategies for the treatment of pregnant HIV-1-infected women and prevention of perinatal HIV-1 transmission. (англ.) // Journal of acquired immune deficiency syndromes (1999). — 2002. — Vol. 29, no. 5. — P. 484—494. — PMID 11981365.
- ↑ Recommendations for Use of Antiretroviral Drugs in Pregnant HIV-1-Infected Women for Maternal Health and Interventions to Reduce Perinatal HIV-1 Transmission in the United States. AIDSinfo.nih.gov (12 октября 2006). Дата обращения: 21 июля 2014.
- ↑ Всемирная организация здравоохранения. HIV transmission through breastfeeding. A review of available evidence. — 2007. — ISBN 9789241596596.
- ↑ 1 2 CDC. HIV Transmission. Дата обращения: 21 июля 2014. Centers for Disease Control and Prevention. HIV and Its Transmission. The Center for HIV Law and Policy. — Разоблачение мифов о передаче ВИЧ бытовым путем, при поцелуях, укусах, через слюну, слёзы и др. Дата обращения: 21 июля 2014. aids.gov. HOW DO YOU GET HIV OR AIDS? U.S. Department of Health & Human Services. Дата обращения: 21 июля 2014. Baron S., Poast J., Cloyd M. W. Why is HIV rarely transmitted by oral secretions? Saliva can disrupt orally shed, infected leukocytes. (англ.) // Archives of internal medicine. — 1999. — Vol. 159, no. 3. — P. 303—310. — PMID 9989543.
- ↑ Kerr C. Bloodsucking fly blamed for transmitting HIV. (англ.) // The Lancet infectious diseases. — 2002. — Vol. 2, no. 5. — P. 265. — PMID 12062985.Цитата: «Most bloodsucking insects are not capable of transmitting HIV because they inject saliva and ingest blood through different routes»
- ↑ Борьба со СПИД в России: как остановить болезнь? РИА Новости (30 ноября 2011). Дата обращения: 16 июня 2013. Архивировано 16 июня 2013 года.
- ↑ 1 2 UNAIDS World AIDS Day Report 2011. UNAIDS World AIDS (2011). Дата обращения: 16 июня 2013. Архивировано 16 июня 2013 года.
- ↑ Федеральный центр СПИД: Справка ВИЧ-инфекция в Российской Федерации в 2013 г.
- ↑ National HIV and STD Testing Resources. Centers for Disease Control and Prevention. Дата обращения: 21 июля 2014.
- ↑ aids.gov. Just Diagnosed with HIV AIDS : Understand Your Test Results : Viral Load. U.S. Department of Health & Human Services. Дата обращения: 21 июля 2014.
- ↑ WebMD Medical Reference from Healthwise. Human Immunodeficiency Virus (HIV) Test. Healthwise. Дата обращения: 21 июля 2014.
- ↑ Федеральный закон от 22 июля 1993 г. N 5487-1 "Основы законодательства Российской Федерации об охране здоровья граждан" 0. Российская газета. Дата обращения: 21 июля 2014.
- ↑ Тест на ВИЧ с точки зрения права. Николай Недзельский. Дата обращения: 21 июля 2014.
- ↑ Emery S., Neuhaus J. A., Phillips A. N., Babiker A., Cohen C. J., Gatell J. M., Girard P. M., Grund B., Law M., Losso M. H., Palfreeman A., Wood R. Major clinical outcomes in antiretroviral therapy (ART)-naive participants and in those not receiving ART at baseline in the SMART study. (англ.) // The Journal of infectious diseases. — 2008. — Vol. 197, no. 8. — P. 1133—1144. — doi:10.1086/586713. — PMID 18476292.
- ↑ Katzenstein D. A., Hammer S. M., Hughes M. D., Gundacker H., Jackson J. B., Fiscus S., Rasheed S., Elbeik T., Reichman R., Japour A., Merigan T. C., Hirsch M. S. The relation of virologic and immunologic markers to clinical outcomes after nucleoside therapy in HIV-infected adults with 200 to 500 CD4 cells per cubic millimeter. AIDS Clinical Trials Group Study 175 Virology Study Team. (англ.) // The New England journal of medicine. — 1996. — Vol. 335, no. 15. — P. 1091—1098. — doi:10.1056/NEJM199610103351502. — PMID 8813039.
- ↑ Sterne J. A., Hernán M. A., Ledergerber B., Tilling K., Weber R., Sendi P., Rickenbach M., Robins J. M., Egger M. Long-term effectiveness of potent antiretroviral therapy in preventing AIDS and death: a prospective cohort study. (англ.) // Lancet. — 2005. — Vol. 366, no. 9483. — P. 378—384. — doi:10.1016/S0140-6736(05)67022-5. — PMID 16054937.
- ↑ Starting, Monitoring & Switching HIV Treatment. AVERT. Дата обращения: 21 июля 2014.
- ↑ 1 2 3 4 5 6 7 Los Alamos National Laboratory. HIV Sequence Compendium 2008. — 2008.
- ↑ Генетический ластик для ВИЧ. Фонд развития межсекторного социального партнерства. Дата обращения: 21 июля 2014.
- ↑ Ye L., Wang J., Beyer A. I., Teque F., Cradick T. J., Qi Z., Chang J. C., Bao G., Muench M. O., Yu J., Levy J. A., Kan Y. W. Seamless modification of wild-type induced pluripotent stem cells to the natural CCR5Δ32 mutation confers resistance to HIV infection. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2014. — Vol. 111, no. 26. — P. 9591—9596. — doi:10.1073/pnas.1407473111. — PMID 24927590.
- ↑ Hu W., Kaminski R., Yang F., Zhang Y., Cosentino L., Li F., Luo B., Alvarez-Carbonell D., Garcia-Mesa Y., Karn J., Mo X., Khalili K. RNA-directed gene editing specifically eradicates latent and prevents new HIV-1 infection. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2014. — Vol. 111, no. 31. — P. 11461—11466. — doi:10.1073/pnas.1405186111. — PMID 25049410.
- ↑ Кирилл Стасевич. Клетки человека избавили от ВИЧ. Наука и жизнь. nkj.ru (25 июля 2014). Дата обращения: 27 июля 2014.
- ↑ Retroviruses: Molecular Biology, Genomics and Pathogenesis / Kurth, R; Bannert, N. — Caister Academic Press, 2010. — ISBN 978-1-904455-55-4.
- ↑ Robertson DL, Hahn BH, Sharp PM (1995). "Recombination in AIDS viruses". J Mol Evol. 40 (3): 249—59. doi:10.1007/BF00163230. PMID 7723052.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Rambaut A, Posada D, Crandall KA, Holmes EC (January 2004). "The causes and consequences of HIV evolution". Nature Reviews Genetics. 5 (52—61): 52—61. doi:10.1038/nrg1246. PMID 14708016.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Perelson AS, Ribeiro RM (October 2008). "Estimating drug efficacy and viral dynamic parameters: HIV and HCV". Stat Med. 27 (23): 4647—57. doi:10.1002/sim.3116. PMID 17960579.
- ↑ 1 2 Nyamweya S., Hegedus A., Jaye A., Rowland-Jones S., Flanagan K. L., Macallan D. C. Comparing HIV-1 and HIV-2 infection: Lessons for viral immunopathogenesis. (англ.) // Reviews in medical virology. — 2013. — Vol. 23, no. 4. — P. 221—240. — doi:10.1002/rmv.1739. — PMID 23444290.
- ↑ Gelderblom H.R., Ozel M., Pauli G. (1989). "Morphogenesis and morphology of HIV. Structure relations". Arch. Virol. 106: 1—13.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Lentivirus. International Committee on Taxonomy of Viruses (ICTV). — Virus Taxonomy: 2013 Release. Дата обращения: 21 июля 2014.
- ↑ 1 2 Джон Бартлетт. Типы и подтипы ВИЧ // Клинические аспекты ВИЧ-инфекции. — 2009. Архив
- ↑ Sharp P. M., Hahn B. H. Origins of HIV and the AIDS pandemic. (англ.) // Cold Spring Harbor perspectives in medicine. — 2011. — Vol. 1, no. 1. — P. 006841. — doi:10.1101/cshperspect.a006841. — PMID 22229120.
- ↑ Bobkov AF, Kazennova EV, Selimova LM; et al. (October 2004). "Temporal trends in the HIV-1 epidemic in Russia: predominance of subtype A". J. Med. Virol. 74 (2): 191—6. doi:10.1002/jmv.20177. PMID 15332265.
{{cite journal}}: Явное указание et al. в:|author=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 3 4 Goudsmit, Jaap. Viral Sex; The Nature of AIDS. Oxford University Press. New York, New York, 1997. Pg. 51-58. Retrieved May 25, 2008.
- ↑ 1 2 3 4 [1] Introduction to HIV types, groups and subtypes. March 3, 2008. Retrieved May 25, 2008.
- ↑ Paraskevis D., Magiorkinis M., Vandamme A. M., Kostrikis L. G., Hatzakis A. Re-analysis of human immunodeficiency virus type 1 isolates from Cyprus and Greece, initially designated 'subtype I', reveals a unique complex A/G/H/K/? mosaic pattern. (англ.) // The Journal of general virology. — 2001. — Vol. 82, no. Pt 3. — P. 575—580. — PMID 11172098.
- ↑ Hemelaar J, Gouws E, Ghys PD, Osmanov S. (March 2006). "Global and regional distribution of HIV-1 genetic subtypes and recombinants in 2004". AIDS. 20 (16): W13—23. doi:10.1097/01.aids.0000247564.73009.bc. PMID 17053344.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Julie Yamaguchi, Ruthie Coffey, Ana Vallari, Charlotte Ngansop, Dora Mbanya, Nicaise Ndembi, Lazare Kaptué, Lutz G. Gürtler, Pierre Bodelle, Gerald Schochetman, Sushil G. Devare, Catherine A. Brennan (January 2006). "Identification of HIV Type 1 Group N Infections in a Husband and Wife in Cameroon: Viral Genome Sequences Provide Evidence for Horizontal Transmission". AIDS Research and Human Retroviruses. 22 (1): 83—92. doi:10.1089/aid.2006.22.83. PMID 16438650.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Peeters M, Gueye A, Mboup S, Bibollet-Ruche F, Ekaza E, Mulanga C, Ouedrago R, Gandji R, Mpele P, Dibanga G, Koumare B, Saidou M, Esu-Williams E, Lombart JP, Badombena W, Luo N, Vanden Haesevelde M, Delaporte E (March 1997). "Geographical distribution of HIV-1 group O viruses in Africa". AIDS. 11 (4): 493—8. doi:10.1097/00002030-199704000-00013. PMID 9084797.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ AVERT.org. HIV Strains: Types, Groups and Subtypes. Дата обращения: 24 июля 2014.
- ↑ Plantier JC, Leoz M, Dickerson JE, De Oliveira F, Cordonnier F, Lemée V, Damond F, Robertson DL, Simon F (August 2009). "A new human immunodeficiency virus derived from gorillas". Nature Medicine. 15 (8): 871—2. doi:10.1038/nm.2016. PMID 19648927.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ "New HIV strain discovered". Associated Press. CBC News. 2009-08-03. Дата обращения: 3 августа 2009.
- ↑ Donald G. McNeil, Jr. (September 16, 2010). "Precursor to H.I.V. Was in Monkeys for Millennia". New York Times. Дата обращения: 17 сентября 2010.
But P appears to have crossed over from a gorilla; it was discovered only last year, and in only one woman, who was from Cameroon, where lowland gorillas are hunted for meat.
{{cite news}}: Шаблон цитирования имеет пустые неизвестные параметры:|coauthors=(справка) - ↑ Clavel F., Guétard D., Brun-Vézinet F., Chamaret S., Rey M. A., Santos-Ferreira M. O., Laurent A. G., Dauguet C., Katlama C., Rouzioux C. Isolation of a new human retrovirus from West African patients with AIDS. (англ.) // Science (New York, N.Y.). — 1986. — Vol. 233, no. 4761. — P. 343—346. — PMID 2425430.
- ↑ Guyader M., Emerman M., Sonigo P., Clavel F., Montagnier L., Alizon M. Genome organization and transactivation of the human immunodeficiency virus type 2. (англ.) // Nature. — 1987. — Vol. 326, no. 6114. — P. 662—669. — doi:10.1038/326662a0. — PMID 3031510.
- ↑ Santiago, M. L.; Range, F.; Keele, B. F.; Li, Y.; Bailes, E.; Bibollet-Ruche, F.; Fruteau, C.; Noe, R.; Peeters, M. (2005). "Simian Immunodeficiency Virus Infection in Free-Ranging Sooty Mangabeys (Cercocebus atys atys) from the Taï Forest, Côte d'Ivoire: Implications for the Origin of Epidemic Human Immunodeficiency Virus Type 2". Journal of Virology. 79 (19): 12515—27. doi:10.1128/JVI.79.19.12515-12527.2005. PMC 1211554. PMID 16160179.
- ↑ 1 2 Marx PA, Alcabes PG, Drucker E (2001). "Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa". Philos Trans R Soc Lond B Biol Sci. 356 (1410): 911—20. doi:10.1098/rstb.2001.0867. PMC 1088484. PMID 11405938.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Marx J.L. (1988). "Tracking variation in the AIDS virus family". Science. 241: 659—660.
- ↑ Molbak K., Lauritzen E., Fernandes D. (1986). "Antibodies to HTLV-IV associated with chronic fatal illnes resembling "slim" didease". Lancet. 8517: 1214—1215.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ HIV-2 Infection Surveillance--United States, 1987-2009. (англ.) // MMWR. Morbidity and mortality weekly report. — 2011. — Vol. 60, no. 29. — P. 985—988. — PMID 21796096. За 12 лет с 1988 по 2010 в США зарегистрированы лишь 242 случая ВИЧ-инфекции
- ↑ Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents. U.S. Department of Health and Human Services. — «Инфекция ВИЧ-2 эндемична в Западной Африке и имеет лишь ограниченное распространение за пределами этой зоны.» Дата обращения: 21 июля 2014.
- ↑ HIV Strains: Types, Groups and Subtypes. AVERT. Дата обращения: 21 июля 2014.
- ↑ McGovern SL, Caselli E, Grigorieff N, Shoichet BK (2002). "A common mechanism underlying promiscuous inhibitors from virtual and high-throughput screening". Journal of Medical Chemistry. 45 (8): 1712—22. doi:10.1021/jm010533y. PMID 11931626.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Compared with overview in: Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C. Lippincott's Illustrated Reviews: Microbiology (Lippincott's Illustrated Reviews Series). — Hagerstown, MD : Lippincott Williams & Wilkins, 2007. — ISBN 0-7817-8215-5. Page 3
- ↑ 1 2 3 Turner B. G., Summers M. F. Structural biology of HIV. (англ.) // Journal of molecular biology. — 1999. — Vol. 285, no. 1. — P. 1—32. — doi:10.1006/jmbi.1998.2354. — PMID 9878383.
- ↑ Pudney J., Song M. J. Electron microscopic analysis of HIV-host cell interactions. (англ.) // Tissue & cell. — 1994. — Vol. 26, no. 4. — P. 539—550. — PMID 8091422.
- ↑ 1 2 Orentas R. J., Hildreth J. E. Association of host cell surface adhesion receptors and other membrane proteins with HIV and SIV. (англ.) // AIDS research and human retroviruses. — 1993. — Vol. 9, no. 11. — P. 1157—1165. — PMID 8312057.
- ↑ Fauci A. S. HIV and AIDS: 20 years of science. (англ.) // Nature medicine. — 2003. — Vol. 9, no. 7. — P. 839—843. — doi:10.1038/nm0703-839. — PMID 12835701.
- ↑ 1 2 3 Guatelli J. C. Interactions of viral protein U (Vpu) with cellular factors. (англ.) // Current topics in microbiology and immunology. — 2009. — Vol. 339. — P. 27—45. — doi:10.1007/978-3-642-02175-6_2. — PMID 20012522.
- ↑ 1 2 3 Nomaguchi M., Fujita M., Adachi A. Role of HIV-1 Vpu protein for virus spread and pathogenesis. (англ.) // Microbes and infection / Institut Pasteur. — 2008. — Vol. 10, no. 9. — P. 960—967. — doi:10.1016/j.micinf.2008.07.006. — PMID 18672082.
- ↑ Malim M. H., Emerman M. HIV-1 accessory proteins--ensuring viral survival in a hostile environment. (англ.) // Cell host & microbe. — 2008. — Vol. 3, no. 6. — P. 388—398. — doi:10.1016/j.chom.2008.04.008. — PMID 18541215.
- ↑ 1 2 Neil S. J., Zang T., Bieniasz P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. (англ.) // Nature. — 2008. — Vol. 451, no. 7177. — P. 425—430. — doi:10.1038/nature06553. — PMID 18200009.
- ↑ 1 2 Van Damme N., Goff D., Katsura C., Jorgenson R. L., Mitchell R., Johnson M. C., Stephens E. B., Guatelli J. The interferon-induced protein BST-2 restricts HIV-1 release and is downregulated from the cell surface by the viral Vpu protein. (англ.) // Cell host & microbe. — 2008. — Vol. 3, no. 4. — P. 245—252. — doi:10.1016/j.chom.2008.03.001. — PMID 18342597.
- ↑ 1 2 Dubé M., Bego M. G., Paquay C., Cohen A. Modulation of HIV-1-host interaction: role of the Vpu accessory protein. (англ.) // Retrovirology. — 2010. — Vol. 7. — P. 114. — doi:10.1186/1742-4690-7-114. — PMID 21176220.
- ↑ 1 2 Ruiz A., Guatelli J. C., Stephens E. B. The Vpu protein: new concepts in virus release and CD4 down-modulation. (англ.) // Current HIV research. — 2010. — Vol. 8, no. 3. — P. 240—252. — PMID 20201792.
- ↑ 1 2 3 4 Votteler, J. and Schubert, U. (2008) Human Immunodeficiency Viruses: Molecular Biology. Encyclopedia of Virology. (3rd ed.) 517—525
- ↑ Rhodes D. I., Ashton L., Solomon A., Carr A., Cooper D., Kaldor J., Deacon N. Characterization of three nef-defective human immunodeficiency virus type 1 strains associated with long-term nonprogression. Australian Long-Term Nonprogressor Study Group. (англ.) // Journal of virology. — 2000. — Vol. 74, no. 22. — P. 10581—10588. — PMID 11044102.
- ↑ Gorry P. R., McPhee D. A., Verity E., Dyer W. B., Wesselingh S. L., Learmont J., Sullivan J. S., Roche M., Zaunders J. J., Gabuzda D., Crowe S. M., Mills J., Lewin S. R., Brew B. J., Cunningham A. L., Churchill M. J. Pathogenicity and immunogenicity of attenuated, nef-deleted HIV-1 strains in vivo. (англ.) // Retrovirology. — 2007. — Vol. 4. — P. 66. — doi:10.1186/1742-4690-4-66. — PMID 17888184.
- ↑ 1 2 Coakley E., Petropoulos C. J., Whitcomb J. M. Assessing chemokine co-receptor usage in HIV. (англ.) // Current opinion in infectious diseases. — 2005. — Vol. 18, no. 1. — P. 9—15. — PMID 15647694.
- ↑ Myszka D. G., Sweet R. W., Hensley P., Brigham-Burke M., Kwong P. D., Hendrickson W. A., Wyatt R., Sodroski J., Doyle M. L. Energetics of the HIV gp120-CD4 binding reaction. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2000. — Vol. 97, no. 16. — P. 9026—9031. — PMID 10922058.
- ↑ Размножение вируса иммунодефицита человека в клетке
- ↑ John Hopkins AIDS Servise Жизненный цикл ВИЧ-инфекции
- ↑ Perelson A. S., Neumann A. U., Markowitz M., Leonard J. M., Ho D. D. HIV-1 dynamics in vivo: virion clearance rate, infected cell life-span, and viral generation time. (англ.) // Science (New York, N.Y.). — 1996. — Vol. 271, no. 5255. — P. 1582—1586. — PMID 8599114.
- ↑ ВИЧ-инфекция Под ред. Ю. В. Лобзина, С. С. Козлова, А. Н. Ускова, 2000 год.
- ↑ Meng G., Wei X., Wu X., Sellers M. T., Decker J. M., Moldoveanu Z., Orenstein J. M., Graham M. F., Kappes J. C., Mestecky J., Shaw G. M., Smith P. D. Primary intestinal epithelial cells selectively transfer R5 HIV-1 to CCR5+ cells. (англ.) // Nature medicine. — 2002. — Vol. 8, no. 2. — P. 150—156. — doi:10.1038/nm0202-150. — PMID 11821899.
- ↑ Burton G. F., Keele B. F., Estes J. D., Thacker T. C., Gartner S. Follicular dendritic cell contributions to HIV pathogenesis. (англ.) // Seminars in immunology. — 2002. — Vol. 14, no. 4. — P. 275—284. — PMID 12163303.
- ↑ Blauvelt A., Asada H., Saville M. W., Klaus-Kovtun V., Altman D. J., Yarchoan R., Katz S. I. Productive infection of dendritic cells by HIV-1 and their ability to capture virus are mediated through separate pathways. (англ.) // The Journal of clinical investigation. — 1997. — Vol. 100, no. 8. — P. 2043—2053. — doi:10.1172/JCI119737. — PMID 9329969.
- ↑ Pathogenesis of HIV-1 Infection Lymphatic tissue as the site of viral replication
- ↑ 1 2 Патогенез ВИЧ-инфекции.
- ↑ Gao F, Bailes E, Robertson DL; et al. (1999). "Origin of HIV-1 in the Chimpanzee Pan troglodytes troglodytes". Nature. 397 (6718): 436—441. doi:10.1038/17130. PMID 9989410.
{{cite journal}}: Явное указание et al. в:|author=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Worobey M, Gemmel M, Teuwen DE; et al. (2008). "Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960". Nature. 455 (7213): 661—4. doi:10.1038/nature07390. PMID 18833279. Дата обращения: 31 марта 2009.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка); Явное указание et al. в:|author=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Salemi, M.; Strimmer, K; Hall, WW; Duffy, M; Delaporte, E; Mboup, S; Peeters, M; Vandamme, AM (2000). "Dating the common ancestor of SIVcpz and HIV-1 group M and the origin of HIV-1 subtypes by using a new method to uncover clock-like molecular evolution". The FASEB Journal. 15 (2): 276—78. doi:10.1096/fj.00-0449fje. PMID 11156935.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Korber, B.; Muldoon, M; Theiler, J; Gao, F; Gupta, R; Lapedes, A; Hahn, BH; Wolinsky, S; Bhattacharya, T (2000). "Timing the Ancestor of the HIV-1 Pandemic Strains". Science. 288 (5472): 1789—96. Bibcode:2000Sci...288.1789K. doi:10.1126/science.288.5472.1789. PMID 10846155.
- ↑ Worobey M, Gemmel M, Teuwen DE; et al. (2008). "Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960". Nature. 455 (7213): 661—4. Bibcode:2008Natur.455..661W. doi:10.1038/nature07390. PMID 18833279.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка); Явное указание et al. в:|author=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Gao F, Bailes E, Robertson DL; et al. (1999). "Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes". Nature. 397 (6718): 436—41. Bibcode:1999Natur.397..436G. doi:10.1038/17130. PMID 9989410.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка); Явное указание et al. в:|author=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Keele, B. F., van Heuverswyn, F., Li, Y. Y., Bailes, E., Takehisa, J., Santiago, M. L., Bibollet-Ruche, F., Chen, Y., Wain, L. V., Liegois, F., Loul, S., Mpoudi Ngole, E., Bienvenue, Y., Delaporte, E., Brookfield, J. F. Y., Sharp, P. M., Shaw, G. M., Peeters, M., and Hahn, B. H. (28 July 2006). "Chimpanzee Reservoirs of Pandemic and Nonpandemic HIV-1". Science. 313 (5786): 523—6. Bibcode:2006Sci...313..523K. doi:10.1126/science.1126531. PMC 2442710. PMID 16728595.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Sharp, P. M.; Bailes, E.; Chaudhuri, R. R.; Rodenburg, C. M.; Santiago, M. O.; Hahn, B. H. (2001). "The origins of acquired immune deficiency syndrome viruses: where and when?" (PDF). Philosophical Transactions of the Royal Society B: Biological Sciences. 356 (1410): 867—76. doi:10.1098/rstb.2001.0863. PMC 1088480. PMID 11405934.
- ↑ Reeves, J. D. and Doms, R. W (2002). "Human Immunodeficiency Virus Type 2". J. Gen. Virol. 83 (Pt 6): 1253—1265. doi:10.1099/vir.0.18253-0. PMID 12029140.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Goodier, J., and Kazazian, H. (2008). "Retrotransposons Revisited: The Restraint and Rehabilitation of Parasites". Cell. 135 (1): 23—35. doi:10.1016/j.cell.2008.09.022. PMID 18854152.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Kalish ML, Wolfe ND, Ndongmo CD, McNicholl J, Robbins KE; et al. (2005). "Central African hunters exposed to simian immunodeficiency virus". Emerg Infect Dis. 11 (12): 1928—30. PMID 16485481.
{{cite journal}}: Явное указание et al. в:|author=(справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Marx PA, Alcabes PG, Drucker E (2001). "Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa" (PDF). Philos Trans R Soc Lond B Biol Sci. 356 (1410): 911—20. doi:10.1098/rstb.2001.0867. PMC 1088484. PMID 11405938.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Worobey, Michael; Gemmel, Marlea; Teuwen, Dirk E.; Haselkorn, Tamara; Kunstman, Kevin; Bunce, Michael; Muyembe, Jean-Jacques; Kabongo, Jean-Marie M.; Kalengayi, Raphaël M. (2008). "Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960" (PDF). Nature. 455 (7213): 661—4. Bibcode:2008Natur.455..661W. doi:10.1038/nature07390. PMID 18833279.
- ↑ 1 2 Sousa, João Dinis de; Müller, Viktor; Lemey, Philippe; Vandamme, Anne-Mieke; Vandamme, Anne-Mieke (2010). Martin, Darren P. (ed.). "High GUD Incidence in the Early 20th Century Created a Particularly Permissive Time Window for the Origin and Initial Spread of Epidemic HIV Strains". PLoS ONE. 5 (4): e9936. doi:10.1371/journal.pone.0009936. PMC 2848574. PMID 20376191.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Chitnis, Amit; Rawls, Diana; Moore, Jim (2000). "Origin of HIV Type 1 in Colonial French Equatorial Africa?". AIDS Research and Human Retroviruses. 16 (1): 5—8. doi:10.1089/088922200309548. PMID 10628811.
- ↑ Donald G. McNeil, Jr. (September 16, 2010). "Precursor to H.I.V. Was in Monkeys for Millennia". New York Times. Дата обращения: 17 сентября 2010.
Dr. Marx believes that the crucial event was the introduction into Africa of millions of inexpensive, mass-produced syringes in the 1950s. ... suspect that the growth of colonial cities is to blame. Before 1910, no Central African town had more than 10,000 people. But urban migration rose, increasing sexual contacts and leading to red-light districts.
{{cite news}}: Шаблон цитирования имеет пустые неизвестные параметры:|coauthors=(справка) - ↑ Zhu, T., Korber, B. T., Nahmias, A. J., Hooper, E., Sharp, P. M. and Ho, D. D. (1998). "An African HIV-1 Sequence from 1959 and Implications for the Origin of the epidemic". Nature. 391 (6667): 594—7. Bibcode:1998Natur.391..594Z. doi:10.1038/35400. PMID 9468138.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Kolata, Gina (28 October 1987). "Boy's 1969 Death Suggests AIDS Invaded U.S. Several Times". The New York Times. Дата обращения: 11 февраля 2009.
- ↑ The emergence of HIV/AIDS in the Americas and beyond. Архивировано 28 марта 2012 года.
- ↑ Randy Dotinga. Genetic HIV Resistance Deciphered. WIRED.com // Condé Nast. Дата обращения: 21 июля 2014.
- ↑ Kaur G., Mehra N. Genetic determinants of HIV-1 infection and progression to AIDS: susceptibility to HIV infection. (англ.) // Tissue antigens. — 2009. — Vol. 73, no. 4. — P. 289—301. — doi:10.1111/j.1399-0039.2009.01220.x. — PMID 19317737.
- ↑ Chinen J., Shearer W. T. Molecular virology and immunology of HIV infection. (англ.) // The Journal of allergy and clinical immunology. — 2002. — Vol. 110, no. 2. — P. 189—198. — PMID 12170257.
- ↑ Kaiser, Shariser (2007). "Restriction of an Extinct Retrovirus by the Human TRIM5α Antiviral Protein". Science. 316 (5832): 1756—1758.
{{cite journal}}: Неизвестный параметр|day=игнорируется (справка); Неизвестный параметр|month=игнорируется (справка) - ↑ 1 2 3 Tokarev A., Skasko M., Fitzpatrick K., Guatelli J. Antiviral activity of the interferon-induced cellular protein BST-2/tetherin. (англ.) // AIDS research and human retroviruses. — 2009. — Vol. 25, no. 12. — P. 1197—1210. — doi:10.1089/aid.2009.0253. — PMID 19929170.
- ↑ Kupzig S., Korolchuk V., Rollason R., Sugden A., Wilde A., Banting G. Bst-2/HM1.24 is a raft-associated apical membrane protein with an unusual topology. (англ.) // Traffic (Copenhagen, Denmark). — 2003. — Vol. 4, no. 10. — P. 694—709. — PMID 12956872.
- ↑ 1 2 Perez-Caballero D., Zang T., Ebrahimi A., McNatt M. W., Gregory D. A., Johnson M. C., Bieniasz P. D. Tetherin inhibits HIV-1 release by directly tethering virions to cells. (англ.) // Cell. — 2009. — Vol. 139, no. 3. — P. 499—511. — doi:10.1016/j.cell.2009.08.039. — PMID 19879838.
- ↑ Douglas J. L., Gustin J. K., Viswanathan K., Mansouri M., Moses A. V., Früh K. The great escape: viral strategies to counter BST-2/tetherin. (англ.) // PLoS pathogens. — 2010. — Vol. 6, no. 5. — P. e1000913. — doi:10.1371/journal.ppat.1000913. — PMID 20485522.
- ↑ Evans D. T., Serra-Moreno R., Singh R. K., Guatelli J. C. BST-2/tetherin: a new component of the innate immune response to enveloped viruses. (англ.) // Trends in microbiology. — 2010. — Vol. 18, no. 9. — P. 388—396. — doi:10.1016/j.tim.2010.06.010. — PMID 20688520.
- ↑ Miyakawa K., Ryo A., Murakami T., Ohba K., Yamaoka S., Fukuda M., Guatelli J., Yamamoto N. BCA2/Rabring7 promotes tetherin-dependent HIV-1 restriction. (англ.) // PLoS pathogens. — 2009. — Vol. 5, no. 12. — P. e1000700. — doi:10.1371/journal.ppat.1000700. — PMID 20019814.
Литература
- Малый В. П. ВИЧ. СПИД. Новейший медицинский справочник. — М.: Эксмо, 2009. — 672 с. — ISBN 978-5-699-31017-3.
- Bushman F.D., Nabel G.J., Swanstrom R. (Editors). HIV: From biology to prevention and treatment. — Cold Spring Harbor, New York, USA: Cold Spring Harbor Laboratory Press, 2012. — 572 с. — ISBN 978-193611340-8.
- Pancino G., Silvestri G., Fowke K. (Editors). Models of protection against HIV/SIV: Avoiding AIDS in humans and monkeys. — UK-USA-Canada: Academic Press, 2012. — 345 с. — ISBN 978-0-12-387715-4.
- Pepin J. The origins of AIDS. — New York, USA: Cambridge University Press, 2011. — 293 с. — ISBN 978-0-52118637-7.
- Prasad V.R., Kalpana G.V. (Editors). HIV protocols. — Humana Press, 2009. — 457 с. — ISBN 978-1-58829-859-1.
- Sax P.E., Cohen C.J., Kuritzkes D.R. (Editors). HIV essentials. — Jones and Bartlett Learning, 2012. — 248 с. — ISBN 978-1-4496-5092-6.
- Spearman P., Freed E.O. (Editors). HIV interactions with host cell proteins. — Springer, 2009. — 204 с. — ISBN 978-3-642-02174-9.
- Weeks B.B., Alcamo I.E. AIDS: The biological basis. — USA - Canada - UK: Jones and Bartlett Publishers, 2010. — 360 с. — ISBN 978-0-7637-6324-4.
Статья является кандидатом в хорошие статьи с 19 июля 2014. |