Азулен
| Азулен | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Азулен | ||
| Хим. формула | С10Н8 | ||
| Физические свойства | |||
| Молярная масса | 128,17 г/моль | ||
| Энергия ионизации | 7,41 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 99 °C | ||
| • кипения | 242 °C | ||
| Структура | |||
| Дипольный момент | 2,7E−30 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 275-51-4 | ||
| PubChem | 9231 | ||
| Рег. номер EINECS | 205-993-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | CO4570000 | ||
| ChEBI | 31249 | ||
| ChemSpider | 8876 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Азуле́н — С10Н8 — бицикло-[5.3.0]-дека-1,3,5,7,9-пентаен — небензоидное ароматическое соединение, содержащее конденсированную систему из 5- и 7-членного циклов. Является изомером нафталина.
История открытия[править | править код]
Азулен впервые был получен в 15 веке в виде синего красящего вещества, выделенного из эфирного масла ромашки. Тогда ему не придали значения, а вещество не идентифицировали. Вторично азулен был обнаружен в 1863 году французским парфюмером Септимусом Пьессом в тысячелистнике и полыни. Тогда же он и получил своё название. Открыл структуру азулена и осуществил его первый синтез швейцарский химик-органик Леопольд (Лавослав) Ружичка в 1937 году.
Нахождение в природе[править | править код]
Производные азулена достаточно широко встречаются в природных эфирных маслах[2]:
- Хамазулен 1,4-диметил-7-этилазулен: компонент эфирного масла из ромашки аптечной (Matricaria chamomilla) [syn. Matricaria recutita] и тысячелистника обыкновенного (Achillea millefolium).
- Гвайазулен 1,4-диметил-7-изопропилазулен: входит в состав эфирного масла некоторых эвкалиптов; выделяется из высококипящих фракций эфирного масла Eucalyptus globulus, гурьюн-бальзама, реюньонской герани, Geranium macrorrhizum и пачули.
- Изогвайазулен 2,4-диметил-7-изопропилазулен. Найден в эфирном масле тысячелистника обыкновенного (Achillea millefolium).
Физические свойства[править | править код]
Кристаллическое вещество синего или сине-фиолетового цвета. Нерастворим в воде, растворим в углеводородах, диэтиловом эфире, этаноле. Перегоняется с паром[3].
Хорошо растворяется в серной и фосфорной кислоте с образованием солей (при этом его синяя окраска исчезает). Легко образует π-комплексы с пикриновой кислотой и тринитробензолом.
Молекула обладает дипольным моментом.
Химические свойства[править | править код]
- При нагревании свыше 300 °C изомеризуется в нафталин.
- Постепенно окисляется кислородом воздуха, а при действии KMnO4 в кислой среде расщепляется до смеси жидких и газообразных продуктов.
- В реакциях электрофильного и радикального замещения ведёт себя подобно высокоактивным пятичленным гетероциклам.
Вследствие высокой электронной плотности на 5-членном цикле, азулен обладает относительно высокой химической активностью, легко вступая в реакции с электрофильными агентами.
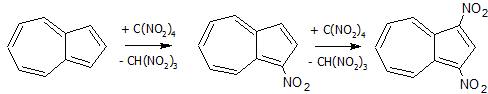
Относительно легко нитруется тетранитрометаном в среде пиридина:
В реакциях галогенирования, ацилирования, азосочетания и др. замещение идёт в положение 1 и затем 3:
- В реакциях с нуклеофилами азулен менее активен, замещение идёт в положение 4, 8 и далее в 6.
Получение[править | править код]
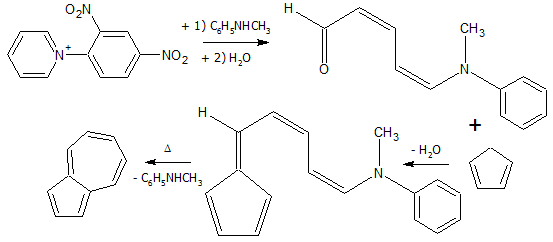
- Из солей пиридиния[3]:
- По реакции 1,1-тиофендиоксида с диметиламинофульвеном[4]:
Применение[править | править код]
Азулен и, особенно, его природные производные достаточно широко используются в парфюмерии и косметике: входят в состав зубных паст, кремов, шампуней и других средств ухода за телом.
Физиологическая роль[править | править код]
Азулены обладают противовоспалительной, антиаллергенной и бактериостатической активностью, на чём и основано их применение.
Примечания[править | править код]
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ АЗУЛЕНЫ. Дата обращения: 22 июня 2009. Архивировано 25 июня 2013 года.
- ↑ 1 2 Химическая энциклопедия./ Азулен. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 1.
- ↑ Архивированная копия. Дата обращения: 23 июня 2009. Архивировано 22 октября 2020 года.