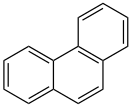
Фенантрен
| Фенантрен | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
фенантрен | ||
| Хим. формула | C14H10 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 178,23 г/моль | ||
| Плотность | 1,179 г/см³ | ||
| Энергия ионизации | 7,86 эВ[3] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 101 °C | ||
| • кипения | 340 °C | ||
| • вспышки | 171 °C[1][2] | ||
| • самовоспламенения | 450 °C[2] | ||
| Давление пара | 1 Па[4], 10 Па[4], 100 Па[4], 1 кПа[4], 10 кПа[4] и 100 кПа[4] | ||
| Оптические свойства | |||
| Показатель преломления | 1,5942 | ||
| Классификация | |||
| Рег. номер CAS | 85-01-8 | ||
| PubChem | 995 | ||
| Рег. номер EINECS | 201-581-5 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 28851 | ||
| ChemSpider | 970 | ||
| Безопасность | |||
| Предельная концентрация | 0,8 мг/м³ | ||
| ЛД50 | 132 мг/кг | ||
| Токсичность | высокая | ||
| Краткие характер. опасности (H) |
H302, H410 |
||
| Меры предостор. (P) |
P262, P272 |
||
| Сигнальное слово | осторожно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фенантре́н — (трицикло-[8.4.0.02,7]-тетрадека-1,3,5,7,9,11,13-гептаен) — органическое вещество; трициклический ароматический углеводород. В больших концентрациях ядовит. Относится ко II классу опасности.
Свойства
[править | править код]Фенантрен представляет собой блестящие бесцветные кристаллы. Не растворяется в воде, растворяется в органических растворителях (диэтиловом эфире, бензоле, хлороформе, метаноле, уксусной кислоте). Растворы фенантрена флуоресцируют голубым цветом.
По химическим свойствам напоминает нафталин:
- при действии хлора и брома образует соответствующие 9,10-дигалогенфенантрены
- нитруется с образованием 9-, 1- и 3-нитрофенантренов
- сульфируется до 2-, 3- и 9-фенантренсульфокислот
- восстанавливается натрием в амиловом спирте до 9,10-дигидрофенантрена и далее до тетрантрена
- окисляется до фенантрен-9,10-хинона
Нахождение фенантрена в природе
[править | править код]Содержится в каменноугольной смоле вместе со своим линейным изомером антраценом. Производные фенантрена широко распространены в живой природе (стероиды, алкалоиды группы морфина).
Виды растений, богатые производными фенантрена, в основном включают семейства орхидных, ситниковых, диоскорейных и лавровых. Из природных растений выделено более 500 производных фенантрена.[5]
Применение
[править | править код]Фенантрен применяется при производстве красителей. Является стабилизатором взрывчатых веществ.
Производные фенантренов используются в традиционной китайской медицине. Фенантрены, извлеченные из натуральных продуктов, имеют следующие медицинские свойства: противовоспалительное, антибактериальное, спазмолитическое, противоаллергическое и антитромбоцитарное действие.[5]
Влияние на здоровье
[править | править код]В исследовании 2010 года Стивена С. Хехта (Stephen S. Hecht) и его коллег было показано, что фенантрен, содержащийся в сигаретном дыме, может разрушать ДНК после попадания в кровь.[6][7]
Исследование в 2022 году показало, что в комнате с компьютером уровни содержания в воздухе полициклических ароматических углеводородов (ПАУ) были в 2—2,5 раз выше, чем на открытом воздухе или в помещении без компьютера. Преобладающими были такие токсичные вещества как нафталин и фенантрен.[8]
Примечания
[править | править код]- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 16—29. — ISBN 978-1-4987-5428-6
- ↑ 1 2 Phenanthrene (англ.)
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 3 4 5 6 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 6—120. — ISBN 978-1-4987-5428-6
- ↑ 1 2 Jingyi Li, Wentao Feng, Rongji Dai, Bo Li. Recent Progress on the Identification of Phenanthrene Derivatives in Traditional Chinese Medicine and Their Biological Activities (англ.) // Pharmacological Research - Modern Chinese Medicine. — 2022-06-01. — Vol. 3. — P. 100078. — ISSN 2667-1425. — doi:10.1016/j.prmcm.2022.100078. Архивировано 22 мая 2022 года.
- ↑ Курение приводит к повреждению ДНК за минуты, 2011
Yan Zhong, Steven G. Carmella, Pramod Upadhyaya, J. Bradley Hochalter, Diane Rauch, Andrew Oliver, Joni Jensen, Dorothy Hatsukami, Jing Wang, Cheryl Zimmerman, Stephen S. Hecht. Immediate Consequences of Cigarette Smoking: Rapid Formation of Polycyclic Aromatic Hydrocarbon Diol Epoxides. Chemical Research in Toxicology, 2010; 101227010050010 DOI:10.1021/tx100345x - ↑ Yan Zhong, Jing Wang, Steven G. Carmella, J. Bradley Hochalter, Diane Rauch. Metabolism of [D10Phenanthrene to Tetraols in Smokers for Potential Lung Cancer Susceptibility Assessment: Comparison of Oral and Inhalation Routes of Administration] // The Journal of Pharmacology and Experimental Therapeutics. — 2011-7. — Т. 338, вып. 1. — С. 353–361. — ISSN 0022-3565. — doi:10.1124/jpet.111.181719.
- ↑ Sung-Hee Seo, Kuen-Sik Jung, Min-Kyu Park, Hye-Ok Kwon, Sung-Deuk Choi. Indoor air pollution of polycyclic aromatic hydrocarbons emitted by computers (англ.) // Building and Environment. — 2022-06-15. — Vol. 218. — P. 109107. — ISSN 0360-1323. — doi:10.1016/j.buildenv.2022.109107.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.
- Вредные вещества в промышленности. т.1 с. 136 — Л., «Химия», 1976.