Белки: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
Shureg (обсуждение | вклад) отмена ошибочного отката |
Please add reliable sources - {{подст:АИ}} source request 42 times |
||
| Строка 1: | Строка 1: | ||
{{значения}} |
{{значения}} |
||
'''Белки́''' ('''протеи́ны''', '''полипепти́ды'''<ref>С химической точки зрения все белки являются политептидами. Однако короткие, меньше 30 аминокислот в длину полипептиды, особенно химически синтезированные, нельзя назвать белками.</ref>) — [[Высокомолекулярные соединения|высокомолекулярные]] [[органические вещества]], состоящие из соединённых в цепочку [[пептидная связь|пептидной связью]] [[аминокислоты|аминокислот]]. В живых организмах аминокислотный состав белков определяется [[генетический код|генетическим кодом]], при синтезе в большинстве случаев используется 20 [[Аминокислоты#Альфа-аминокислоты белков|стандартных аминокислот]]. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются [[Посттрансляционная модификация|посттрансляционным модификациям]], которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, [[фотосинтез|фотосинтетический комплекс]]. |
'''Белки́''' ('''протеи́ны''', '''полипепти́ды'''<ref>С химической точки зрения все белки являются политептидами. Однако короткие, меньше 30 аминокислот в длину полипептиды, особенно химически синтезированные, нельзя назвать белками.</ref>) — [[Высокомолекулярные соединения|высокомолекулярные]] [[органические вещества]], состоящие из соединённых в цепочку [[пептидная связь|пептидной связью]] [[аминокислоты|аминокислот]]. В живых организмах аминокислотный состав белков определяется [[генетический код|генетическим кодом]], при синтезе в большинстве случаев используется 20 [[Аминокислоты#Альфа-аминокислоты белков|стандартных аминокислот]]. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются [[Посттрансляционная модификация|посттрансляционным модификациям]], которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, [[фотосинтез|фотосинтетический комплекс]].{{нет АИ|16|01|2010}} |
||
[[Файл:Protein crystals grown in space.jpg|thumb|Кристаллы различных белков, выращенные на [[Мир (орбитальная станция)|космической станции «Мир»]] и во время полётов [[шаттл]]ов [[НАСА]]. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка.]] |
[[Файл:Protein crystals grown in space.jpg|thumb|Кристаллы различных белков, выращенные на [[Мир (орбитальная станция)|космической станции «Мир»]] и во время полётов [[шаттл]]ов [[НАСА]]. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка.]] |
||
__TOC__ |
__TOC__ |
||
Функции белков в [[Клетка|клетках живых организмов]] более разнообразны, чем функции других [[биополимеры|биополимеров]] — [[полисахарид]]ов и [[ДНК]]. Так, белки-[[ферменты]] катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя [[цитоскелет]], поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при [[Иммунитет (биология)|иммунном ответе]] и в [[клеточный цикл|клеточном цикле]]. |
Функции белков в [[Клетка|клетках живых организмов]] более разнообразны, чем функции других [[биополимеры|биополимеров]] — [[полисахарид]]ов и [[ДНК]]. Так, белки-[[ферменты]] катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя [[цитоскелет]], поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при [[Иммунитет (биология)|иммунном ответе]] и в [[клеточный цикл|клеточном цикле]].{{нет АИ|16|01|2010}} |
||
Белки — важная часть питания [[животные|животных]] и [[человек]]а, поскольку в их организме не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе [[пищеварение|пищеварения]] [[ферменты]] разрушают потреблённые белки до аминокислот, которые используются при [[трансляция (биология)|биосинтезе белков]] организма или подвергаются дальнейшему распаду для получения [[энергия|энергии]]. |
Белки — важная часть питания [[животные|животных]] и [[человек]]а, поскольку в их организме не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе [[пищеварение|пищеварения]] [[ферменты]] разрушают потреблённые белки до аминокислот, которые используются при [[трансляция (биология)|биосинтезе белков]] организма или подвергаются дальнейшему распаду для получения [[энергия|энергии]].{{нет АИ|16|01|2010}} |
||
Определение аминокислотной последовательности первого белка — [[инсулин]]а — методом [[секвенирование|секвенирования]] белков принесло [[Сенгер, Фредерик|Фредерику Сенгеру]] [[Нобелевская премия по химии|Нобелевскую премию по химии]] в [[1958 год]]у. |
Определение аминокислотной последовательности первого белка — [[инсулин]]а — методом [[секвенирование|секвенирования]] белков принесло [[Сенгер, Фредерик|Фредерику Сенгеру]] [[Нобелевская премия по химии|Нобелевскую премию по химии]] в [[1958 год]]у. |
||
| Строка 36: | Строка 36: | ||
|страницы = 662—666 |
|страницы = 662—666 |
||
}} |
}} |
||
</ref>, за что в [[1962 год]]у они получили [[Нобелевская премия по химии|Нобелевскую премию по химии]]. |
</ref>, за что в [[1962 год]]у они получили [[Нобелевская премия по химии|Нобелевскую премию по химии]].{{нет АИ|16|01|2010}} |
||
== История изучения == |
== История изучения == |
||
[[Файл:Antoine François, comte de Fourcroy.jpg|thumb|''Антуан Франсуа де Фуркруа'', основоположник изучения белков]]Белки были выделены в отдельный класс биологических [[молекула|молекул]] в [[XVIII век]]е в результате работ французского химика [[Фуркруа, Антуан Франсуа|Антуана Фуркруа]] и других учёных, в которых было отмечено свойство белков [[коагуляция|коагулировать]] ([[Денатурация белков|денатурировать]]) под воздействием нагревания или [[кислоты|кислот]]. В то время были исследованы такие белки, как [[альбумин]] («яичный белок»), [[фибрин]] (белок из [[кровь|крови]]) и [[глютен]] из зерна [[пшеница|пшеницы]]. Голландский химик [[Мульдер, Геррит Ян|Геррит Мульдер]] провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную [[эмпирическая формула|эмпирическую формулу]]. Термин «протеин» для обозначения подобных молекул был предложен в [[1838 год]]у сотрудником Мульдера [[Берцелиус, Йёнс Якоб|Якобом Берцелиусом]] <ref>Leicester, Henry . «Berzelius, Jöns Jacob». Dictionary of Scientific Biography 2. New York: Charles Scribner’s Sons. 90-97 (1980). ISBN 0-684-10114-9</ref>. Мульдер также определил продукты разрушения белков — [[аминокислоты]] и для одной из них ([[лейцин]]а) почти точно определил молекулярную массу — 131 [[атомная единица массы|дальтон]]. В 1836 Мулдер предложил первую модель химического строения белков. Основываясь на теории [[радикал (химия)|радикалов]] он сформулировал понятие о минимальной структурной единице состава белка, C<sub>16</sub>H<sub>24</sub>N<sub>4</sub>O<sub>5</sub>, которая была названа протеин (Pr), а теория — теорией протеина <ref>{{cite book|author=Ю.А. Овчинникова |title=Биоорганическая химия|city=Москва| publisher=Просвещение|year=1987}}</ref>. По мере накопления новых данных о белках теория неоднократно подвергалась критике, но до конца 1850-х оставалась общепризнанной. |
[[Файл:Antoine François, comte de Fourcroy.jpg|thumb|''Антуан Франсуа де Фуркруа'', основоположник изучения белков]] Белки были выделены в отдельный класс биологических [[молекула|молекул]] в [[XVIII век]]е в результате работ французского химика [[Фуркруа, Антуан Франсуа|Антуана Фуркруа]] и других учёных, в которых было отмечено свойство белков [[коагуляция|коагулировать]] ([[Денатурация белков|денатурировать]]) под воздействием нагревания или [[кислоты|кислот]]. В то время были исследованы такие белки, как [[альбумин]] («яичный белок»), [[фибрин]] (белок из [[кровь|крови]]) и [[глютен]] из зерна [[пшеница|пшеницы]]. Голландский химик [[Мульдер, Геррит Ян|Геррит Мульдер]] провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную [[эмпирическая формула|эмпирическую формулу]]. Термин «протеин» для обозначения подобных молекул был предложен в [[1838 год]]у сотрудником Мульдера [[Берцелиус, Йёнс Якоб|Якобом Берцелиусом]] <ref>Leicester, Henry . «Berzelius, Jöns Jacob». Dictionary of Scientific Biography 2. New York: Charles Scribner’s Sons. 90-97 (1980). ISBN 0-684-10114-9</ref>. Мульдер также определил продукты разрушения белков — [[аминокислоты]] и для одной из них ([[лейцин]]а) почти точно определил молекулярную массу — 131 [[атомная единица массы|дальтон]]. В 1836 Мулдер предложил первую модель химического строения белков. Основываясь на теории [[радикал (химия)|радикалов]] он сформулировал понятие о минимальной структурной единице состава белка, C<sub>16</sub>H<sub>24</sub>N<sub>4</sub>O<sub>5</sub>, которая была названа протеин (Pr), а теория — теорией протеина <ref>{{cite book|author=Ю.А. Овчинникова |title=Биоорганическая химия|city=Москва| publisher=Просвещение|year=1987}}</ref>. По мере накопления новых данных о белках теория неоднократно подвергалась критике, но до конца 1850-х оставалась общепризнанной.{{нет АИ|16|01|2010}} |
||
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог [[Коссель, Альбрехт|Альбрехт Коссель]] выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков<ref>{{cite book|chapter = Белки | title = Химическая энциклопедия|publisher=Советская энциклопедия|city = Москва|year=1988 | chapterlink = http://www.cnshb.ru/AKDiL/0048/base/RB/030001.shtm}}</ref>. В начале XX века немецкий химик [[Фишер, Герман Эмиль|Эмиль Фишер]] экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза |
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог [[Коссель, Альбрехт|Альбрехт Коссель]] выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков<ref>{{cite book|chapter = Белки | title = Химическая энциклопедия|publisher=Советская энциклопедия|city = Москва|year=1988 | chapterlink = http://www.cnshb.ru/AKDiL/0048/base/RB/030001.shtm}}</ref>. В начале XX века немецкий химик [[Фишер, Герман Эмиль|Эмиль Фишер]] экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза{{нет АИ|16|01|2010}} |
||
Однако центральная роль белков в организмах не была признана до [[1926 год]]а, когда американский химик [[Самнер, Джеймс Бетчеллер|Джеймс Самнер]] (впоследствии — лауреат [[Нобелевская премия по химии|Нобелевской премии]]) показал, что фермент [[уреаза]] была белком<ref name="evolution">N. H. Barton, D. E. G. Briggs, J. A. Eisen «Evolution», Cold Spring Harbor Laboratory Press, 2007 — P. 38. ISBN 978-0-87969-684-9</ref>. |
Однако центральная роль белков в организмах не была признана до [[1926 год]]а, когда американский химик [[Самнер, Джеймс Бетчеллер|Джеймс Самнер]] (впоследствии — лауреат [[Нобелевская премия по химии|Нобелевской премии]]) показал, что фермент [[уреаза]] была белком<ref name="evolution">N. H. Barton, D. E. G. Briggs, J. A. Eisen «Evolution», Cold Spring Harbor Laboratory Press, 2007 — P. 38. ISBN 978-0-87969-684-9</ref>. |
||
Изучению белков препятствовала сложность их выделения. Поэтому первые исследования белков проводились с использованием тех [[Полипептиды|полипептидов]], которые могли быть очищены в большом количестве, то есть белков [[кровь|крови]], [[курица|куриных]] яиц, различных [[токсин]]ов и пищеварительных/метаболических [[фермент]]ов, которые можно было выделить в местах забоя скота. В конце 1950-х годов компания ''Armour Hot Dog Co'' смогла очистить килограмм [[быки|бычьей]] [[поджелудочная железа|панкреатической]] [[рибонуклеаза|рибонуклеазы А]], которая стала экспериментальным объектом для многих учёных. |
Изучению белков препятствовала сложность их выделения. Поэтому первые исследования белков проводились с использованием тех [[Полипептиды|полипептидов]], которые могли быть очищены в большом количестве, то есть белков [[кровь|крови]], [[курица|куриных]] яиц, различных [[токсин]]ов и пищеварительных/метаболических [[фермент]]ов, которые можно было выделить в местах забоя скота. В конце 1950-х годов компания ''Armour Hot Dog Co'' смогла очистить килограмм [[быки|бычьей]] [[поджелудочная железа|панкреатической]] [[рибонуклеаза|рибонуклеазы А]], которая стала экспериментальным объектом для многих учёных.{{нет АИ|16|01|2010}} |
||
Идея о том, что вторичная структура белков образуется в результате образования [[водородная связь|водородных связей]] между аминокислотами, была высказана [[Астбери, Уильям|Уильямом Астбери]] в [[1933 год]]у, но [[Полинг, Лайнус Карл|Лайнус Полинг]] считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее [[Каузман, Уолтер|Уолтер Каузман]], опираясь на работы [[Линдерстрём-Ланг, Кай Ульрик|Кая Линдерстрём-Ланга]], внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В [[1949 год]]у [[Сенгер, Фредерик|Фред Сенгер]] определил аминокислотную последовательность [[инсулин]]а, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых [[сахар]]ов) цепи, [[коллоиды]] или [[циклолы]]. Первые структуры белков, основанные на [[дифракция|дифракции]] рентгеновских лучей на уровне отдельных [[атом]]ов были получены в 1960-х годах и с помощью [[ЯМР]] в 1980-х годах. В [[2006 год]]у Банк данных о белках (''Protein Data Bank'') содержал около 40 000 структур белков. |
Идея о том, что вторичная структура белков образуется в результате образования [[водородная связь|водородных связей]] между аминокислотами, была высказана [[Астбери, Уильям|Уильямом Астбери]] в [[1933 год]]у, но [[Полинг, Лайнус Карл|Лайнус Полинг]] считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее [[Каузман, Уолтер|Уолтер Каузман]], опираясь на работы [[Линдерстрём-Ланг, Кай Ульрик|Кая Линдерстрём-Ланга]], внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В [[1949 год]]у [[Сенгер, Фредерик|Фред Сенгер]] определил аминокислотную последовательность [[инсулин]]а, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых [[сахар]]ов) цепи, [[коллоиды]] или [[циклолы]]. Первые структуры белков, основанные на [[дифракция|дифракции]] рентгеновских лучей на уровне отдельных [[атом]]ов были получены в 1960-х годах и с помощью [[ЯМР]] в 1980-х годах. В [[2006 год]]у Банк данных о белках (''Protein Data Bank'') содержал около 40 000 структур белков.{{нет АИ|16|01|2010}} |
||
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных [[клетка|клеток]], [[ткань (биология)|тканей]] или организмов. Эта область биохимии называется [[протеомика|протеомикой]]. С помощью методов [[биоинформатика|биоинформатики]] стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время крио[[электронная микроскопия]] больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне. |
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных [[клетка|клеток]], [[ткань (биология)|тканей]] или организмов. Эта область биохимии называется [[протеомика|протеомикой]]. С помощью методов [[биоинформатика|биоинформатики]] стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время крио[[электронная микроскопия]] больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.{{нет АИ|16|01|2010}} |
||
== Свойства == |
== Свойства == |
||
| Строка 55: | Строка 55: | ||
Размер белка может измеряться в числе аминокислот или в [[атомная единица массы|дальтонах]] ([[молекулярная масса]]), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки [[дрожжи|дрожжей]], в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин (другие названия: [[тайтин]], [[коннектин]]) — является компонентом [[саркомер]]ов [[мускул]]ов; молекулярная масса его различных изоформ варьирует в интервале от 3 000 до 3 700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius<ref> {{cite journal|author=Fulton A, Isaacs W |title=Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis |journal=Bioessays |volume=13 |issue=4 |pages=157–61 |year=1991 |pmid=1859393}}</ref>). |
Размер белка может измеряться в числе аминокислот или в [[атомная единица массы|дальтонах]] ([[молекулярная масса]]), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки [[дрожжи|дрожжей]], в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин (другие названия: [[тайтин]], [[коннектин]]) — является компонентом [[саркомер]]ов [[мускул]]ов; молекулярная масса его различных изоформ варьирует в интервале от 3 000 до 3 700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius<ref> {{cite journal|author=Fulton A, Isaacs W |title=Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis |journal=Bioessays |volume=13 |issue=4 |pages=157–61 |year=1991 |pmid=1859393}}</ref>). |
||
Белки являются [[Амфотерность|амфотерными]] [[полиэлектролит]]ами (полиамфолитами), при этом группами, способными к [[ион]]изации в растворе, являются [[Карбоксильная группа|карбоксильные остатки]] боковых цепей кислых аминокислот ([[Аспарагиновая кислота|аспарагиновая]] и [[глутаминовая кислота|глутаминовая]] кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь <math>\omega</math>-[[аминогруппа]] [[лизин]]а и [[Амидины|амидиновый]] остаток CNH(NH<sub>2</sub>) [[аргинин]]а, в несколько меньшей степени — [[Имидазолы|имидазольный]] остаток [[гистидин]]а). Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды [[рН]], при которой молекулы данного белка не несут [[электрический заряд|электрического заряда]] и, соответственно, не перемещаются в электрическом поле (например, при [[электрофорез]]е). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI. |
Белки являются [[Амфотерность|амфотерными]] [[полиэлектролит]]ами (полиамфолитами), при этом группами, способными к [[ион]]изации в растворе, являются [[Карбоксильная группа|карбоксильные остатки]] боковых цепей кислых аминокислот ([[Аспарагиновая кислота|аспарагиновая]] и [[глутаминовая кислота|глутаминовая]] кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь <math>\omega</math>-[[аминогруппа]] [[лизин]]а и [[Амидины|амидиновый]] остаток CNH(NH<sub>2</sub>) [[аргинин]]а, в несколько меньшей степени — [[Имидазолы|имидазольный]] остаток [[гистидин]]а). Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды [[рН]], при которой молекулы данного белка не несут [[электрический заряд|электрического заряда]] и, соответственно, не перемещаются в электрическом поле (например, при [[электрофорез]]е). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI.{{нет АИ|16|01|2010}} |
||
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 — основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для [[пепсин]]а — протеолитического фермента сильнокислого желудочного сока pI ~ 1<ref>http://www.brenda-enzymes.info/php/result_flat.php4?ecno=3.4.23.1</ref>, а для сальмина — белка-[[Протамины|протамина]] [[Молоки|молок]] лосося, особенностью которого является чрезвычайно высокое содержание аргинина, pI ~ 12. Белки, связывающиеся с [[нуклеиновые кислоты|нуклеиновыми кислотами]] за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат [[гистоны]] и [[протамины]]. |
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 — основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для [[пепсин]]а — протеолитического фермента сильнокислого желудочного сока pI ~ 1<ref>http://www.brenda-enzymes.info/php/result_flat.php4?ecno=3.4.23.1</ref>, а для сальмина — белка-[[Протамины|протамина]] [[Молоки|молок]] лосося, особенностью которого является чрезвычайно высокое содержание аргинина, pI ~ 12. Белки, связывающиеся с [[нуклеиновые кислоты|нуклеиновыми кислотами]] за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат [[гистоны]] и [[протамины]].{{нет АИ|16|01|2010}} |
||
По степени растворимости в воде белки бывают растворимыми и нерастворимыми. Большинство белков растворяются в воде. К нерастворимым относятся, например, [[кератин]] (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т.п.) и [[фиброин]], который входит в состав [[шёлк]]а и [[паутина|паутины]]. Белки также делятся на [[гидрофильность|гидрофильные]] и [[гидрофобность|гидрофобные]]. К гидрофильным относятся большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относятся большинство белков, входящих в состав [[Клеточные мембраны|биологических мембран]] интегральных мембранных белков, которые взаимодействуют с гидрофобными [[липиды|липидами]] мембраны <ref>S J Singer. The Structure and Insertion of Integral Proteins in Membranes. Annual Review of Cell Biology. Volume 6, Page 247—296. 1990</ref> (у этих белков обычно есть и небольшие гидрофильные участки). |
По степени растворимости в воде белки бывают растворимыми и нерастворимыми. Большинство белков растворяются в воде. К нерастворимым относятся, например, [[кератин]] (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т.п.) и [[фиброин]], который входит в состав [[шёлк]]а и [[паутина|паутины]]. Белки также делятся на [[гидрофильность|гидрофильные]] и [[гидрофобность|гидрофобные]]. К гидрофильным относятся большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относятся большинство белков, входящих в состав [[Клеточные мембраны|биологических мембран]] интегральных мембранных белков, которые взаимодействуют с гидрофобными [[липиды|липидами]] мембраны <ref>S J Singer. The Structure and Insertion of Integral Proteins in Membranes. Annual Review of Cell Biology. Volume 6, Page 247—296. 1990</ref> (у этих белков обычно есть и небольшие гидрофильные участки).{{нет АИ|16|01|2010}} |
||
=== Денатурация === |
=== Денатурация === |
||
| Строка 73: | Строка 73: | ||
[[Файл:Amino-veresterung.jpg|thumb|450px|Схематическое изображение образования пептидной связи (справа). Подобная реакция происходит в молекулярной машине по образованию белка — [[рибосома|рибосоме]]]] |
[[Файл:Amino-veresterung.jpg|thumb|450px|Схематическое изображение образования пептидной связи (справа). Подобная реакция происходит в молекулярной машине по образованию белка — [[рибосома|рибосоме]]]] |
||
[[молекула|Молекулы]] белков представляют собой линейные [[полимер]]ы, состоящие из [[аминокислоты|α-L-аминокислот]] (которые являются [[мономер]]ами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, [[посттрансляционная модификация|модификации]] происходят уже после синтеза белка на [[рибосома|рибосоме]]). Для обозначения [[аминокислоты|аминокислот]] в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10<sup>130</sup> вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют '''пептидами''', при большей степени полимеризации — '''белками''', хотя это деление весьма условно. |
[[молекула|Молекулы]] белков представляют собой линейные [[полимер]]ы, состоящие из [[аминокислоты|α-L-аминокислот]] (которые являются [[мономер]]ами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, [[посттрансляционная модификация|модификации]] происходят уже после синтеза белка на [[рибосома|рибосоме]]). Для обозначения [[аминокислоты|аминокислот]] в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10<sup>130</sup> вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют '''пептидами''', при большей степени полимеризации — '''белками''', хотя это деление весьма условно.{{нет АИ|16|01|2010}} |
||
При образовании белка в результате взаимодействия α-аминогруппы (-NH<sub>2</sub>) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются [[пептидная связь|пептидные связи]]. Концы белка называют С- и N- концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH<sub>2</sub>, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца. |
При образовании белка в результате взаимодействия α-аминогруппы (-NH<sub>2</sub>) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются [[пептидная связь|пептидные связи]]. Концы белка называют С- и N- концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH<sub>2</sub>, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.{{нет АИ|16|01|2010}} |
||
Последовательность аминокислот в белке соответствует [[Реализация генетической информации|информации]], содержащейся в [[ген]]е данного белка. Эта информация представлена в виде последовательности [[нуклеотид]]ов, причём одной аминокислоте соответствует в ДНК последовательность из трёх нуклеотидов — так называемый '''[[Триплет (биология)|триплет]]''' или [[кодон]]. То, какая [[аминокислоты|аминокислота]] соответствует данному кодону в [[мРНК]], определяется [[генетический код|генетическим кодом]], который может несколько отличаться у разных организмов. Так как аминокислоты синтезируются на рибосомах из 20-ти аминокислот, а триплетов, которыми они закодированы в ДНК, у разных организмов от 61 до 63, то большинство аминокислот может быть закодировано разными триплетами (генетический код вырожденный, или избыточный). |
Последовательность аминокислот в белке соответствует [[Реализация генетической информации|информации]], содержащейся в [[ген]]е данного белка. Эта информация представлена в виде последовательности [[нуклеотид]]ов, причём одной аминокислоте соответствует в ДНК последовательность из трёх нуклеотидов — так называемый '''[[Триплет (биология)|триплет]]''' или [[кодон]]. То, какая [[аминокислоты|аминокислота]] соответствует данному кодону в [[мРНК]], определяется [[генетический код|генетическим кодом]], который может несколько отличаться у разных организмов. Так как аминокислоты синтезируются на рибосомах из 20-ти аминокислот, а триплетов, которыми они закодированы в ДНК, у разных организмов от 61 до 63, то большинство аминокислот может быть закодировано разными триплетами (генетический код вырожденный, или избыточный). {{нет АИ|16|01|2010}} |
||
[[Файл:Protein alignment.jpg|300px|thumb|Сравнение аминокислотных последовательностей белков (в данном случае — [[гемоглобин]]ов) из разных организмов позволяет определять участки, важные для функционирования белков, а также эволюционную историю сравниваемых видов]] |
[[Файл:Protein alignment.jpg|300px|thumb|Сравнение аминокислотных последовательностей белков (в данном случае — [[гемоглобин]]ов) из разных организмов позволяет определять участки, важные для функционирования белков, а также эволюционную историю сравниваемых видов]] |
||
Гомологичные белки (предположительно имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, [[гемоглобин]]ы разных организмов, имеют во многих местах цепи идентичные, ''консервативные'' остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые ''вариабельными''. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между [[таксон]]ами, к которым принадлежат сравниваемые организмы. |
Гомологичные белки (предположительно имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, [[гемоглобин]]ы разных организмов, имеют во многих местах цепи идентичные, ''консервативные'' остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые ''вариабельными''. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между [[таксон]]ами, к которым принадлежат сравниваемые организмы.{{нет АИ|16|01|2010}} |
||
[[Файл:Protein-structure ru.jpg|thumb|left|200px|Уровни структуры белков: 1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная]] |
[[Файл:Protein-structure ru.jpg|thumb|left|200px|Уровни структуры белков: 1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная]] |
||
| Строка 100: | Строка 100: | ||
:* [[ионная связь|ионные связи]] между противоположно заряженными боковыми группами аминокислотных остатков; |
:* [[ионная связь|ионные связи]] между противоположно заряженными боковыми группами аминокислотных остатков; |
||
:* водородные связи; |
:* водородные связи; |
||
:* [[гидрофобность|гидрофильно-гидрофобные]] взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула "стремится" свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы. |
:* [[гидрофобность|гидрофильно-гидрофобные]] взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула "стремится" свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы. {{нет АИ|16|01|2010}} |
||
Белки разделяют на группы согласно их трёхмерной структуре. Большинство белков относятся к [[глобулярные белки|глобулярным]]: общая форма из молекулы более или менее сферическая. Меньшая часть белков относится к [[фибриллярные белки|фибриллярным]]: их молекулы (обычно и надмолекулярные комплексы) в работающем состоянии представляют собой сильно вытянутые волокна. К фибриллярным белкам относятся, например, [[кератин]] и [[коллаген]]. Среди глобулярных и фибриллярных белков выделяют подгруппы. Например, изображённый на картинке справа глобулярный белок, [[триозофосфатизомераза]], состоит из восьми α-спиралей, расположенных на внешней поверхности структуры и восьми параллельных β-слоёв внутри структуры. Белки с подобным трёхмерным строением называются αβ-баррелы (от англ. barrel — бочка) [http://pdbdev.sdsc.edu:48346/pdb/molecules/pdb50_6.html]. |
Белки разделяют на группы согласно их трёхмерной структуре. Большинство белков относятся к [[глобулярные белки|глобулярным]]: общая форма из молекулы более или менее сферическая. Меньшая часть белков относится к [[фибриллярные белки|фибриллярным]]: их молекулы (обычно и надмолекулярные комплексы) в работающем состоянии представляют собой сильно вытянутые волокна. К фибриллярным белкам относятся, например, [[кератин]] и [[коллаген]]. Среди глобулярных и фибриллярных белков выделяют подгруппы. Например, изображённый на картинке справа глобулярный белок, [[триозофосфатизомераза]], состоит из восьми α-спиралей, расположенных на внешней поверхности структуры и восьми параллельных β-слоёв внутри структуры. Белки с подобным трёхмерным строением называются αβ-баррелы (от англ. barrel — бочка) [http://pdbdev.sdsc.edu:48346/pdb/molecules/pdb50_6.html]. |
||
; Четверичная структура : — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру (можно считать её и молекулой, если между разными полипептидными цепями, как это нередко бывает, образуются дисульфидные мостики). В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. |
; Четверичная структура : — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру (можно считать её и молекулой, если между разными полипептидными цепями, как это нередко бывает, образуются дисульфидные мостики). В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. {{нет АИ|16|01|2010}} |
||
Надмолекулярные белковые комплексы могут состоять из десятков молекул, многие из них сравнимы по размеру с рибосомами и в последние годы часто описываются как органоиды (см., напр., [[протеасома]]). Нередко в их состав входят молекулы РНК (см., напр., [[сплайсосома]]). |
Надмолекулярные белковые комплексы могут состоять из десятков молекул, многие из них сравнимы по размеру с рибосомами и в последние годы часто описываются как органоиды (см., напр., [[протеасома]]). Нередко в их состав входят молекулы РНК (см., напр., [[сплайсосома]]). {{нет АИ|16|01|2010}} |
||
Также выделяют: |
Также выделяют:{{нет АИ|16|01|2010}} |
||
* '''Трёхмерную структуру белка''' — набор пространственных координат составляющих белок [[атом]]ов. |
* '''Трёхмерную структуру белка''' — набор пространственных координат составляющих белок [[атом]]ов. |
||
* '''Субъединичную ([[домен белка|доменную]]) структуру белка''' — последовательность участков белка, имеющих известную функцию или определённую трёхмерную структуру. |
* '''Субъединичную ([[домен белка|доменную]]) структуру белка''' — последовательность участков белка, имеющих известную функцию или определённую трёхмерную структуру. |
||
| Строка 124: | Строка 124: | ||
Короткие белки могут быть синтезированы химическим путём с помощью группы методов, которые используют [[Органическая химия|органический синтез]] — например, [[лигазы|химическое лигирование]]<ref>Wilken J, Kent SB.. Curr Opin Biotechnol. Chemical protein synthesis. 1998.9(4):412-26</ref>. |
Короткие белки могут быть синтезированы химическим путём с помощью группы методов, которые используют [[Органическая химия|органический синтез]] — например, [[лигазы|химическое лигирование]]<ref>Wilken J, Kent SB.. Curr Opin Biotechnol. Chemical protein synthesis. 1998.9(4):412-26</ref>. |
||
Большинство методов химического синтеза проходят в направлении от С-конца к N-концу, в противоположность биосинтезу. Таким образом можно синтезировать короткий [[антиген|иммунногенный]] пептид ([[эпитоп]]), служащий для получения антител путём инъекции в животных, или получения [[гибридома|гибридо́м]]; химический синтез также используется для получения ингибиторов некоторых ферментов <ref>Dawson PE, Kent SB. Synthesis of native proteins by chemical ligation. Annu Rev Biochem. 2000;69:923-60</ref>. |
Большинство методов химического синтеза проходят в направлении от С-конца к N-концу, в противоположность биосинтезу. Таким образом можно синтезировать короткий [[антиген|иммунногенный]] пептид ([[эпитоп]]), служащий для получения антител путём инъекции в животных, или получения [[гибридома|гибридо́м]]; химический синтез также используется для получения ингибиторов некоторых ферментов <ref>Dawson PE, Kent SB. Synthesis of native proteins by chemical ligation. Annu Rev Biochem. 2000;69:923-60</ref>. |
||
Химический синтез позволяет вводить искусственные, то есть не встречающиеся в обычных белках аминокислоты — например, присоединять [[Флюорофор|флюоресцентные метки]] к боковым цепям аминокислот. Однако химические методы синтеза неэффективны при длине белков более 300 аминокислот; кроме того, искусственные белки могут иметь неправильную третичную структуру, и у аминокислот искусственных белков отсутствуют посттрансляционные модификации. |
Химический синтез позволяет вводить искусственные, то есть не встречающиеся в обычных белках аминокислоты — например, присоединять [[Флюорофор|флюоресцентные метки]] к боковым цепям аминокислот. Однако химические методы синтеза неэффективны при длине белков более 300 аминокислот; кроме того, искусственные белки могут иметь неправильную третичную структуру, и у аминокислот искусственных белков отсутствуют посттрансляционные модификации.{{нет АИ|16|01|2010}} |
||
=== Биосинтез белков === |
=== Биосинтез белков === |
||
| Строка 132: | Строка 132: | ||
[[Файл:Ribosome (bacteria).JPG|300px|thumb|Молекулярная модель малой (слева) и большой (справа) субъединиц бактериальной рибосомы — молекулярной машины, синтезирующей белки. Голубым цветом показаны белки в составе рибосомы, но основную структурную роль выполняет [[рРНК]] ]] |
[[Файл:Ribosome (bacteria).JPG|300px|thumb|Молекулярная модель малой (слева) и большой (справа) субъединиц бактериальной рибосомы — молекулярной машины, синтезирующей белки. Голубым цветом показаны белки в составе рибосомы, но основную структурную роль выполняет [[рРНК]] ]] |
||
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в [[ген]]ах. Каждый белок состоит из уникальной последовательности аминокислот, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. [[Генетический код]] составляется из трёхбуквенных «слов», называемых [[кодон]]ами; каждый кодон отвечает за присоединение к белку одной аминокислоты: например, сочетание АУГ соответствует [[метионин]]у. Поскольку ДНК состоит из четырёх типов [[нуклеотид]]ов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более, чем одним кодоном. |
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в [[ген]]ах. Каждый белок состоит из уникальной последовательности аминокислот, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. [[Генетический код]] составляется из трёхбуквенных «слов», называемых [[кодон]]ами; каждый кодон отвечает за присоединение к белку одной аминокислоты: например, сочетание АУГ соответствует [[метионин]]у. Поскольку ДНК состоит из четырёх типов [[нуклеотид]]ов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более, чем одним кодоном. |
||
Гены, кодирующие белки сначала [[Транскрипция (биология)|транскрибируются]] в последовательность нуклеотидов матричной РНК ([[мРНК]]) белками [[РНК-полимераза]]ми. |
Гены, кодирующие белки сначала [[Транскрипция (биология)|транскрибируются]] в последовательность нуклеотидов матричной РНК ([[мРНК]]) белками [[РНК-полимераза]]ми.{{нет АИ|16|01|2010}} |
||
У [[прокариот]] мРНК может считываться [[рибосома]]ми в аминокислотную последовательность белков сразу после транскрипции, а у эукариот она [[транспорт]]ируется из ядра в цитоплазму, где находятся рибосомы. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду <ref name="Dobson">Dobson CM. (2000). The nature and significance of protein folding. In ''Mechanisms of Protein Folding'' 2nd ed. Ed. RH Pain. ''Frontiers in Molecular Biology'' series. Oxford University Press: New York, NY.</ref>. |
У [[прокариот]] мРНК может считываться [[рибосома]]ми в аминокислотную последовательность белков сразу после транскрипции, а у эукариот она [[транспорт]]ируется из ядра в цитоплазму, где находятся рибосомы. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду <ref name="Dobson">Dobson CM. (2000). The nature and significance of protein folding. In ''Mechanisms of Protein Folding'' 2nd ed. Ed. RH Pain. ''Frontiers in Molecular Biology'' series. Oxford University Press: New York, NY.</ref>. |
||
Процесс синтеза белка с мРНК называется [[трансляция|трансляцией]]. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых [[факторы инициации|факторов инициации]] присоединена метиониновая транспортная РНК ([[тРНК]]). После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции — элонгация. При каждом движении рибосомы от 5' к 3' концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами ([[кодон]]ом) мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез [[пептидная связь|пептидной связи]] катализируется рибосомальной РНК [[рРНК]], образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК ([[рРНК]]) катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы [[азот]]а и [[углерод]]а в положении, благоприятном для прохождения реакции. Ферменты [[аминоацил-тРНК-синтетазы]] присоединяют аминокислоты к их тРНК. Третья, и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые [[факторы терминации]] [[гидролиз]]уют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C- концу. |
Процесс синтеза белка с мРНК называется [[трансляция|трансляцией]]. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых [[факторы инициации|факторов инициации]] присоединена метиониновая транспортная РНК ([[тРНК]]). После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции — элонгация. При каждом движении рибосомы от 5' к 3' концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами ([[кодон]]ом) мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез [[пептидная связь|пептидной связи]] катализируется рибосомальной РНК [[рРНК]], образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК ([[рРНК]]) катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы [[азот]]а и [[углерод]]а в положении, благоприятном для прохождения реакции. Ферменты [[аминоацил-тРНК-синтетазы]] присоединяют аминокислоты к их тРНК. Третья, и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые [[факторы терминации]] [[гидролиз]]уют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C- концу.{{нет АИ|16|01|2010}} |
||
==== Нерибосомный синтез ==== |
==== Нерибосомный синтез ==== |
||
| Строка 144: | Строка 144: | ||
{{main|Внутриклеточная сортировка белков}} |
{{main|Внутриклеточная сортировка белков}} |
||
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные [[компартмент]]ы клетки — [[ядро]], [[митохондрия|митохондрии]], ЭПР, [[аппарат Гольджи]], [[лизосома|лизосомы]] и др., а некоторые белки должны попасть во внеклеточную среду. Для попадания в определенный компартмент белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или [[сигнальная последовательность белка]]). В некоторых случаях меткой служат посттрансляционно присоединенные к белку олигосахариды. Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путем [[везикулярный транспорт|везикулярного транспорта]]. В ядро белки, обладающие сигнальной последовательностью для ядра, попадают через [[ядерные поры]]. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии [[шапероны|шаперонов]]. |
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные [[компартмент]]ы клетки — [[ядро]], [[митохондрия|митохондрии]], ЭПР, [[аппарат Гольджи]], [[лизосома|лизосомы]] и др., а некоторые белки должны попасть во внеклеточную среду. Для попадания в определенный компартмент белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или [[сигнальная последовательность белка]]). В некоторых случаях меткой служат посттрансляционно присоединенные к белку олигосахариды. Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путем [[везикулярный транспорт|везикулярного транспорта]]. В ядро белки, обладающие сигнальной последовательностью для ядра, попадают через [[ядерные поры]]. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии [[шапероны|шаперонов]].{{нет АИ|16|01|2010}} |
||
== Посттрансляционная модификация белков == |
== Посттрансляционная модификация белков == |
||
| Строка 150: | Строка 150: | ||
[[Файл:Ubiquitin.png|150px|left|thumb|Молекулы убиквитина (оранжевые и розовые) присоединены к белку Src (голубой), предвещая его деградацию]] |
[[Файл:Ubiquitin.png|150px|left|thumb|Молекулы убиквитина (оранжевые и розовые) присоединены к белку Src (голубой), предвещая его деградацию]] |
||
После завершения трансляции и высвобождения белка из рибосомы аминокислоты в составе полипептидной цепи подвергаются разнообразным химическим модификациям. Примерами посттрансляционной модификации являются: |
После завершения трансляции и высвобождения белка из рибосомы аминокислоты в составе полипептидной цепи подвергаются разнообразным химическим модификациям. Примерами посттрансляционной модификации являются:{{нет АИ|16|01|2010}} |
||
* присоединение различных функциональных групп ([[уксусная кислота|ацетил-]], [[метилирование|метил-]] и [[фосфорная кислота|фосфатных]] групп); |
* присоединение различных функциональных групп ([[уксусная кислота|ацетил-]], [[метилирование|метил-]] и [[фосфорная кислота|фосфатных]] групп); |
||
* присоединение [[липид]]ов и [[углеводород]]ов; |
* присоединение [[липид]]ов и [[углеводород]]ов; |
||
| Строка 162: | Строка 162: | ||
== Функции белков в организме == |
== Функции белков в организме == |
||
Так же как и другие биологические макромолекулы ([[полисахарид]]ы, [[липид]]ы) и [[нуклеиновая кислота|нуклеиновые кислоты]], белки — необходимые компоненты всех [[жизнь|живых]] [[организм]]ов, они участвуют в большинстве жизненных процессов [[клетка|клетки]]. Белки осуществляют [[обмен веществ]] и энергетические превращения. Белки входят в состав клеточных структур — [[органеллы|органелл]], секретируются во внеклеточное пространство для обмена сигналами между клетками, [[гидролиз]]а пищи и образования межклеточного вещества. |
Так же как и другие биологические макромолекулы ([[полисахарид]]ы, [[липид]]ы) и [[нуклеиновая кислота|нуклеиновые кислоты]], белки — необходимые компоненты всех [[жизнь|живых]] [[организм]]ов, они участвуют в большинстве жизненных процессов [[клетка|клетки]]. Белки осуществляют [[обмен веществ]] и энергетические превращения. Белки входят в состав клеточных структур — [[органеллы|органелл]], секретируются во внеклеточное пространство для обмена сигналами между клетками, [[гидролиз]]а пищи и образования межклеточного вещества. {{нет АИ|16|01|2010}} |
||
Следует отметить, что классификация белков по их функции достаточно условна, потому что у эукариот один и тот же белок может выполнять несколько функций. Хорошо изученным примером такой многофункциональности служит лизил-тРНК-синтетаза — фермент из класса аминоацил-тРНК синтетаз, который не только присоединяет [[лизин]] к [[тРНК]], но и регулирует [[транскрипция (биология)|транскрипцию]] нескольких генов<ref>{{cite journal|url=http://www.molcells.org/home/journal/article_read.asp?volume=22&number=2&startpage=127|author= Yannay-Cohen N, Razin E.|year= 2000|title= Translation and transcription: the dual functionality of LysRS in mast cells. |journal=Mol Cells.|volume=22|pages=127–32|id=PMID 17085962 }}</ref>. |
Следует отметить, что классификация белков по их функции достаточно условна, потому что у эукариот один и тот же белок может выполнять несколько функций. Хорошо изученным примером такой многофункциональности служит лизил-тРНК-синтетаза — фермент из класса аминоацил-тРНК синтетаз, который не только присоединяет [[лизин]] к [[тРНК]], но и регулирует [[транскрипция (биология)|транскрипцию]] нескольких генов<ref>{{cite journal|url=http://www.molcells.org/home/journal/article_read.asp?volume=22&number=2&startpage=127|author= Yannay-Cohen N, Razin E.|year= 2000|title= Translation and transcription: the dual functionality of LysRS in mast cells. |journal=Mol Cells.|volume=22|pages=127–32|id=PMID 17085962 }}</ref>. |
||
Многие функции белки выполняют благодаря своей ферментативной активности. Так, ферментами являются двигательный белок [[миозин]], регуляторные белки [[протеинкиназы]], транспортный белок [[натрий-калиевая аденозинтрифосфатаза]] и др. |
Многие функции белки выполняют благодаря своей ферментативной активности. Так, ферментами являются двигательный белок [[миозин]], регуляторные белки [[протеинкиназы]], транспортный белок [[натрий-калиевая аденозинтрифосфатаза]] и др. {{нет АИ|16|01|2010}} |
||
[[Файл:Helicobacter Pylori Urease.png|right|thumb|200px|Молекулярная модель фермента [[уреаза|уреазы]] бактерии [[Helicobacter pylori]]]] |
[[Файл:Helicobacter Pylori Urease.png|right|thumb|200px|Молекулярная модель фермента [[уреаза|уреазы]] бактерии [[Helicobacter pylori]]]] |
||
| Строка 172: | Строка 172: | ||
{{main|Ферменты}} |
{{main|Ферменты}} |
||
Наиболее хорошо известная роль белков в организме — [[катализ]] различных химических реакций. [[Ферменты]] — группа белков, обладающая специфическими каталитическими свойствами, то есть каждый фермент катализирует одну или несколько сходных реакций. Ферменты катализируют реакции расщепления сложных молекул |
Наиболее хорошо известная роль белков в организме — [[катализ]] различных химических реакций. [[Ферменты]] — группа белков, обладающая специфическими каталитическими свойствами, то есть каждый фермент катализирует одну или несколько сходных реакций. Ферменты катализируют реакции расщепления сложных молекул |
||
([[катаболизм]]) и их синтеза ([[анаболизм]]), а также [[репликация (биология)|репликации]] и [[репарация|репарации]] ДНК и матричного синтеза РНК. Известно несколько тысяч ферментов; среди них такие, как, например [[пепсин]], расщепляют белки в процессе пищеварения. В процесс посттрансляционной модификации некоторые ферменты добавляют или удаляют химические группы на других белках. Известно около 4000 реакций, катализируемых белками<ref>{{cite journal|url=http://www.expasy.org/NAR/enz00.pdf|author= Bairoch A.|year= 2000|title= The ENZYME database in 2000 |journal=Nucleic Acids Res|volume=28|pages=304–305|id= PMID 10592255 }}</ref>. Ускорение реакции в результате ферментативного катализа иногда огромно: например, реакция, катализируемая ферментом оротат-карбоксилазой протекает в 10<sup>17</sup> быстрее некатализируемой (78 миллионов лет без фермента, 18 миллисекунд с участием фермента)<ref>{{cite journal |author=Radzicka A, Wolfenden R.|year= 1995|title= A proficient enzyme. |journal= Science |volume=6|issue=267|pages=90–931|id= PMID 7809611}}</ref>. Молекулы, которые присоединяются к ферменту и изменяются в результате реакции, называются [[субстрат (биохимия)|субстратами]]. |
([[катаболизм]]) и их синтеза ([[анаболизм]]), а также [[репликация (биология)|репликации]] и [[репарация|репарации]] ДНК и матричного синтеза РНК. Известно несколько тысяч ферментов; среди них такие, как, например [[пепсин]], расщепляют белки в процессе пищеварения. В процесс посттрансляционной модификации некоторые ферменты добавляют или удаляют химические группы на других белках. Известно около 4000 реакций, катализируемых белками<ref>{{cite journal|url=http://www.expasy.org/NAR/enz00.pdf|author= Bairoch A.|year= 2000|title= The ENZYME database in 2000 |journal=Nucleic Acids Res|volume=28|pages=304–305|id= PMID 10592255 }}</ref>. Ускорение реакции в результате ферментативного катализа иногда огромно: например, реакция, катализируемая ферментом оротат-карбоксилазой протекает в 10<sup>17</sup> быстрее некатализируемой (78 миллионов лет без фермента, 18 миллисекунд с участием фермента)<ref>{{cite journal |author=Radzicka A, Wolfenden R.|year= 1995|title= A proficient enzyme. |journal= Science |volume=6|issue=267|pages=90–931|id= PMID 7809611}}</ref>. Молекулы, которые присоединяются к ферменту и изменяются в результате реакции, называются [[субстрат (биохимия)|субстратами]].{{нет АИ|16|01|2010}} |
||
Хотя ферменты обычно состоят из сотен аминокислот, только небольшая часть из них взаимодействует с субстратом, и ещё меньшее количество — в среднем 3-4 аминокислоты, часто расположенные далеко друг от друга в первичной аминокислотной последовательности — напрямую участвуют в катализе<ref>[http://www.ebi.ac.uk/thornton-srv/databases/CSA/ The Catalytic Site Atlas at The European Bioinformatics Institute]</ref>. Часть фермента, которая присоединяет субстрат и содержит каталитические аминокислоты, называется [[Активный центр ферментов|активным центром фермента]]. |
Хотя ферменты обычно состоят из сотен аминокислот, только небольшая часть из них взаимодействует с субстратом, и ещё меньшее количество — в среднем 3-4 аминокислоты, часто расположенные далеко друг от друга в первичной аминокислотной последовательности — напрямую участвуют в катализе<ref>[http://www.ebi.ac.uk/thornton-srv/databases/CSA/ The Catalytic Site Atlas at The European Bioinformatics Institute]</ref>. Часть фермента, которая присоединяет субстрат и содержит каталитические аминокислоты, называется [[Активный центр ферментов|активным центром фермента]].{{нет АИ|16|01|2010}} |
||
=== Структурная функция === |
=== Структурная функция === |
||
{{main|Структурная функция белков|Фибриллярные белки}} |
{{main|Структурная функция белков|Фибриллярные белки}} |
||
Структурные белки [[цитоскелет]]а, как своего рода [[арматура]], придают форму клеткам и многим органоидам и участвуют в изменении формы клеток. Большинство структурных белков являются [[филаментозными белками]]: например, мономеры [[актин]]а и [[тубулин]]а — это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит [[цитоскелет]], позволяющий клетке поддерживать форму<ref>Erickson HP. Evolution of the cytoskeleton. Bioessays. 2007:668-77</ref>. [[Коллаген]] и [[эластин]] — основные компоненты межклеточного вещества [[соединительная ткань|соединительной ткани]] (например, [[хрящ]]а), а из другого структурного белка [[кератин]]а состоят [[волосы]], [[ногти]], [[перья]] птиц и некоторые [[Раковина|раковины]]. |
Структурные белки [[цитоскелет]]а, как своего рода [[арматура]], придают форму клеткам и многим органоидам и участвуют в изменении формы клеток. Большинство структурных белков являются [[филаментозными белками]]: например, мономеры [[актин]]а и [[тубулин]]а — это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит [[цитоскелет]], позволяющий клетке поддерживать форму<ref>Erickson HP. Evolution of the cytoskeleton. Bioessays. 2007:668-77</ref>. [[Коллаген]] и [[эластин]] — основные компоненты межклеточного вещества [[соединительная ткань|соединительной ткани]] (например, [[хрящ]]а), а из другого структурного белка [[кератин]]а состоят [[волосы]], [[ногти]], [[перья]] птиц и некоторые [[Раковина|раковины]].{{нет АИ|16|01|2010}} |
||
[[Файл:Mouse-cholera-antibody-1f4x.png|thumb|150px|[[Мышь|Мышиное]] антитело против [[холера|холеры]], присоединённое к [[углеводород]]ному антигену (вверху)]] |
[[Файл:Mouse-cholera-antibody-1f4x.png|thumb|150px|[[Мышь|Мышиное]] антитело против [[холера|холеры]], присоединённое к [[углеводород]]ному антигену (вверху)]] |
||
| Строка 191: | Строка 191: | ||
{{main|Активатор (белки)|Протеасома|Регуляторная функция белков}} |
{{main|Активатор (белки)|Протеасома|Регуляторная функция белков}} |
||
Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируют [[транскрипция|транскрипцию]], |
Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируют [[транскрипция|транскрипцию]], |
||
[[трансляция|трансляцию]], [[сплайсинг]], а также активность других белков и др. Регуляторную функцию белки осуществляют либо за счет ферментативной активности (например, [[протеинкиназы]]), либо за счет специфического связывания с другими молекулами, как правило, влияющего на взаимодействие с этими молекулами ферментов. |
[[трансляция|трансляцию]], [[сплайсинг]], а также активность других белков и др. Регуляторную функцию белки осуществляют либо за счет ферментативной активности (например, [[протеинкиназы]]), либо за счет специфического связывания с другими молекулами, как правило, влияющего на взаимодействие с этими молекулами ферментов.{{нет АИ|16|01|2010}} |
||
Так, [[транскрипция]] генов определяется присоединением [[факторы транскрипции|факторов транскрипции]] — [[Активатор (белки)|белков-активаторов]] и [[репресссоры|белков-репрессоров]] к регуляторным последовательностям генов. На уровне трансляции считывание многих мРНК также регулируется присоединением белковых факторов <ref>Hinnebusch AG. Translational regulation of GCN4 and the general amino acid control of yeast. Annu Rev Microbiol. 2005;59:407-50</ref>, а [[деградация]] РНК и белков также проводится специализированными белковыми комплексами <ref>Anderson P, Kedersha N., RNA granules. Cell Biol. 2006:172(6):803-8</ref>. Важнейшую роль в регуляции внутриклеточных процессов играют [[протеинкиназы]] — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп. |
Так, [[транскрипция]] генов определяется присоединением [[факторы транскрипции|факторов транскрипции]] — [[Активатор (белки)|белков-активаторов]] и [[репресссоры|белков-репрессоров]] к регуляторным последовательностям генов. На уровне трансляции считывание многих мРНК также регулируется присоединением белковых факторов <ref>Hinnebusch AG. Translational regulation of GCN4 and the general amino acid control of yeast. Annu Rev Microbiol. 2005;59:407-50</ref>, а [[деградация]] РНК и белков также проводится специализированными белковыми комплексами <ref>Anderson P, Kedersha N., RNA granules. Cell Biol. 2006:172(6):803-8</ref>. Важнейшую роль в регуляции внутриклеточных процессов играют [[протеинкиназы]] — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп.{{нет АИ|16|01|2010}} |
||
[[Файл:Myoglobin.png|thumb|200px|Структура [[миоглобин]]а с выделенными α спиралями. |
[[Файл:Myoglobin.png|thumb|200px|Структура [[миоглобин]]а с выделенными α спиралями.]] |
||
=== Сигнальная функция === |
=== Сигнальная функция === |
||
{{main|Сигнальная функция белка|Гормоны|Цитокины}} |
{{main|Сигнальная функция белка|Гормоны|Цитокины}} |
||
[[Сигнальная функция белков]] — способность белков служить сигнальными веществами, передавая сигналы между тканями, клетками или организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов. |
[[Сигнальная функция белков]] — способность белков служить сигнальными веществами, передавая сигналы между тканями, клетками или организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов. {{нет АИ|16|01|2010}} |
||
Сигнальную функцию выполняют белки-[[гормоны]], [[цитокины]], [[факторы роста]] и др. |
Сигнальную функцию выполняют белки-[[гормоны]], [[цитокины]], [[факторы роста]] и др.{{нет АИ|16|01|2010}} |
||
Гормоны переносятся кровью. Большинство гормонов животных - это белки или пептиды. Связывание гормона с рецептором является сигналом, запускающим в клетке ответную реакцию. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит [[инсулин]], который регулирует концентрацию [[глюкоза|глюкозы]] в [[кровь|крови]] |
Гормоны переносятся кровью. Большинство гормонов животных - это белки или пептиды. Связывание гормона с рецептором является сигналом, запускающим в клетке ответную реакцию. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит [[инсулин]], который регулирует концентрацию [[глюкоза|глюкозы]] в [[кровь|крови]] {{нет АИ|16|01|2010}} |
||
Клетки могут взаимодействуют друг с другом на небольшом расстоянии с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, [[цитокины]] и [[факторы роста]]. |
Клетки могут взаимодействуют друг с другом на небольшом расстоянии с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, [[цитокины]] и [[факторы роста]]. {{нет АИ|16|01|2010}} |
||
[[Цитокины]] — небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют их выживаемость, стимулируют или подавляют рост, дифференцировку, функциональную активность и [[апоптоз]], обеспечивают согласованность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить [[ФНО|фактор некроза опухолей]], который передаёт сигналы воспаления между клетками организма<ref>Повещенко АФ., Абрамов ВВ., Козлов ВВ. Цитокины — факторы нейроэндокринной регуляции. Успехи Физиологических Наук. 2007 — 38(3):40-6</ref>. |
[[Цитокины]] — небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют их выживаемость, стимулируют или подавляют рост, дифференцировку, функциональную активность и [[апоптоз]], обеспечивают согласованность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить [[ФНО|фактор некроза опухолей]], который передаёт сигналы воспаления между клетками организма<ref>Повещенко АФ., Абрамов ВВ., Козлов ВВ. Цитокины — факторы нейроэндокринной регуляции. Успехи Физиологических Наук. 2007 — 38(3):40-6</ref>. |
||
| Строка 216: | Строка 216: | ||
=== Запасная (резервная) функция белков === |
=== Запасная (резервная) функция белков === |
||
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек [[яйцо|яйца]] ([[овальбумин]]ы) и основной белок [[молоко|молока]] ([[казеин]]) также выполняют, главным образом, питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы [[метаболизм]]а. |
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек [[яйцо|яйца]] ([[овальбумин]]ы) и основной белок [[молоко|молока]] ([[казеин]]) также выполняют, главным образом, питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы [[метаболизм]]а.{{нет АИ|16|01|2010}} |
||
=== Рецепторная функция === |
=== Рецепторная функция === |
||
| Строка 227: | Строка 227: | ||
Целый класс [[Двигательный белок|моторных белков]] обеспечивает движения организма (например, сокращение мышц, в том числе локомоцию ([[миозин]]), перемещение клеток внутри организма (например, амебоидное движение [[лейкоцит]]ов), движение [[ресничка|ресничек]] и [[жгутик]]ов, а также активный и направленный внутриклеточный транспорт ([[кинезин]], [[динеин]]). Динеины и кинезины проводят транспортировку молекул (так называемого [[карго]]) вдоль [[микротрубочки|микротрубочек]] с использованием [[гидролиз]]а [[АТФ]] в качестве источника энергии. Динеины переносят карго из периферических частей клетки по направлению к [[центросома|центросоме]], кинезины в противоположном направлении <ref>Karp G. ''Cell and Molecular Biology: Concepts and Experiments'', Fourth ed, pp. 346—358. John Wiley and Sons, Hoboken, NJ. 2005. |
Целый класс [[Двигательный белок|моторных белков]] обеспечивает движения организма (например, сокращение мышц, в том числе локомоцию ([[миозин]]), перемещение клеток внутри организма (например, амебоидное движение [[лейкоцит]]ов), движение [[ресничка|ресничек]] и [[жгутик]]ов, а также активный и направленный внутриклеточный транспорт ([[кинезин]], [[динеин]]). Динеины и кинезины проводят транспортировку молекул (так называемого [[карго]]) вдоль [[микротрубочки|микротрубочек]] с использованием [[гидролиз]]а [[АТФ]] в качестве источника энергии. Динеины переносят карго из периферических частей клетки по направлению к [[центросома|центросоме]], кинезины в противоположном направлении <ref>Karp G. ''Cell and Molecular Biology: Concepts and Experiments'', Fourth ed, pp. 346—358. John Wiley and Sons, Hoboken, NJ. 2005. |
||
</ref><ref>Schroer, Trina A. Dynactin. ''Annual Review of Cell and Developmental Biology'' 2004 20, 759—779. PMID 15473859</ref>. Динеины также отвечают за движение ресничек и [[жгутик]]ов эукариот. Цитоплазматические варианты миозина могут перемещать карго вдоль микрофиламентов. |
</ref><ref>Schroer, Trina A. Dynactin. ''Annual Review of Cell and Developmental Biology'' 2004 20, 759—779. PMID 15473859</ref>. Динеины также отвечают за движение ресничек и [[жгутик]]ов эукариот. Цитоплазматические варианты миозина могут перемещать карго вдоль микрофиламентов.{{нет АИ|16|01|2010}} |
||
== Белки в обмене веществ == |
== Белки в обмене веществ == |
||
| Строка 233: | Строка 233: | ||
Большинство [[микроорганизм]]ов и растений могут синтезировать 20 стандартных [[аминокислоты|аминокислот]], а также дополнительные (нестандартные) аминокислоты, например, [[цитруллин]]. Но если аминокислоты есть в окружающей среде, даже микроорганизмы сохраняют энергию путём транспорта аминокислот внутрь клеток и выключения их биосинтетических путей<ref>Voet D, Voet JG. Biochemistry Vol 1 3rd ed., Hoboken, NJ.(2004).</ref>. |
Большинство [[микроорганизм]]ов и растений могут синтезировать 20 стандартных [[аминокислоты|аминокислот]], а также дополнительные (нестандартные) аминокислоты, например, [[цитруллин]]. Но если аминокислоты есть в окружающей среде, даже микроорганизмы сохраняют энергию путём транспорта аминокислот внутрь клеток и выключения их биосинтетических путей<ref>Voet D, Voet JG. Biochemistry Vol 1 3rd ed., Hoboken, NJ.(2004).</ref>. |
||
Аминокислоты, которые не могут быть синтезированы животными, называются незаменимыми. Основные ферменты в [[биосинтез|биосинтетических]] путях, например, [[аспартаткиназа]], которая катализирует первый этап в образовании [[лизин]]а, [[метионин]]а и [[треонин]]а из [[аспартат]]а, отсутствуют у животных. |
Аминокислоты, которые не могут быть синтезированы животными, называются незаменимыми. Основные ферменты в [[биосинтез|биосинтетических]] путях, например, [[аспартаткиназа]], которая катализирует первый этап в образовании [[лизин]]а, [[метионин]]а и [[треонин]]а из [[аспартат]]а, отсутствуют у животных.{{нет АИ|16|01|2010}} |
||
Животные, в основном, получают аминокислоты из белков, содержащихся в пище. Белки разрушаются в процессе [[пищеварение|пищеварения]], который обычно начинается с денатурации белка путём помещения его в [[кислота|кислотную среду]] и [[гидролиз]]а с помощью ферментов, называемых [[протеаза]]ми. Некоторые аминокислоты, полученные в результате пищеварения, используются для синтеза белков организма, а остальные превращаются в [[глюкоза|глюкозу]] в процессе [[глюконеогенез]]а или используются в [[цикл Кребса|цикле Кребса]]. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии<ref>{{cite journal |author=Brosnan J |title=Interorgan amino acid transport and its regulation |url=http://jn.nutrition.org/cgi/content/full/133/6/2068S |journal=J Nutr |volume=133 |issue=6 Suppl 1 |pages=2068S-72S |year=2003 |pmid=12771367}}</ref>. Аминокислоты также являются важным источником [[азот]]а в питании организма. |
Животные, в основном, получают аминокислоты из белков, содержащихся в пище. Белки разрушаются в процессе [[пищеварение|пищеварения]], который обычно начинается с денатурации белка путём помещения его в [[кислота|кислотную среду]] и [[гидролиз]]а с помощью ферментов, называемых [[протеаза]]ми. Некоторые аминокислоты, полученные в результате пищеварения, используются для синтеза белков организма, а остальные превращаются в [[глюкоза|глюкозу]] в процессе [[глюконеогенез]]а или используются в [[цикл Кребса|цикле Кребса]]. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии<ref>{{cite journal |author=Brosnan J |title=Interorgan amino acid transport and its regulation |url=http://jn.nutrition.org/cgi/content/full/133/6/2068S |journal=J Nutr |volume=133 |issue=6 Suppl 1 |pages=2068S-72S |year=2003 |pmid=12771367}}</ref>. Аминокислоты также являются важным источником [[азот]]а в питании организма.{{нет АИ|16|01|2010}} |
||
В мире не существует единых представлений о количественной характеристике норм потребления белков. [[Микрофлора]] толстого кишечника синтезирует аминокислоты, которые не учитываются при составлении белковых норм. |
В мире не существует единых представлений о количественной характеристике норм потребления белков. [[Микрофлора]] толстого кишечника синтезирует аминокислоты, которые не учитываются при составлении белковых норм.{{нет АИ|16|01|2010}} |
||
== Методы количественного определения белков == |
== Методы количественного определения белков == |
||
Для определения количества белка в образце используется ряд методик: |
Для определения количества белка в образце используется ряд методик:{{нет АИ|16|01|2010}} |
||
* [[Биуретовый метод]] |
* [[Биуретовый метод]] |
||
* [[Микробиуретовый метод]] |
* [[Микробиуретовый метод]] |
||
Версия от 00:26, 16 января 2010
Белки́ (протеи́ны, полипепти́ды[1]) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.[источник не указан 5306 дней]

Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.[источник не указан 5306 дней]
Белки — важная часть питания животных и человека, поскольку в их организме не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.[источник не указан 5306 дней]
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков принесло Фредерику Сенгеру Нобелевскую премию по химии в 1958 году. Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции рентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в 1958 году[2][3], за что в 1962 году они получили Нобелевскую премию по химии.[источник не указан 5306 дней]
История изучения

Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен из зерна пшеницы. Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. Термин «протеин» для обозначения подобных молекул был предложен в 1838 году сотрудником Мульдера Якобом Берцелиусом [4]. Мульдер также определил продукты разрушения белков — аминокислоты и для одной из них (лейцина) почти точно определил молекулярную массу — 131 дальтон. В 1836 Мулдер предложил первую модель химического строения белков. Основываясь на теории радикалов он сформулировал понятие о минимальной структурной единице состава белка, C16H24N4O5, которая была названа протеин (Pr), а теория — теорией протеина [5]. По мере накопления новых данных о белках теория неоднократно подвергалась критике, но до конца 1850-х оставалась общепризнанной.[источник не указан 5306 дней]
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков[6]. В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза[источник не указан 5306 дней]
Однако центральная роль белков в организмах не была признана до 1926 года, когда американский химик Джеймс Самнер (впоследствии — лауреат Нобелевской премии) показал, что фермент уреаза была белком[7].
Изучению белков препятствовала сложность их выделения. Поэтому первые исследования белков проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов и пищеварительных/метаболических ферментов, которые можно было выделить в местах забоя скота. В конце 1950-х годов компания Armour Hot Dog Co смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих учёных.[источник не указан 5306 дней]
Идея о том, что вторичная структура белков образуется в результате образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов были получены в 1960-х годах и с помощью ЯМР в 1980-х годах. В 2006 году Банк данных о белках (Protein Data Bank) содержал около 40 000 структур белков.[источник не указан 5306 дней]
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.[источник не указан 5306 дней]
Свойства

Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин (другие названия: тайтин, коннектин) — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3 000 до 3 700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius[8]).
Белки являются амфотерными полиэлектролитами (полиамфолитами), при этом группами, способными к ионизации в растворе, являются карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь -аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина). Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды рН, при которой молекулы данного белка не несут электрического заряда и, соответственно, не перемещаются в электрическом поле (например, при электрофорезе). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI.[источник не указан 5306 дней]
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 — основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для пепсина — протеолитического фермента сильнокислого желудочного сока pI ~ 1[9], а для сальмина — белка-протамина молок лосося, особенностью которого является чрезвычайно высокое содержание аргинина, pI ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины.[источник не указан 5306 дней]
По степени растворимости в воде белки бывают растворимыми и нерастворимыми. Большинство белков растворяются в воде. К нерастворимым относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т.п.) и фиброин, который входит в состав шёлка и паутины. Белки также делятся на гидрофильные и гидрофобные. К гидрофильным относятся большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относятся большинство белков, входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны [10] (у этих белков обычно есть и небольшие гидрофильные участки).[источник не указан 5306 дней]
Денатурация

Как правило, белки сохраняют структуру и, следовательно, физико-химические свойства, например, растворимость в условиях, таких как температура и рН, к которым приспособлен данный организм[7]. Резкое изменение этих условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной, третичной и вторичной структур белка, называемой денатурацией. Самый известный случай денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, как в случае осаждения (преципитации) водорастворимых белков с помощью солей аммония, и используется как способ их очистки[11].
Простые и сложные белки
Все белки разделяют на две большие группы — простые и сложные белки. Простые белки содержат только аминокислоты, сложные белки имеют также неаминокислотные группы. Эти дополнительные группы в составе сложных белков называются «простетическими группами». Примерами простетических групп в составе белков служат гем (в составе гемоглобина), витамины тиамин и биотин. Неорганические простетические группы состоят из ионов металлов — цинка, магния и молибдена [12] .
Структура белка
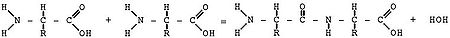
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.[источник не указан 5306 дней]
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются пептидные связи. Концы белка называют С- и N- концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.[источник не указан 5306 дней]
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде последовательности нуклеотидов, причём одной аминокислоте соответствует в ДНК последовательность из трёх нуклеотидов — так называемый триплет или кодон. То, какая аминокислота соответствует данному кодону в мРНК, определяется генетическим кодом, который может несколько отличаться у разных организмов. Так как аминокислоты синтезируются на рибосомах из 20-ти аминокислот, а триплетов, которыми они закодированы в ДНК, у разных организмов от 61 до 63, то большинство аминокислот может быть закодировано разными триплетами (генетический код вырожденный, или избыточный). [источник не указан 5306 дней]

Гомологичные белки (предположительно имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, гемоглобины разных организмов, имеют во многих местах цепи идентичные, консервативные остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые вариабельными. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.[источник не указан 5306 дней]

Уровни структуры белка
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура белка, которая формируется в процессе фолдинга (от англ. folding), «сворачивание»). Трёхмерная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка[13]:
- Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, важных для функции белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
- Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями. Ниже приведены некоторые распространённые типы вторичной структуры белков:
- α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0.54 нм[14] (так что на один аминокислотный остаток приходится 0.15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0.347 нм на аминокислотный остаток[14]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.
- π-спирали;
- -спирали;
- неупорядоченные фрагменты.

- Третичная структура — пространственное строение полипептидной цепи; взаимное расположение элементов вторичной структуры, стабилизированное различными типами взаимодействий. В стабилизации третичной структуры принимают участие:
- ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
- ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
- водородные связи;
- гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула "стремится" свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы. [источник не указан 5306 дней]
Белки разделяют на группы согласно их трёхмерной структуре. Большинство белков относятся к глобулярным: общая форма из молекулы более или менее сферическая. Меньшая часть белков относится к фибриллярным: их молекулы (обычно и надмолекулярные комплексы) в работающем состоянии представляют собой сильно вытянутые волокна. К фибриллярным белкам относятся, например, кератин и коллаген. Среди глобулярных и фибриллярных белков выделяют подгруппы. Например, изображённый на картинке справа глобулярный белок, триозофосфатизомераза, состоит из восьми α-спиралей, расположенных на внешней поверхности структуры и восьми параллельных β-слоёв внутри структуры. Белки с подобным трёхмерным строением называются αβ-баррелы (от англ. barrel — бочка) [1].
- Четверичная структура
- — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру (можно считать её и молекулой, если между разными полипептидными цепями, как это нередко бывает, образуются дисульфидные мостики). В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. [источник не указан 5306 дней]
Надмолекулярные белковые комплексы могут состоять из десятков молекул, многие из них сравнимы по размеру с рибосомами и в последние годы часто описываются как органоиды (см., напр., протеасома). Нередко в их состав входят молекулы РНК (см., напр., сплайсосома). [источник не указан 5306 дней]
Также выделяют:[источник не указан 5306 дней]
- Трёхмерную структуру белка — набор пространственных координат составляющих белок атомов.
- Субъединичную (доменную) структуру белка — последовательность участков белка, имеющих известную функцию или определённую трёхмерную структуру.
- Гидрофобное ядро, обеспечивающее сворачивание белка.

Образование и поддержание структуры белков в живых организмах
Способность белков восстанавливать правильную трёхмерную структуру после денатурации позволила выдвинуть гипотезу о том, что вся информация о конечной структуре белка содержится в его аминокислотной последовательности. В настоящее время общепризнана теория о том, что в результате эволюции стабильная конформация белка обладает минимальной свободной энергией по сравнению с другими возможными конформациями этого полипептида [15].
Тем не менее, в клетках существует группа белков, функция которых — обеспечение восстановления структуры белков после повреждения, а также создание и диссоциация белковых комплексов. Эти белки называются шаперонами. Концентрация многих шаперонов в клетке возрастает при резком повышении температуры окружающей среды, поэтому они относятся к группе Hsp (англ. heat shock proteins — белки теплового шока)[16]. Важность нормальной работы шаперонов для функционирования организма может быть проиллюстрирована на примере шаперона α-кристаллина, входящего в состав хрусталика глаза человека. Мутации в этом белке приводят к помутнению хрусталика из-за аггрегирования белков и, как результат, к катаракте [17].
Синтез белков
Химический синтез
Короткие белки могут быть синтезированы химическим путём с помощью группы методов, которые используют органический синтез — например, химическое лигирование[18]. Большинство методов химического синтеза проходят в направлении от С-конца к N-концу, в противоположность биосинтезу. Таким образом можно синтезировать короткий иммунногенный пептид (эпитоп), служащий для получения антител путём инъекции в животных, или получения гибридо́м; химический синтез также используется для получения ингибиторов некоторых ферментов [19]. Химический синтез позволяет вводить искусственные, то есть не встречающиеся в обычных белках аминокислоты — например, присоединять флюоресцентные метки к боковым цепям аминокислот. Однако химические методы синтеза неэффективны при длине белков более 300 аминокислот; кроме того, искусственные белки могут иметь неправильную третичную структуру, и у аминокислот искусственных белков отсутствуют посттрансляционные модификации.[источник не указан 5306 дней]
Биосинтез белков
Универсальный способ: рибосомный синтез
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах. Каждый белок состоит из уникальной последовательности аминокислот, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. Генетический код составляется из трёхбуквенных «слов», называемых кодонами; каждый кодон отвечает за присоединение к белку одной аминокислоты: например, сочетание АУГ соответствует метионину. Поскольку ДНК состоит из четырёх типов нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более, чем одним кодоном. Гены, кодирующие белки сначала транскрибируются в последовательность нуклеотидов матричной РНК (мРНК) белками РНК-полимеразами.[источник не указан 5306 дней]
У прокариот мРНК может считываться рибосомами в аминокислотную последовательность белков сразу после транскрипции, а у эукариот она транспортируется из ядра в цитоплазму, где находятся рибосомы. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду [20].
Процесс синтеза белка с мРНК называется трансляцией. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена метиониновая транспортная РНК (тРНК). После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции — элонгация. При каждом движении рибосомы от 5' к 3' концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами (кодоном) мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомальной РНК рРНК, образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК (рРНК) катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положении, благоприятном для прохождения реакции. Ферменты аминоацил-тРНК-синтетазы присоединяют аминокислоты к их тРНК. Третья, и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C- концу.[источник не указан 5306 дней]
Нерибосомный синтез
У низших грибов и некоторых бактерий существует менее распространённый способ биосинтеза белков, который не требует участия рибосом. Синтез пептидов, обычно вторичных метаболитов, проводится высокомолекулярным белковым комплексом, так называемой НРС-синтазой. НРС-синтаза обычно состоит из нескольких доменов или отдельных белков, осуществляющих селекцию аминокислот, образование пептидной связи, высвобождение синтезированного пептида и, иногда, домен, способный изомеризовать L-аминокислоты (нормальная форма) в D-форму.[21][22]
Внутриклеточный транспорт и сортировка белков
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные компартменты клетки — ядро, митохондрии, ЭПР, аппарат Гольджи, лизосомы и др., а некоторые белки должны попасть во внеклеточную среду. Для попадания в определенный компартмент белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или сигнальная последовательность белка). В некоторых случаях меткой служат посттрансляционно присоединенные к белку олигосахариды. Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путем везикулярного транспорта. В ядро белки, обладающие сигнальной последовательностью для ядра, попадают через ядерные поры. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шаперонов.[источник не указан 5306 дней]
Посттрансляционная модификация белков
После завершения трансляции и высвобождения белка из рибосомы аминокислоты в составе полипептидной цепи подвергаются разнообразным химическим модификациям. Примерами посттрансляционной модификации являются:[источник не указан 5306 дней]
- присоединение различных функциональных групп (ацетил-, метил- и фосфатных групп);
- присоединение липидов и углеводородов;
- изменение стандартных аминокислот на нестандартные (образование цитруллина);
- образование структурных изменений (образование дисульфидных мостиков между цистеинами);
- удаление части белка как в начале (сигнальная последовательность), так и в отдельных случаях в середине (инсулин);
- добавление небольших белков, которые влияют на деградацию белков (сумоилирование и убиквитинирование).
При этом тип модификации может быть как универсальным (добавление цепей, состоящих из мономеров убиквитина, служит сигналом для деградации этого белка протеосомой), так и специфическим для данного белка [23]. В то же время один и тот же белок может подвергаться многочисленным модификациям. Так, гистоны (белки, входящие в состав хроматина у эукариот) в разных условиях могут подвергаться до 150 различных модификаций [24].
Функции белков в организме
Так же как и другие биологические макромолекулы (полисахариды, липиды) и нуклеиновые кислоты, белки — необходимые компоненты всех живых организмов, они участвуют в большинстве жизненных процессов клетки. Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур — органелл, секретируются во внеклеточное пространство для обмена сигналами между клетками, гидролиза пищи и образования межклеточного вещества. [источник не указан 5306 дней]
Следует отметить, что классификация белков по их функции достаточно условна, потому что у эукариот один и тот же белок может выполнять несколько функций. Хорошо изученным примером такой многофункциональности служит лизил-тРНК-синтетаза — фермент из класса аминоацил-тРНК синтетаз, который не только присоединяет лизин к тРНК, но и регулирует транскрипцию нескольких генов[25]. Многие функции белки выполняют благодаря своей ферментативной активности. Так, ферментами являются двигательный белок миозин, регуляторные белки протеинкиназы, транспортный белок натрий-калиевая аденозинтрифосфатаза и др. [источник не указан 5306 дней]

Каталитическая функция
Наиболее хорошо известная роль белков в организме — катализ различных химических реакций. Ферменты — группа белков, обладающая специфическими каталитическими свойствами, то есть каждый фермент катализирует одну или несколько сходных реакций. Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации и репарации ДНК и матричного синтеза РНК. Известно несколько тысяч ферментов; среди них такие, как, например пепсин, расщепляют белки в процессе пищеварения. В процесс посттрансляционной модификации некоторые ферменты добавляют или удаляют химические группы на других белках. Известно около 4000 реакций, катализируемых белками[26]. Ускорение реакции в результате ферментативного катализа иногда огромно: например, реакция, катализируемая ферментом оротат-карбоксилазой протекает в 1017 быстрее некатализируемой (78 миллионов лет без фермента, 18 миллисекунд с участием фермента)[27]. Молекулы, которые присоединяются к ферменту и изменяются в результате реакции, называются субстратами.[источник не указан 5306 дней]
Хотя ферменты обычно состоят из сотен аминокислот, только небольшая часть из них взаимодействует с субстратом, и ещё меньшее количество — в среднем 3-4 аминокислоты, часто расположенные далеко друг от друга в первичной аминокислотной последовательности — напрямую участвуют в катализе[28]. Часть фермента, которая присоединяет субстрат и содержит каталитические аминокислоты, называется активным центром фермента.[источник не указан 5306 дней]
Структурная функция
Структурные белки цитоскелета, как своего рода арматура, придают форму клеткам и многим органоидам и участвуют в изменении формы клеток. Большинство структурных белков являются филаментозными белками: например, мономеры актина и тубулина — это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит цитоскелет, позволяющий клетке поддерживать форму[29]. Коллаген и эластин — основные компоненты межклеточного вещества соединительной ткани (например, хряща), а из другого структурного белка кератина состоят волосы, ногти, перья птиц и некоторые раковины.[источник не указан 5306 дней]

Защитная функция
Существуют несколько видов защитных функций белков:
- Физическая защита. В ней принимает участие коллаген — белок, образующий основу межклеточного вещества соединительных тканей (в том числе костей, хряща, сухожилий и глубоких слоев кожи )дермы); кератин, составляющий основу роговых щитков, волос, перьев, рогов и др. производных эпидермиса. Обычно такие белки рассматривают как белки со структурной функцией. Примерами этой группы белков служат фибриногены и тромбины[30], участвующие в свёртывании крови.
- Химическая защита. Связывание токсинов белковыми молекулами может обеспечивать их детоксикацию. Особенно важную роль в детоксикации у человека играют ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма[31].
- Иммунная защита. Белки, входящие в состав крови и других биологических жидкостей, участвуют в защитном ответе организма как на повреждение, так и на атаку патогенов. Белки системы комплемента и антитела (иммуноглобулины) относятся к белкам второй группы; они нейтрализуют бактерии, вирусы или чужеродные белки. Антитела, входящие в состав адаптативной иммунной системы, присоединяются к чужеродным для данного организма веществам, антигенам, и тем самым нейтрализуют их, направляя к местам уничтожения. Антитела могут секретироваться в межклеточное пространство или закрепляться в мембранах специализированных В-лимфоцитов, которые называются плазмоцитами[32]. В то время как ферменты имеют ограниченное сродство к субстрату, поскольку слишком сильное присоединение к субстрату может мешать протеканию катализируемой реакции, стойкость присоединения антител к антигену ничем не ограничена [33].
Регуляторная функция
Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируют транскрипцию, трансляцию, сплайсинг, а также активность других белков и др. Регуляторную функцию белки осуществляют либо за счет ферментативной активности (например, протеинкиназы), либо за счет специфического связывания с другими молекулами, как правило, влияющего на взаимодействие с этими молекулами ферментов.[источник не указан 5306 дней]
Так, транскрипция генов определяется присоединением факторов транскрипции — белков-активаторов и белков-репрессоров к регуляторным последовательностям генов. На уровне трансляции считывание многих мРНК также регулируется присоединением белковых факторов [34], а деградация РНК и белков также проводится специализированными белковыми комплексами [35]. Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп.[источник не указан 5306 дней]

Сигнальная функция
Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между тканями, клетками или организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов. [источник не указан 5306 дней]
Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.[источник не указан 5306 дней]
Гормоны переносятся кровью. Большинство гормонов животных - это белки или пептиды. Связывание гормона с рецептором является сигналом, запускающим в клетке ответную реакцию. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит инсулин, который регулирует концентрацию глюкозы в крови [источник не указан 5306 дней]
Клетки могут взаимодействуют друг с другом на небольшом расстоянии с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, цитокины и факторы роста. [источник не указан 5306 дней]
Цитокины — небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют их выживаемость, стимулируют или подавляют рост, дифференцировку, функциональную активность и апоптоз, обеспечивают согласованность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухолей, который передаёт сигналы воспаления между клетками организма[36].
Транспортная функция
Растворимые белки, участвующие в транспорте малых молекул, должны иметь высокое сродство (афинность) к субстрату, когда он присутствует в высокой концентрации, и легко его высвобождать в местах низкой концентрации субстрата. Примером транспортных белков можно назвать гемоглобин, который переносит кислород из лёгких к остальным тканям и углекислый газ от тканей к лёгким, а также гомологичные ему белки, найденные во всех царствах живых организмов [37].
Некоторые мембранные белки участвуют в транспорте малых молекул через мембрану клетки, изменяя её проницаемость. Липидный компонент мембраны водонепроницаем (гидрофобен), что предотвращает диффузию полярных или заряженных (ионы) молекул. Мембранные транспортные белки принято подразделять на белки-каналы и белки-переносчики. Белки-каналы содержат внутренние заполненные водой поры, которые позволяют ионам (через ионные каналы) или молекулам воды (через белки-аквапорины) перемещаться внутрь или наружу. Многие ионные каналы специализируются на транспорте только одного иона; так, калиевые и натриевые каналы часто различают эти сходные ионы и пропускают только один из них [38]. Белки-переносчики связывают, подобно ферментам, каждую переносимую молекулу или ион и, в отличие от каналов, могут осуществлять активный транспорт с использованием энергии АТФ. «Электростанция клетки» — АТФ-синтаза, которая осуществляет синтез АТФ за счёт протонного градиента, также может быть отнесена к мембранным транспортным белкам [39].
Запасная (резервная) функция белков
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.[источник не указан 5306 дней]
Рецепторная функция
Белковые рецепторы могут как находиться в цитоплазме, так и встраиваться в клеточную мембрану. Одна часть молекулы рецептора воспринимает сигнал, которым чаще всего служит химическое вещество, а в некоторых случаях — свет, механическое воздействие (например, растяжение) и другие стимулы. При воздействии сигнала на определенный участок молекулы белок-рецептор происходят её конформационные изменения. В результате меняется конформация другой части молекулы, осуществляющей передачу сигнала на другие клеточные компоненты. Существует несколько механизмов передачи сигнала. Некоторые рецепторы катализируют определенную химическую реакцию; другие служат ионными каналами, которые при действии сигнала открываются или закрываются; третьи специфически связывают внутриклеточные молекулы-посредники. У мембранных рецепторов часть молекулы, связывающаяся с сигнальной молекулой, находится на поверхности клетки, а домен, передающий сигнал, внутри [40].
Моторная (двигательная) функция
Целый класс моторных белков обеспечивает движения организма (например, сокращение мышц, в том числе локомоцию (миозин), перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), движение ресничек и жгутиков, а также активный и направленный внутриклеточный транспорт (кинезин, динеин). Динеины и кинезины проводят транспортировку молекул (так называемого карго) вдоль микротрубочек с использованием гидролиза АТФ в качестве источника энергии. Динеины переносят карго из периферических частей клетки по направлению к центросоме, кинезины в противоположном направлении [41][42]. Динеины также отвечают за движение ресничек и жгутиков эукариот. Цитоплазматические варианты миозина могут перемещать карго вдоль микрофиламентов.[источник не указан 5306 дней]
Белки в обмене веществ
Большинство микроорганизмов и растений могут синтезировать 20 стандартных аминокислот, а также дополнительные (нестандартные) аминокислоты, например, цитруллин. Но если аминокислоты есть в окружающей среде, даже микроорганизмы сохраняют энергию путём транспорта аминокислот внутрь клеток и выключения их биосинтетических путей[43].
Аминокислоты, которые не могут быть синтезированы животными, называются незаменимыми. Основные ферменты в биосинтетических путях, например, аспартаткиназа, которая катализирует первый этап в образовании лизина, метионина и треонина из аспартата, отсутствуют у животных.[источник не указан 5306 дней]
Животные, в основном, получают аминокислоты из белков, содержащихся в пище. Белки разрушаются в процессе пищеварения, который обычно начинается с денатурации белка путём помещения его в кислотную среду и гидролиза с помощью ферментов, называемых протеазами. Некоторые аминокислоты, полученные в результате пищеварения, используются для синтеза белков организма, а остальные превращаются в глюкозу в процессе глюконеогенеза или используются в цикле Кребса. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии[44]. Аминокислоты также являются важным источником азота в питании организма.[источник не указан 5306 дней]
В мире не существует единых представлений о количественной характеристике норм потребления белков. Микрофлора толстого кишечника синтезирует аминокислоты, которые не учитываются при составлении белковых норм.[источник не указан 5306 дней]
Методы количественного определения белков
Для определения количества белка в образце используется ряд методик:[источник не указан 5306 дней]
Примечания
- ↑ С химической точки зрения все белки являются политептидами. Однако короткие, меньше 30 аминокислот в длину полипептиды, особенно химически синтезированные, нельзя назвать белками.
- ↑ Muirhead H., Perutz M. Структура гемоглобина. = Structure of hemoglobin. A three-dimensional fourier synthesis of reduced human hemoglobin at 5.5 A resolution. // Nature : журнал. — 1963. — Т. 199, № 4894. — С. 633—638.
- ↑ Kendrew J., Bodo G., Dintzis H., Parrish R., Wyckoff H., Phillips D. Трёхмерная модель молекулы миоглобина, полученная по результатам рентгеновских исследований. = A three-dimensional model of the myoglobin molecule obtained by x-ray analysis. // Nature : журнал. — 1958. — Т. 181, № 4610. — С. 662—666.
- ↑ Leicester, Henry . «Berzelius, Jöns Jacob». Dictionary of Scientific Biography 2. New York: Charles Scribner’s Sons. 90-97 (1980). ISBN 0-684-10114-9
- ↑ Ю.А. Овчинникова. Биоорганическая химия. — Просвещение, 1987.
- ↑ Белки // Химическая энциклопедия. — Советская энциклопедия, 1988.
- ↑ 1 2 N. H. Barton, D. E. G. Briggs, J. A. Eisen «Evolution», Cold Spring Harbor Laboratory Press, 2007 — P. 38. ISBN 978-0-87969-684-9
- ↑ Fulton A, Isaacs W (1991). "Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis". Bioessays. 13 (4): 157—61. PMID 1859393.
- ↑ http://www.brenda-enzymes.info/php/result_flat.php4?ecno=3.4.23.1
- ↑ S J Singer. The Structure and Insertion of Integral Proteins in Membranes. Annual Review of Cell Biology. Volume 6, Page 247—296. 1990
- ↑ Страер Л., Биохимия в 3 томах. — М.: Мир, 1984
- ↑ de Bolster, M.W.G. Glossary of Terms Used in Bioinorganic Chemistry: Prosthetic groups. International Union of Pure and Applied Chemistry (1997). Дата обращения: 30 октября 2007.
- ↑ Ленинджер А. Основы биохимии, в 3 томах. — М.: «Мир», 1985.
- ↑ 1 2 Лекция 2. Структурные уровни белков и нуклеиновых кислот ("Основы биологии", Макеев Александр Владиславович, 1996 и 1997)
- ↑ Anfinsen C. (1973). "Principles that Govern the Folding of Protein Chains". Science. 181: 223—229.
{{cite journal}}: Игнорируется текст: "Нобелевская лекция. Автор, совместно с Стэнфордом Муром и Уиллиамом Стейном, получил Нобелевскую Премию по химии за "изучение рибонуклеазы, в особенности взаимоотношений между аминокислотной последовательностью [фермента] и [его] биологически активной конформацией" (справка) - ↑ Ellis RJ, van der Vies SM (1991). "Molecular chaperones". Annu. Rev. Biochem. 60: 321—47. doi:10.1146/annurev.bi.60.070191.001541. PMID 1679318.
- ↑ Sun Y, MacRae TH. (2005). "The small heat shock proteins and their role in human disease". FEBS J. 60: 2613—27. PMID 115943797.
{{cite journal}}: Проверьте значение|pmid=(справка) - ↑ Wilken J, Kent SB.. Curr Opin Biotechnol. Chemical protein synthesis. 1998.9(4):412-26
- ↑ Dawson PE, Kent SB. Synthesis of native proteins by chemical ligation. Annu Rev Biochem. 2000;69:923-60
- ↑ Dobson CM. (2000). The nature and significance of protein folding. In Mechanisms of Protein Folding 2nd ed. Ed. RH Pain. Frontiers in Molecular Biology series. Oxford University Press: New York, NY.
- ↑ Stack D, Neville C, Doyle S. Nonribosomal peptide synthesis in Aspergillus fumigatus and other fungi. Microbiology. 2007 May;153(Pt 5):1297-306
- ↑ Welker M, von Döhren H. Cyanobacterial peptides — nature’s own combinatorial biosynthesis. FEMS Microbiol Rev. 2006 Jul;30(4):530-63
- ↑ Demartino GN, Gillette TG. Proteasomes: machines for all reasons. Cell. 2007 May 18;129(4):659-62
- ↑ Bronner C, Chataigneau T, Schini-Kerth VB, Landry Y.The «Epigenetic Code Replication Machinery», ECREM: a promising drugable target of the epigenetic cell memory. Curr Med Chem. 2007;14(25):2629-41
- ↑ Yannay-Cohen N, Razin E. (2000). "Translation and transcription: the dual functionality of LysRS in mast cells". Mol Cells. 22: 127—32. PMID 17085962.
- ↑ Bairoch A. (2000). "The ENZYME database in 2000" (PDF). Nucleic Acids Res. 28: 304—305. PMID 10592255.
- ↑ Radzicka A, Wolfenden R. (1995). "A proficient enzyme". Science. 6 (267): 90—931. PMID 7809611.
- ↑ The Catalytic Site Atlas at The European Bioinformatics Institute
- ↑ Erickson HP. Evolution of the cytoskeleton. Bioessays. 2007:668-77
- ↑ Wolberg AS (2007). «Thrombin generation and fibrin clot structure.». Blood Rev. 21 (3): 131-42.PMID 17208341.
- ↑ Я. Кольман, К.- Г. Рем. Наглядная биохимия. М., Мир, 2000, с.308-309
- ↑ ^ J. Li, D.R. Barreda, Y.-A. Zhang, H. Boshra, A.E. Gelman, S. LaPatra, L. Tort & J.O. Sunyer (2006). «B lymphocytes from early vertebrates have potent phagocytic and microbicidal abilities». Nature Immunology 7: 1116—1124. PMID 16980980.
- ↑ Felix NJ, Allen PM. Specificity of T-cell alloreactivity. Rev Immunol. 2007 Dec;7(12):942-53
- ↑ Hinnebusch AG. Translational regulation of GCN4 and the general amino acid control of yeast. Annu Rev Microbiol. 2005;59:407-50
- ↑ Anderson P, Kedersha N., RNA granules. Cell Biol. 2006:172(6):803-8
- ↑ Повещенко АФ., Абрамов ВВ., Козлов ВВ. Цитокины — факторы нейроэндокринной регуляции. Успехи Физиологических Наук. 2007 — 38(3):40-6
- ↑ Wittenberg JB. On optima: the case of myoglobin-facilitated oxygen diffusion Gene. 2007 Aug 15;398(1-2):156-61.
- ↑ Driessen AJ, Nouwen N. Protein Translocation Across the Bacterial Cytoplasmic Membrane.Annu Rev Biochem. 2007 Dec 13 [Epub ahead of print]
- ↑ Drory O, Nelson N. (2006). "The emerging structure of vacuolar ATPases". Physiology (Bethesda). 21: 317—25. PMID 16990452.
- ↑ Dupré DJ, Hébert TE. Biosynthesis and trafficking of seven transmembrane receptor signalling complexes.Cell Signal. 2006.(10):1549-59
- ↑ Karp G. Cell and Molecular Biology: Concepts and Experiments, Fourth ed, pp. 346—358. John Wiley and Sons, Hoboken, NJ. 2005.
- ↑ Schroer, Trina A. Dynactin. Annual Review of Cell and Developmental Biology 2004 20, 759—779. PMID 15473859
- ↑ Voet D, Voet JG. Biochemistry Vol 1 3rd ed., Hoboken, NJ.(2004).
- ↑ Brosnan J (2003). "Interorgan amino acid transport and its regulation". J Nutr. 133 (6 Suppl 1): 2068S–72S. PMID 12771367.
См. также
- Аминокислота
- Незаменимые аминокислоты
- Нестандартные аминокислоты
- Пептидная связь
- Пептиды
- Прионы
- Протеомика
- Сплайсинг белков
- Folding@home — проект распределённых вычислений для проведения компьютерной симуляции свёртывания молекул белка
Литература
- Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки. В 3 томах. — М.: Мир, 1994. — ISBN 5-03-001986-3.
- Ленинджер А. Основы биохимии. В 3 томах. — М.: Мир, 1985.
- Страйер Л. Биохимия. В 3 томах. — М.: Мир, 1984.
Ссылки
- Свойства аминокислот и белков
- PDB — Protein Data Bank
- Обзоры статей о фолдинге белков на русском
- Хаос и порядок дискретных систем в свете синергетической теории информации (В статье проводится количественный анализ первичной структуры белков со стороны соотношения хаоса и порядка)
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |

