Ацетон
| Ацетон | |||
|---|---|---|---|
 | |||
 | |||
| Общие | |||
| Систематическое наименование |
Пропа́н-2-о́н | ||
| Традиционные названия | Ацето́н, диметилкетон | ||
| Хим. формула | C3H6O | ||
| Рац. формула | CH3—C(O)—CH3 | ||
| Физические свойства | |||
| Состояние | Жидкость | ||
| Молярная масса | 58,08 г/моль | ||
| Плотность | 0,7899 г/см³ | ||
| Поверхностное натяжение | 23,7×10-3 Н/м | ||
| Динамическая вязкость |
0,36 мПа·с (10 °C) 0,295 мПа·с (25 °C) 0,28 мПа·с (41 °C) |
||
| Энергия ионизации | 9,69 эВ и 9,71 эВ[4] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −95 °C | ||
| • кипения | 56,1 °C | ||
| • вспышки | −20 [1] °C | ||
| • самовоспламенения | 465 [2][3] °C | ||
| Пределы взрываемости | 2,5 об.% | ||
| Критическая точка | 235,5°C; 4.7МПа | ||
| Критическая плотность | 0,273 г/см3 см³/моль | ||
| Мол. теплоёмк. | 125 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования |
(ж) −247,7 кДж/моль (г) −216,5 кДж/моль |
||
| • сгорания | 1829,4 кДж/моль | ||
| • плавления | 5,69 кДж/моль | ||
| • кипения | 29,1 кДж/моль | ||
| Давление пара | 23 998 Па | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 19,16 ± 0,04[5] | ||
| Диэлектрическая проницаемость | 20,9 | ||
| Оптические свойства | |||
| Показатель преломления | 1,3588 (25 °C) 1,3591 (20 °C) | ||
| Структура | |||
| Дипольный момент | 2,84 Д | ||
| Классификация | |||
| Рег. номер CAS | 67-64-1 | ||
| PubChem | 180 | ||
| Рег. номер EINECS | 200-662-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | AL3150000 | ||
| ChEBI | 15347 | ||
| Номер ООН | 1090 | ||
| ChemSpider | 175 | ||
| Безопасность | |||
| ЛД50 | 1159 мг/кг | ||
| Краткие характер. опасности (H) |
H225, H319, H336, EUH066 |
||
| Меры предостор. (P) |
P210, P240, P305+P351+P338, P403+P233 |
||
| Сигнальное слово | опасно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Ацето́н (пропано́н, димети́лкето́н, пропано́н-2, химическая формула — C3H6O или CH3-C(=O)-CH3)[1] — органическое вещество, относящееся к классу насыщенных кетонов[6].
Бесцветная летучая жидкость с характерным запахом. Неограниченно смешивается с водой и полярными органическими растворителями, ограниченно смешивается с неполярными растворителями.
Ценный промышленный растворитель. Благодаря низкой токсичности широко применяется в производстве лаков, взрывчатых веществ, лекарственных средств. Исходное соединение в многочисленных химических синтезах. В лабораторной практике ацетон применяют в качестве полярного апротонного растворителя, для приготовления охлаждающих смесей вместе с сухим льдом и аммиаком, а также для мытья химической посуды.
Ацетон является одним из продуктов метаболизма в живых организмах, в частности, в организме человека. Один из компонентов так называемых кетоновых тел, которых в крови здорового человека содержится крайне мало, однако при патологических состояниях (длительное голодание, тяжелая физическая нагрузка, тяжелая форма сахарного диабета) их концентрация может значительно повышаться и достигать 20 ммоль/л.
Происхождение названия
[править | править код]Своё название ацетон получил от лат. acetum — «уксус». Это связано с тем, что ранее ацетон получали из ацетатов, а из самого ацетона получали синтетическую ледяную уксусную кислоту. В 1848 году немецкий профессор медицины и химии Леопольд Гмелин ввёл термин в официальное употребление[7][8], использовав старое немецкое слово Aketon (кетон, ацетон), которое также берёт корни от латинского «acetum».
Открытие
[править | править код]
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины, однако повышенный спрос на него в годы Первой мировой войны (для производства хлорацетона — эффективного слезоточивого вещества) очень быстро стимулировал создание новых методов производства.
Получение
[править | править код]Мировое производство ацетона составляет более 6,9 миллионов тонн в год (по данным на 2012 г[9].) и устойчиво растёт[9]. В промышленности ацетон получают напрямую или косвенно из пропена.
Старые методы
[править | править код]Старейший метод промышленного производства ацетона заключался в сухой перегонке ацетата кальция, который образуется при нейтрализации известью древесного уксуса, образующегося при коксовании древесины.[10]
- .
Сейчас этот метод уже не применяется, так как ацетон в этом случае содержит слишком много примесей.
Известны также способы получения ацетона ацетоно-бутиловым брожением углеводов (крахмала, сахаров, меласса), вызываемым бактериями — клостридиями, в частности Clostridium acetobutylicum; в ходе брожения образуются ацетон и бутиловый или этиловый спирты[11][12][13]. Ацетон и бутиловый спирт получают в мольном соотношении от 2:1 до 3:1. Метод характеризуется малыми выходами.
- .
В Германии в 1916 г. был запатентован процесс производства ацетона на основе уксусной кислоты. При 400 °C через контакты из церия пропускали уксусную кислоту:
- .
Ацетон также производили из ацетилена прямым синтезом:
- .
Ацетилен вступает во взаимодействие с водяным паром при 450 °C в присутствии катализаторов.
Кумольный способ
[править | править код]Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Процесс протекает в 3 стадии.[14]
На первой стадии бензол алкилируют пропеном с получением изопропилбензола (кумола), на второй и третьей (реакция Удриса — Сергеева) полученный кумол окисляют кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
Из изопропанола
[править | править код]По данному методу изопропанол окисляют в паровой фазе при температурах 450—650 °C на катализаторе (металлические медь, серебро, никель, платина). Ацетон с высоким выходом (до 90 %) получают на катализаторе «серебро на пемзе» или на серебряной сетке:
Метод окисления пропена
[править | править код]Ацетон получают также прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
Физические свойства
[править | править код]Ацетон — при н.у. бесцветная подвижная летучая жидкость с характерным резким запахом. Во всех соотношениях смешивается с водой, диэтиловым эфиром, бензолом, метанолом, этанолом, многими сложными эфирами и др.
Основные термодинамические свойства ацетона:[3]
- Поверхностное натяжение (20 °C): 23,7 мН/м
- Стандартная энтальпия образования ΔH (298 К): −247,7 кДж/моль (ж)
- Стандартная энтропия образования S (298 К): 200 Дж/моль·K (ж)
- Стандартная мольная теплоемкость Cp (298 К): 125 Дж/моль·K (ж)
- Энтальпия плавления ΔHпл: 5,69 кДж/моль
- Энтальпия кипения ΔHкип: 29,1 кДж/моль
- Теплота сгорания Qp: 1829,4 кДж/моль
- Критическое давление: 4,7 МПа
- Критическая плотность: 0,273 г/см3
- Динамическая вязкость:
- 0,36 мПа·с (10 °C)
- 0,295 мПа·с (25 °C)
- 0,28 мПа·с (41 °C)
Термохимические свойства:
- Температура вспышки в воздухе[2]: (-20 °C)[1]
- Температура самовоспламенения на воздухе[2][3]: 465 °C
- Пределы взрывоопасных концентраций[2]: 2,6-12,8 %
Прочие свойства:
- Показатель преломления (для D-линии натрия):
- 1,3591 (20 °C)
- 1,3588 (25 °C)
- Показатель электролитической диссоциации: pKa = 20 (20 °C, вода)
- Диэлектрическая проницаемость (20 °C): 20,9
- Дипольный момент молекулы (20 °C): 2,84 Д
Ацетон хорошо растворяет многие органические вещества, в частности, ацетил- и нитроцеллюлозы, воски, алкалоиды и др., а также ряд солей.
Химические свойства
[править | править код]Окислительно-восстановительные реакции
[править | править код]Восстанавливается амальгамами магния или цинка до пинакона:
Окисляет вторичные спирты в кетоны в присутствии трет-бутилата алюминия (реакция Опенауэра)
При использовании большого избытка ацетона реакция смещается вправо.
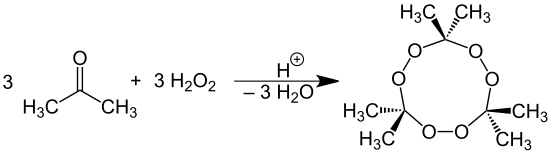
Под действием перекиси водорода на ацетон в кислой среде образуется перекись ацетона.
Ангидрид хрома окисляет ацетон до углекислого газа и воды. Ацетон реагирует с аммиаком и водородом в присутствии никеля или меди с образованием аминов:
Обычно реакция протекает при температуре 125-175 °C и давлении 5-10 атмосфер.
Присоединение нуклеофилов к карбонильной группе
[править | править код]Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение:
Ацетон легко присоединяет циановодород с образованием ацетонциангидрина:
Аналогично ацетон присоединяет хлороформ, образуя хлорэтон, который используется в качестве антисептика:
Реакции альфа-позиции
[править | править код]При воздействии ацетона на металлический натрий или амид натрия образуется ацетоннатрий, натриевый спирт изопропенилового спирта:
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
- +
Реакции конденсации
[править | править код]В щелочной среде вступает в альдольную самоконденсацию, с образованием диацетонового спирта:
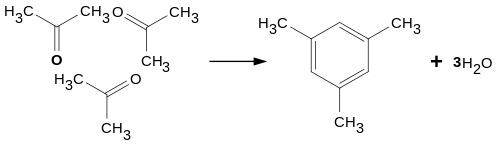
При конденсации трех молекул ацетона под действием концентрированной серной или соляной кислоты образуется симметричный триметилбензол (мезитилен):
Прочие реакции
[править | править код]При пиролизе (700 °C) образует кетен:
Обнаружение
[править | править код]В химико-токсикологическом анализе для обнаружения ацетона применяют реакции с растворами йода, нитропруссида натрия, фурфурола, ο-нитробензальдегида и метод микродиффузии.
Реакция на образование йодоформа[15].
При взаимодействии ацетона с раствором йода в щелочной среде образуется трииодметан (йодоформ):
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора аммиака и несколько капель раствора йода в йодиде калия (йодной настойки). В присутствии йода образуется жёлтый осадок трииодметана с характерным запахом, а его кристаллы имеют характерную гексалучевую форму. Предел обнаружения — 0,1 мг ацетона в пробе.
Реакция с нитропруссидом натрия (проба Легаля)[15][16].
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую. Кетоны, в молекулах которых отсутствуют метильные группы, непосредственно связанные с кетоновыми (СО—) группами, не дают такой реакции. Соответственно такие кетоны как метилэтилкетон, метилпропилкетон и другие — также дадут красную окраску с нитропруссидом.
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора гидроксида натрия и 5 капель 1%-го свежеприготовленного раствора нитропруссида натрия. При наличии ацетона в пробе появляется красная или оранжево-красная окраска. При прибавлении 10%-го раствора уксусной кислоты до кислой реакции через несколько минут окраска переходит в красно-фиолетовую или вишнёво-красную. Следует заметить, что бутанон дает аналогичную окраску с нитропруссидом натрия.
Применение
[править | править код]Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и так далее; пример:
Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем. В частности он используется как растворитель
- в производстве лаков;
- в производстве взрывчатых веществ;
- в производстве лекарственных препаратов;
- в составе клея для киноплёнок как растворитель ацетата целлюлозы и целлулоида[17];
- компонент для очистки поверхностей в различных производственных процессах;
- как очиститель инструмента и поверхностей от монтажной пены — в аэрозольных баллонах.
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который под давлением в чистом виде крайне взрывоопасен. Для этого используют ёмкости с пористым материалом, пропитанным ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Ацетон используется также при экстракции многих растительных веществ.
Лабораторное применение
[править | править код]В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности, в реакции алкилирования
для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
Ацетон применяется для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
В лабораториях используется для мытья химической посуды благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
Очистка
[править | править код]Технический ацетон обычно содержит воду, иногда — спирт и другие восстановители. Проба на присутствие восстановителей:
К 10 мл ацетона прибавляют 1 каплю раствора перманганата калия (1:1000); после 15 мин. при 15 °C не должно наблюдаться значительного посветления окраски[18].
Сушат ацетон безводным поташом (около 5 % от веса ацетона), нагревая смесь в течение нескольких часов с обратным холодильником, переливают в другую колбу и перегоняют над свежим осушителем. Металлический натрий и щёлочи непригодны для сушки ацетона[19].
Для использования в качестве растворителя при окислении органических веществ перманганатом калия ацетон перегоняют в присутствии небольшого количества перманганата калия (до устойчивой фиолетовой окраски раствора), при этом для удаления воды добавляют безводный поташ[20].
Очень чистый ацетон получают разложением аддукта ацетона и бисульфита натрия[20] либо продукта присоединения ацетона и иодистого натрия:
В 440 мл сухого свежеперегнанного ацетона растворяют при нагревании на водяной бане 100 г безводного иодистого натрия. Образующийся раствор охлаждают до −8 °C и аддукт отделяют отсасыванием. При нагревании аддукт разлагается, освобождающийся ацетон отгоняют, сушат безводным хлористым кальцием и снова перегоняют, защищая от влаги воздуха[21].
Пожароопасность
[править | править код]Одна из основных опасностей при работе с ацетоном — его лёгкая воспламеняемость. Температура самовоспламенения +465°C, температура вспышки −20°C. Воздушные смеси, содержащие от 2,5% до 12,8% (по объёму), взрывоопасны. С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним.
Метаболизм
[править | править код]Ацетон является естественным метаболитом, производимым организмами млекопитающих, в том числе и человеческим организмом. В крови в норме содержится 1—2 мг/100 мл ацетона, в суточном количестве мочи — 0,01—0,03 г. Некоторое количество ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом, некоторое — с мочой и выделениями кожи. В медицине ацетон относят к кетоновым телам. Нарушение нормального метаболизма, например, при сахарном диабете, приводит к так называемой ацетонурии — избыточному образованию и выведению ацетона.
Токсичность
[править | править код]Ацетон токсичен[22]. По данным[23] ПДК ацетона составляет 200 мг/м³ (среднесменная за 8 часов) и 800 мг/м³ (максимально разовая). По данным ряда исследований, например[24] средний порог восприятия запаха был в ~3 раза выше чем максимально разовая ПДК, и в ~12 раз выше среднесменной ПДК. При этом у части работников порог был значительно выше среднего значения (например, более 30 и 120 ПДК соответственно). В исследовании[25] среднее значение порога восприятия запаха было ещё выше — 11 000 ppm (28 000 мг/м3), что превышает среднесменную ПДК в 140 раз.
Ацетон ядовит, но относится к малоопасным веществам (класс опасности IV, категория безопасности для здоровья по NFPA — 1). Сильно раздражает слизистые оболочки: длительное вдыхание больших концентраций паров[прояснить] приводит к возникновению воспаления слизистых оболочек, отёку лёгких и токсической пневмонии.[источник не указан 1323 дня] Пары оказывают слабое наркотическое действие, сопровождаемое, чаще всего, дисфорией. При попадании внутрь вызывает состояние опьянения, сопровождаемое слабостью и головокружением, нередко — болями в животе; в существенных количествах возникает выраженная интоксикация, хотя, как правило, отравления ацетоном не смертельны. Возможно поражение печени (токсический гепатит), почек (уменьшение диуреза, появление крови и белка в моче) и коматозное состояние. При ингаляционном воздействии ацетон выводится гораздо медленнее (в течение нескольких часов), чем поступает, и поэтому может накапливаться в организме.
Правовой статус
[править | править код]Эта статья описывает ситуацию применительно лишь к одному региону, возможно, нарушая при этом правило о взвешенности изложения. |
Ацетон, в концентрации более 60%, в России входит в таблицу III спиcка IV «Перечня наркотических средств, психотропных веществ и их прекурсоров» и его оборот подлежит контролю. При работе в лаборатории с ацетоном операции, в которых он расходуется, должны вноситься в специальный «Журнал регистрации операций, при которых изменяется количество прекурсоров наркотических средств и психотропных веществ».
Примечания
[править | править код]- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 230. — 625 с.
- ↑ 1 2 3 4 Lewis R.J. Sax's Dangerous Properties of Industrial Materials. — 11ed.. — Wiley-interscience, 2004. — С. 22—23.
- ↑ 1 2 3 Рабинович В. А., Хавин З. Я. Краткий химический справочник: Справ. изд. / Под ред. Потехина А. А., Ефимова А. И.. — Издание 3-е, переработанное и дополненное. — Л.:: Химия, 1991. — С. 328—329. — 432 с. — ISBN 5-7245-0703-X.
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Chiang Y., Kresge A. J., Tang Y. S., Wirz J. The pKa and keto-enol equilibrium constant of acetone in aqueous solution (англ.) // Journal of the American Chemical Society / P. J. Stang — ACS, 1984. — Vol. 106, Iss. 2. — P. 460—462. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA00314A055
- ↑ Acetone - New World Encyclopedia. www.newworldencyclopedia.org. Дата обращения: 9 июля 2023. Архивировано 9 июля 2023 года.
- ↑ Контроль бета-кетонов. Дата обращения: 29 июля 2015. Архивировано 10 августа 2015 года.
- ↑ Ацетон (кетоновые тела) в моче. Дата обращения: 29 июля 2015. Архивировано 29 февраля 2020 года.
- ↑ 1 2 http://www.newchemistry.ru/printletter.php?n_id=4886 Архивная копия от 5 ноября 2011 на Wayback Machine ПРОИЗВОДСТВО АЦЕТОНА: получение, применение, рынок по данным АКПР (Академии конъюнктуры промышленных рынков)
- ↑ Bennewitz. Katalyse. Von Dr. W. Frankenburger und Dr. F. Dürr, Forschungslaboratorium Oppau der I. G. Farbenindustrie A. G. Sonderdruck aus Bd. VI der Enzyklopädie der technischen Chemie. Herausgegeben von Prof. Dr. Fritz Ullmann, Genf. Zweite, völlig neubearbeitete Auflage. 56 S. Verlag Urban & Schwarzenberg, Berlin und Wien 1930. Preis RM. 3,50 // Angewandte Chemie. — 1932-01-30. — Т. 45, вып. 5. — С. 116–116. — ISSN 1521-3757 0044-8249, 1521-3757. — doi:10.1002/ange.19320450511.
- ↑ John H. Northrop, Lauren H. Ashe, R. R. Morgan. A Fermentation Process for the Production of Acetone and Ethyl Alcohol. // Journal of Industrial & Engineering Chemistry. — 1919-08. — Т. 11, вып. 8. — С. 723–727. — ISSN 1943-2968 0095-9014, 1943-2968. — doi:10.1021/ie50116a006.
- ↑ TOC // Industrial & Engineering Chemistry. — 1921-10-01. — Т. 13, вып. 10. — С. 861–861. — ISSN 0019-7866. — doi:10.1021/ie50142a900.
- ↑ http://kodomo.cmm.msu.ru/~ramil.mintaev/projects/C.acetobutylicum/index.php Архивная копия от 20 декабря 2013 на Wayback Machine Ацито-бутановая бактерия
- ↑ Химическая энциклопедия. М. 1988, Т1, стр. 230
- ↑ 1 2 Крамаренко В. Ф. Токсикологическая химия. — К.: Выща шк. Головное изд-во, 1989. — С. 146—149. — 447 с. — ISBN 5-11-000148-0.
- ↑ Легаля проба. Дата обращения: 12 ноября 2015. Архивировано 21 сентября 2020 года.
- ↑ Ацетон // Фотокинотехника: Энциклопедия / Гл. ред. Е. А. Иофис. — М.: Советская энциклопедия, 1981. — 447 с.
- ↑ K. Bernhauer. Einführung in die organisch-chemische Laboratoriumstechnik. — Wien: Springer, 1944. — С. 49.
- ↑ Лабораторная техника органической химии / Б. Кейл. — Москва: Мир, 1966. — С. 603. — 751 с.
- ↑ 1 2 Л. Физер. Эксперимент в органической химии в книге "Современные методы эксперимента в органической химии". — Москва: Госхимиздат, 1960.
- ↑ Pl. A. Plattner. Analytische Methode der organischen Chemie. — Zürich: ETH, 1947.
- ↑ Чельцова М. А., Смусин Я. С. (суд.-мед.). Ацетон // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1975. — Т. 2 : Антибиотики — Беккерель. — С. 407. — 608 с. : ил.
- ↑ (Роспотребнадзор). № 1795 Пропан-2-он (Ацетон) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 125. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ↑ Charles J. Wysocki, Pamela Dalton, Michael J. Brody & Henry J. Lawley. Acetone Odor and Irritation Thresholds Obtained From Acetone-Exposed Factory Workers and From Control (Occupationally Unexposed) Subjects (англ.) // AIHA & ACGIH American Industrial Hygiene Association Journal. — Akrin (Ohio): Taylor & Francis, 1997. — October (vol. 58 (iss. 10). — P. 704—712. — ISSN 0002-8894. — doi:10.1080/15428119791012342.
- ↑ J. Enrique Cometto-Muñiz & William S. Cain. Efficacy of Volatile Organic Compounds in Evoking Nasal Pungency and Odor (англ.) // Archives of Environmental Health: An International Journal. — Taylor & Francis, 1993. — May (vol. 48 (iss. 5). — P. 309—314. — ISSN 0003-9896. — doi:10.1080/00039896.1993.9936719.
Ссылки
[править | править код]- Ацетон // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Ацетонемия // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Ацетоновая кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ГОСТ 2768-84. Ацетон технический. Технические условия.
- З. Гауптман, Ю. Грефе, Х. Ремане. Органическая химия. Пер.с нем. / Под ред. проф. Потапова В. М.. — Москва: Химия, 1979. — 832 с.




![{\displaystyle {\ce {(CH3COO)2Ca ->[t] CH3COCH3 + CaCO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6bf02851372be1b648b799f9915a9da8d8a1c0db)

![{\displaystyle {\ce {2CH_{3}COOH->[{400^{\circ },~{\text{Ce}}}]{CH_{3}COCH_{3}}+{CO_{2}}+{H_{2}O}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc3d3ac355fb56c4a1c6ae38b274c7991fe9494f)








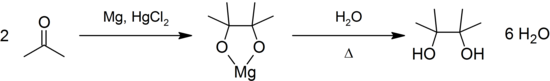
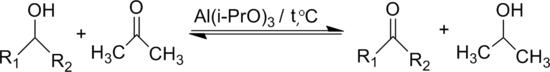















![{\displaystyle {\mathsf {\ CH_{3}COCH_{3}+Na_{2}[Fe(CN)_{5}NO]+2NaOH\longrightarrow \ Na_{4}[Fe(CN)_{5}ON{\text{=}}CHCOCH_{3}]+2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/350f5da7ad2328bc34b45d14c5ba1156acfa35ed)



