Обмен веществ: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
TXiKiBoT (обсуждение | вклад) м робот добавил: be-x-old:Мэтабалізм |
Meddoc13 (обсуждение | вклад) Нет описания правки |
||
| Строка 1: | Строка 1: | ||
{{другие значения |
{{другие значения}} |
||
[[Файл:ATP-3D-vdW.png|thumb|right|280px|Структура [[кофермент]]а [[аденозинтрифосфат]]а — главного посредника в энергетическом обмене веществ]] |
|||
'''Метаболи́зм''' (от {{lang-el|μεταβολή}}, «превращение, изменение»), '''обмен веществ''' — набор [[химическая реакция|химических реакций]], которые возникают в живом [[организм]]е для поддержания жизни. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды. Метаболизм обычно делится на 2 категории. [[Катаболизм]] разрушает сложные органические вещества до более простых, например для накопления [[энергия|энергии]] при [[клеточное дыхание|клеточном дыхании]]. [[Анаболизм]] использует энергию для построения элементов клетки таких, как [[белок|белки]] и [[нуклеиновая кислота|нуклеиновые кислоты]]. |
|||
Химические реакции обмена веществ происходят в [[метаболические пути|метаболических путях]], где одно [[химическое вещество]] превращается через серию реакций в другое химическое вещество при участии определённых [[фермент]]ов. Ферменты имеют важное значение в метаболизме, поскольку они позволяют организмам управлять необходимыми реакцями, которые требуют энергии и не протекают самостоятельно. Ферменты действуют как [[катализатор]]ы и позволяют этим реакциям протекать быстро и эффективно. Ферменты также позволяют регулировать метаболические пути в ответ на изменения среды [[клетка|клетки]] или сигналы от других клеток. |
|||
'''Метаболи́зм''' (от {{lang-el|μεταβολή}}, «превращение, изменение»), '''обмен веществ''' — полный процесс превращения [[химическое вещество|химических веществ]] в [[организм]]е, обеспечивающих его рост, развитие, деятельность и [[жизнь]] в целом. |
|||
Обмен веществ организма определяет какие вещества питательные, а какие [[яд]]овитые. Например, некоторые [[прокариот]]ы используют [[сероводород]] как питательное вещество, однако этот газ ядовит для [[животные|животных]].<ref name="Physiology1">{{cite journal |author=Friedrich C |title=Physiology and genetics of sulfur-oxidizing bacteria |journal=Adv Microb Physiol |volume=39 |issue= |pages=235–89 |year=1998 |pmid=9328649 |doi=10.1016/S0065-2911(08)60018-1}}</ref> [[Скорость обмена веществ]] также влияет на количество пищи, необходимой для организма. |
|||
В живом организме постоянно расходуется [[энергия]], причём не только во время физической и умственной работы, но и при полном покое (сне). |
|||
Отличительная особенность метаболизма — схожесть основных метаболических путей и компонентов даже между очень разными [[вид]]ами.<ref>{{cite journal |author=Pace NR |title=The universal nature of biochemistry |journal=Proc. Natl. Acad. Sci. U.S.A. |volume=98 |issue=3 |pages=805–8 |year=2001 |month=January |pmid=11158550 |pmc=33372 |doi=10.1073/pnas.98.3.805}}</ref> Например, ряд [[карбоновые кислоты|карбоновых кислот]], известные как посредники в [[цикл трикарбоновых кислот|цикле трикарбоновых кислот]] присутствуют во всех организмах, начиная от одноклеточных [[бактерия|бактерий]] ''[[Бактерии группы кишечных палочек|Escherichia coli]]'' и заканчивая большим количеством [[Многоклеточный организм|многоклеточных организмов]], таких как [[слон]]ы.<ref name=SmithE>{{cite journal |author=Smith E, Morowitz H |title=Universality in intermediary metabolism |pmc=516543 |journal=Proc Natl Acad Sci USA |volume=101 |issue=36 |pages=13168–73 |year=2004 |pmid=15340153 |doi=10.1073/pnas.0404922101 |url=http://www.pnas.org/cgi/pmidlookup?view=long&pmid=15340153}}</ref> Эти поразительные сходства в обмене веществ вероятно связаны с высокой [[эффективность]]ю метаболических путей, а также с их ранним появлением в истории [[эволюция|эволюции]].<ref name=Ebenhoh>{{cite journal |author=Ebenhöh O, Heinrich R |title=Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems |journal=Bull Math Biol |volume=63 |issue=1 |pages=21–55 |year=2001 |pmid=11146883 |doi=10.1006/bulm.2000.0197}}</ref><ref name=Cascante>{{cite journal |author=Meléndez-Hevia E, Waddell T, Cascante M |title=The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution |journal=J Mol Evol |volume=43 |issue=3 |pages=293–303 |year=1996 |pmid=8703096 |doi=10.1007/BF02338838}}</ref> |
|||
Обмен веществ представляет собой комплекс [[Биохимия|биохимических]] и энергетических процессов, обеспечивающих использование пищевых веществ для нужд организма и удовлетворения его потребностей в пластических и энергетических веществах. |
|||
== Основные моменты биохимии == |
|||
== История изучения == |
|||
{{further|[[Клетка]] и [[Биохимия]]}} |
|||
[[Файл:Trimyristin-3D-vdW.png|right|thumb|250px|Структура липида [[триглицерид]]а]] |
|||
Большинство структурных элементов, входящих в состав животных, растений и микробов, образованы тремя классами [[молекула|молекул]]: [[аминокислота]]ми, [[углевод]]ами и [[липиды|липидами]] (часто называемые [[жиры|жирами]]). Так как эти молекулы имеют важное значение для жизни, метаболические реакции сосредоточены на создании этих молекул при строительстве клеток и тканей или разрушении их с целью использования в качестве источника энергии. Многие важные биохимические реакции объединяются вместе для создания [[полимер]]ов таких как [[ДНК]] и [[белки]]. Эти [[макромолекулы]] очень важны. |
|||
{| class="wikitable" style="margin-left: auto; margin-right: auto;" |
|||
!Тип молекулы |
|||
!Название формы [[мономер]]а |
|||
!Название формы [[полимер]]а |
|||
!Примеры форм полимера |
|||
|- |
|||
|align="center" |[[Аминокислота|Аминокислоты]] |
|||
|align="center" |Аминокислоты |
|||
|align="center" |[[Белки]] (синоним: полипептиды) |
|||
|align="center" |Волоконные и глобулярные белки |
|||
|- |
|||
|align="center" |[[Углеводы]] |
|||
|align="center" |[[Моносахариды]] |
|||
|align="center" |[[Полисахариды]] |
|||
|align="center" |[[Крахмал]], [[гликоген]] и [[целлюлоза]] |
|||
|- |
|||
|align="center" |[[Нуклеиновые кислоты]] |
|||
|align="center" |[[Нуклеотиды]] |
|||
|align="center" |[[Полинуклеотиды]] |
|||
|align="center" |[[ДНК]] и [[РНК]] |
|||
|} |
|||
=== Аминокислоты и белки === |
|||
Хотя, как мы сейчас знаем, обмен веществ происходит непрерывно, видимая псевдонеизменность нашего тела долгое время вводила в заблуждение не только неискушенных в науке людей, но и многих учёных и философов древности. Тогда полагали, что в организме имеются два вида веществ; одни из них идут на строительство тела, они неподвижны, статичны; другие же, используемые в качестве источника энергии, быстро перерабатываются. |
|||
[[Белки]] состоят из [[аминокислоты|аминокислот]], выстроенных в линейную цепочку и соединённых [[пептидная связь|пептидными связями]]. Многие белки — [[фермент]]ы, которые катализируют химические реакции обмена веществ. Другие белки выполняют структурную или механическую функцию (например, образуют [[цитоскелет]]).<ref>{{cite journal |author=Michie K, Löwe J |title=Dynamic filaments of the bacterial cytoskeleton |journal=Annu Rev Biochem |volume=75 |issue= |pages=467–92 |year=2006 |pmid=16756499 |doi=10.1146/annurev.biochem.75.103004.142452}}</ref> Белки также играют важную роль в сигнальной системе клеток, иммунных реакциях, [[Агрегация клеток|агрегации клеток]], [[активный транспорт|активном транспорте]] через мембраны и [[клеточный цикл|клеточном цикле]].<ref name=Nelson>{{cite book | last = Nelson | first = David L. | coauthors = Michael M. Cox | title = Lehninger Principles of Biochemistry | publisher = W. H. Freeman and company | year = 2005 | location = New York | pages = 841 | isbn = 0-7167-4339-6}}</ref> |
|||
=== Липиды === |
|||
Однако внедрение в биологические исследования меченых атомов позволило в [[вивисекция|экспериментах на животных]] установить, что во всех тканях и клетках обмен веществ происходит непрерывно — никакой разницы между «строительными» и «энергетическими» молекулами не существует. В организме все молекулы равным образом участвуют в обмене веществ. В среднем у человека каждые 80 дней меняется половина всех тканевых [[белок|белков]]; [[фермент]]ы [[печень|печени]] (в ней идут особенно интенсивные реакции) обновляются через 2-4 часа, а некоторые — через несколько десятков минут. |
|||
[[Липиды]] — наиболее разнообразная группа биохимических веществ. Они используются для построения биологических мембран таких, как [[клеточная мембрана]], или как источник энергии.<ref name=Nelson/> Липиды, как правило, [[Гидрофобность|гидрофобные]] или [[Амфифильность|амфифильные]] биологические молекулы, которые растворяются в [[Растворитель|органических растворителях]] таких, как [[бензол]] или [[хлороформ]].<ref>{{cite journal |author=Fahy E, Subramaniam S, Brown H, Glass C, Merrill A, Murphy R, Raetz C, Russell D, Seyama Y, Shaw W, Shimizu T, Spener F, van Meer G, VanNieuwenhze M, White S, Witztum J, Dennis E |title=A comprehensive classification system for lipids |url=http://www.jlr.org/cgi/content/full/46/5/839 |journal=J Lipid Res |volume=46 |issue=5 |pages=839–61 |year=2005 |pmid=15722563 |doi=10.1194/jlr.E400004-JLR200}}</ref> [[Жиры]] — большая группа соединений, которые содержат [[жирные кислоты]] и [[глицерин]]; молекула глицерина, присоединившая к 3 жирным кислотам сложные эфиры называется [[триглицерид]].<ref>{{cite web | title=Nomenclature of Lipids |publisher=IUPAC-IUB Commission on Biochemical Nomenclature (CBN) | url=http://www.chem.qmul.ac.uk/iupac/lipid/ |accessdate=2007-03-08}}</ref> Существует несколько вариаций этой базовой структуры (например, [[сфингозин]] в [[сфинголипид]]ах, [[Гидрофильность|гидрофильные]] группы [[фосфат]]ов в [[фосфолипид]]ах. [[Стероид]]ы, например [[холестерол]], — ещё один большой класс липидов, которые [[синтез]]ируются в клетках.<ref>{{cite journal |author=Hegardt F |title=Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis |pmc=1220089 |journal=Biochem J |volume=338 |issue=Pt 3 |pages=569–82 |year=1999 |pmid=10051425 |doi=10.1042/0264-6021:3380569}}</ref> |
|||
=== Углеводы === |
|||
[[Файл:Perfused Rat Liver.JPG|thumb|left|300px|[[Печень]] — важнейший орган метаболизма у животных (фотография печени крысы)]] |
|||
[[Файл:Glucose Fisher to Haworth.gif|thumb|250px|right|alt=The straight chain form consists of four C H O H groups linked in a row, capped at the ends by an aldehyde group C O H and a methanol group C H 2 O H. To form the ring, the aldehyde group combines with the O H group of the next-to-last carbon at the other end, just before the methanol group.|[[Глюкоза]] может существовать как в виде прямой цепи, так и в кольцевой форме.]] |
|||
[[Углеводы]] — [[альдегиды]] или [[кетоны]] с множеством [[гидроксильная группа|гидроксильных групп]], которые могут существовать в виде прямой цепочки или кольца. Углеводы — наиболее распространённые биологические молекулы. Они выполняют множество функций: хранение и транспортировка энергии ([[крахмал]], [[гликоген]]), структурная ([[целлюлоза]] растений, [[хитин]] у животных).<ref name=Nelson/> Основная углеводная единица называется [[моносахарид]] и включает [[галактоза|галактозу]], [[фруктоза|фруктозу]] и самое главное [[глюкоза|глюкозу]]. Моносахариды могут объединяться для образования разнообразных [[полисахарид]]ов.<ref>{{cite journal |author=Raman R, Raguram S, Venkataraman G, Paulson J, Sasisekharan R |title=Glycomics: an integrated systems approach to structure-function relationships of glycans |journal=Nat Methods |volume=2 |issue=11 |pages=817–24 |year=2005 |pmid=16278650 |doi=10.1038/nmeth807}}</ref> |
|||
=== Нуклеотиды === |
|||
== Этапы метаболизма == |
|||
[[Полимер]]ы [[ДНК]] и [[РНК]] — длинные цепочки нуклеотидов. Эти молекулы имеют важное значение для хранения и использования генетической информации через процессы [[транскрипция|транскрипции]] и [[биосинтез белка|биосинтеза белка]].<ref name=Nelson/> Эта информация защищена механизмами [[Репарация ДНК|репарации ДНК]] и распространяется через [[Репликация ДНК|репликацию ДНК]]. Некоторые [[вирус]]ы имеют [[геном]] РНК. Например, [[ВИЧ]], который использует [[Обратная транскрипция|обратную транскрипцию]] для создания ДНК-шаблона из своего вирусного генома РНК.<ref>{{cite journal |author=Sierra S, Kupfer B, Kaiser R |title=Basics of the virology of HIV-1 and its replication |journal=J Clin Virol |volume=34 |issue=4 |pages=233–44 |year=2005 |pmid=16198625 |doi=10.1016/j.jcv.2005.09.004}}</ref> РНК в [[рибозим]]ах таких, как [[Сплайсосома|сплайсосомы]] и [[рибосома|рибосомы]] схожи с ферментами, которые катализируют химические реакции. [[Нуклеозид]]ы образуются при присоединении [[Азотистые основания|азотистых оснований]] к [[Рибоза|рибозе]] сахара. Эти основания — [[Гетероциклические соединения|гетероциклические]] кольца, содержащие [[азот]], классифицируются как [[пурины]] или [[пиримидины]]. Нуклеотиды также выступают в качестве [[кофермент]]ов в реакциях перемещения метаболических групп.<ref name=Wimmer>{{cite journal |author=Wimmer M, Rose I |title=Mechanisms of enzyme-catalyzed group transfer reactions |journal=Annu Rev Biochem |volume=47 |issue= |pages=1031–78 |year=1978 |pmid=354490 |doi=10.1146/annurev.bi.47.070178.005123}}</ref> |
|||
=== Коферменты === |
|||
Условно процесс обмена веществ можно разделить на три этапа: |
|||
[[Файл:Acetyl-CoA-2D.svg|thumb|right|300px|Структура [[кофермент]]а [[Ацетил-КоА]]. [[Ацетил|Ацетил группа]] связана с атомом серы по левому краю.]] |
|||
{{further|[[Кофермент]]}} |
|||
Метаболизм включает широкий спектр химических реакций, но большинство подпадают под несколько основных типов реакций, которые связаны с перемещением [[Функциональная группа|функциональных групп]].<ref>{{cite journal |author=Mitchell P |title=The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems |journal=Eur J Biochem |volume=95 |issue=1 |pages=1–20 |year=1979 |pmid=378655 |doi=10.1111/j.1432-1033.1979.tb12934.x}}</ref> Такие химически процессы позволяют клеткам использовать ряд метаболических посредников для транспортировки химических групп между различными реакциями.<ref name=Wimmer/> Эту группу переносчиков называют [[кофермент]]ами. Каждый класс реакций с переносом групп осуществляется отдельным коферментом и рядом ферментов.<ref name=Dimroth>{{cite journal |author=Dimroth P, von Ballmoos C, Meier T |title=Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series |pmc=1456893 |journal=EMBO Rep |volume=7 |issue=3 |pages=276–82 |year=2006 |month=March |pmid=16607397 |doi=10.1038/sj.embor.7400646}}</ref> |
|||
[[Аденозинтрифосфат]] (АТФ) — один из центральных коферментов, универсальный источник энергии клеток. Этот [[нуклеотид]] используется для передачи химической энергии между различными химическими реакциями. В клетках существует небольшое количество АТФ, но она постоянно регенерируется. Человеческий организм способен за сутки израсходовать массу АТФ, равной массе собственного тела.<ref name=Dimroth/> АТФ выступает в качестве связующего звена между катаболизмом и анаболизмом: при катаболических реакциях образуется АТФ, а при анаболических — она потребляется. АТФ также выступает в качестве носителя фосфатных групп в реакциях [[Фосфорилирование|фосфорилирования]]. |
|||
'''Первый этап''' — [[фермент]]ативное расщепление [[белок|белков]], [[жир]]ов и [[углевод]]ов до растворимых в воде [[аминокислоты|аминокислот]], [[Углеводы#Простые и сложные углеводы|моно- и дисахаридов]], [[глицерин]]а, [[жирные кислоты|жирных кислот]] и других соединений, происходящее в различных отделах [[Желудочно-кишечный тракт|желудочно-кишечного тракта]], и всасывание их в кровь и лимфу. |
|||
[[Витамин]] — органическое соединение, которое необходимо в небольших количествах и не синтезируется в клетках. В питании человека, большинство витаминов функционируют как коферменты после преобразования. Например, все водорастворимые витамины фосфорилируются или соединяются с нуклеотидами, когда они используются в клетках.<ref>{{Cite book | last1 = Coulston | first1 = Ann | last2 = Kerner | first2 = John | last3 = Hattner | first3 = JoAnn | last4 = Srivastava | first4 = Ashini | contribution = Nutrition Principles and Clinical Nutrition | title = Stanford School of Medicine Nutrition Courses | publisher = SUMMIT | year = 2006 }}</ref> [[Никотинамидадениндинуклеотид]] (НАДН), производная витамина B<sub>3</sub> ([[ниацин]]), — важный кофермент, который выступает в качестве [[акцептор]]а водорода. Сотни отдельных видов [[дегидрогеназа|дегидрогеназ]] удаляют электроны из своих субстратов и [[Окислительно-восстановительные реакции|окисляют]] НАД<sup>+</sup> до НАДН. Эта окисленная форма кофермента выступает в качестве субстрата для различных [[редуктаза|редуктаз]] в клетке.<ref>{{cite journal |author=Pollak N, Dölle C, Ziegler M |title=The power to reduce: pyridine nucleotides—small molecules with a multitude of functions |journal=Biochem J |volume=402 |issue=2 |pages=205–18 |year=2007 |pmid=17295611 |doi=10.1042/BJ20061638 |pmc=1798440}}</ref> Никотинамидадениндинуклеотид существует в двух связанных формах в клетке: НАДН и НАДФН. НАД<sup>+</sup>/НАДН форма — важна больше в катаболических реакций, а НАДФ<sup>+</sup>/НАДФН используется в анаболических реакциях. |
|||
'''Второй этап''' — транспорт питательных веществ кровью к тканям и [[клеточный метаболизм]], результатом которого является их ферментативное расщепление до конечных продуктов. Часть этих продуктов используется для построения составных частей [[клеточная мембрана|мембран]], [[цитоплазма|цитоплазмы]], для синтеза [[биологически активные вещества|биологически активных веществ]] и воспроизведения [[клетка|клеток]] и [[ткань (биология)|тканей]]. Расщепление веществ сопровождается выделением энергии, которая используется для процесса синтеза и обеспечения работы каждого органа и организма в целом. |
|||
[[Файл:1GZX Haemoglobin.png|thumb|300px|left|Структура [[гемоглобин]]а. Белковые субъединицы окрашены красным и синим, а железосодержащий [[гем]] — зелёным. Из {{PDB|1GZX}}.]] |
|||
'''Третий этап''' — выведение конечных продуктов метаболизма в составе [[моча|мочи]], [[кал]]а, [[пот]]а, через легкие в виде [[углекислый газ|CO<sub>2</sub>]] и т. д. |
|||
=== Минералы и кофакторы === |
|||
== Анаболизм и катаболизм == |
|||
Неорганические элементы играют важнейшую роль в обмене веществ. Около 99 % массы млекопитающего состоит из [[углерод]]а, [[азот]]а, [[кальций|кальция]], [[натрий|натрия]], [[хлор]]а, [[калий|калия]], [[водород]]а, [[фосфор]]а, [[кислород]]а и [[сера|серы]].<ref name=Heymsfield>{{cite journal |author=Heymsfield S, Waki M, Kehayias J, Lichtman S, Dilmanian F, Kamen Y, Wang J, Pierson R |title=Chemical and elemental analysis of humans in vivo using improved body composition models |journal=Am J Physiol |volume=261 |issue=2 Pt 1 |pages=E190–8 |year=1991 |pmid=1872381}}</ref> [[Органические соединения]] (белки, жиры и углеводы) содержат большое количество углерода и азота.<ref name=Heymsfield/> |
|||
Обмен веществ состоит из двух противоположных, одновременно протекающих процессов. Первый — [[анаболизм]] — объединяет все реакции, связанные с [[химический синтез|синтезом]] необходимых веществ, их усвоением и использованием для роста, развития и жизнедеятельности организма. Второй — [[катаболизм]] — включает реакции, связанные с распадом веществ, их окислением и выведением из организма продуктов распада (см. тж. [[Окислительно-восстановительные реакции]]). |
|||
Множество неорганических элементов выступают в качестве [[ион]]ных [[электролит]]ов. Наиболее важны для организма ионы [[натрий|натрия]], [[калий|калия]], [[кальций|кальция]], [[магний|магния]], [[хлорид]]ов, [[фосфат]]ов и органических ионов [[гидрокарбонат]]а. Баланс этих ионов внутри и вне клетки определяет [[осмотическое давление]] и [[рН]].<ref>{{cite journal |author=Sychrová H |title=Yeast as a model organism to study transport and homeostasis of alkali metal cations |url=http://www.biomed.cas.cz/physiolres/pdf/53%20Suppl%201/53_S91.pdf |format=PDF|journal=Physiol Res |volume=53 Suppl 1 |issue= |pages=S91–8 |year=2004 |pmid=15119939}}</ref> Ионы также важны для [[нерв]]ов и [[мышца|мышц]]. [[Потенциал действия]] в этих тканях возникает при обмене электролитами между [[внеклеточная жидкость|внеклеточной жидкостью]] и [[цитозоль|цитозолем]].<ref>{{cite journal |author=Levitan I |title=Modulation of ion channels in neurons and other cells |journal=Annu Rev Neurosci |volume=11 |issue= |pages=119–36 |year=1988 |pmid=2452594 |doi=10.1146/annurev.ne.11.030188.001003}}</ref> Электролиты входят и выходят из клетки через белки в клеточной мембране. Эти белки называют [[ионный канал|ионными каналами]]. Например, [[мышечное сокращение]] зависит от движения кальция, натрия и калия через ионные каналы в клеточной мембране и [[Т-трубочка|Т-трубочки]].<ref>{{cite journal |author=Dulhunty A |title=Excitation-contraction coupling from the 1950s into the new millennium |journal=Clin Exp Pharmacol Physiol |volume=33 |issue=9 |pages=763–72 |year=2006 |pmid=16922804 |doi=10.1111/j.1440-1681.2006.04441.x}}</ref> |
|||
Главным образом через реакции анаболизма протекает процесс ассимиляции (усвоения) питательных веществ, а реакции катаболизма составляют основу диссимиляции — освобождения организма от веществ, его составляющих (употребление терминов «[[Ассимиляция (биология)|ассимиляция]]» как синонима анаболизма, а «[[Диссимиляция (химия)|диссимиляция]]» — синонима катаболизма некорректно, так как они являются более общими биологическими понятиями)........ |
|||
[[Переходные металлы]], как правило, присутствует в организме как [[микроэлемент]]ы; [[цинк]] и [[железо]] наиболее распространённые элементы.<ref>{{cite journal |author=Mahan D, Shields R |title=Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight |url=http://jas.fass.org/cgi/reprint/76/2/506 |journal=J Anim Sci |volume=76 |issue=2 |pages=506–12 |year=1998 |pmid=9498359}}</ref><ref name=Husted>{{cite journal |author=Husted S, Mikkelsen B, Jensen J, Nielsen N |title=Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics |journal=Anal Bioanal Chem |volume=378 |issue=1 |pages=171–82 |year=2004 |pmid=14551660 |doi=10.1007/s00216-003-2219-0}}</ref> Эти металлы используются некоторыми белками (например, [[кофактор]]ы) и имеют важное значение для активности ферментов, таких как [[каталаза]] и белков-переносчиков кислорода ([[гемоглобин]]).<ref>{{cite journal |author=Finney L, O'Halloran T |title=Transition metal speciation in the cell: insights from the chemistry of metal ion receptors |journal=Science |volume=300 |issue=5621 |pages=931–6 |year=2003 |pmid=12738850 |doi=10.1126/science.1085049}}</ref> Эти кофакторы тесно связаны со специфическим белком, хотя ферментативные кофакторы могут быть изменены в процессе катализа; кофакторы всегда возвращаются к своему первоначальному состоянию после катализа. Организм получает металлы-микроэлементы из специфических переносчиков (например, [[ферритин]] или [[металлотионеин]]), когда они не используются.<ref>{{cite journal |author=Cousins R, Liuzzi J, Lichten L |title=Mammalian zinc transport, trafficking, and signals |url=http://www.jbc.org/cgi/content/full/281/34/24085 |journal=J Biol Chem |volume=281 |issue=34 |pages=24085–9 |year=2006 |pmid=16793761 |doi=10.1074/jbc.R600011200}}</ref><ref>{{cite journal |author=Dunn L, Rahmanto Y, Richardson D |title=Iron uptake and metabolism in the new millennium |journal=Trends Cell Biol |volume=17 |issue=2 |pages=93–100 |year=2007 |pmid=17194590 |doi=10.1016/j.tcb.2006.12.003}}</ref> |
|||
== Прочие аспекты == |
|||
== Катаболизм == |
|||
Обмен веществ обеспечивает присущее живому организму как системе динамическое равновесие, при котором взаимно уравновешиваются синтез и разрушение, размножение и гибель. В основе реакций обмена веществ лежат физико-химические взаимодействия между [[атом]]ами и [[молекула]]ми, подчиняющиеся единым для живой и неживой материи законам. Сказанное означает, что сама возможность существования жизни, в первооснове своей, сводится к элементарным актам физико-химических процессов. Но живым организмам присущи свои особенности. |
|||
{{further|[[Катаболизм]]}} |
|||
Катаболизм — множество метаболических процессов, при которых расщепляются и окисляются крупные пищевые молекулы. Цель катаболических реакций — получение энергии и компонентов, необходимых для анаболических реакций. Классификация организмов может быть основана на источнике получения энергии и углерода, как показано в таблице ниже. Органические молекулы используются в качестве источника энергии в [[органотроф]]ами, [[литотроф]]ы используют неорганические субстраты, а [[фототроф]]ы поглощают [[солнечный свет]] как источник химической потенциальной энергии. Однако, все эти различные формы обмена веществ зависят от [[Окислительно-восстановительные реакции|окислительно-восстановительных реакций]], которые связаны с передачей электронов от восстановленных доноров молекул, таких как [[органические молекулы]], [[вода]], [[аммиак]], [[сероводород]], на акцепторные молекулы, такие как [[кислород]], [[нитраты]] или [[сульфат]].<ref>{{cite journal |author=Nealson K, Conrad P |title=Life: past, present and future |journal=Philos Trans R Soc Lond B Biol Sci |volume=354 |issue=1392 |pages=1923–39 |year=1999 |pmid=10670014 |pmc=1692713 |doi=10.1098/rstb.1999.0532 |url=http://rstb.royalsocietypublishing.org/cgi/pmidlookup?view=long&pmid=10670014 }}</ref> У животных эти реакции сопряжены с расщеплением сложных органических молекул до более простых, таких как [[двуокись углерода]] и воду. В [[фотосинтез]]ирующих организмах, таких как растения и [[цианобактерии]], эти реакции переноса электрона не высвобождают энергию, но они используются как способ хранения энергии, поглощаемой из солнечного света.<ref name=Nelson>{{cite journal |author=Nelson N, Ben-Shem A |title=The complex architecture of oxygenic photosynthesis |journal=Nat Rev Mol Cell Biol |volume=5 |issue=12 |pages=971–82 |year=2004 |pmid=15573135 |doi=10.1038/nrm1525}}</ref> |
|||
С обменом веществ неразрывно связан обмен [[энергия|энергии]] в организме. Живые организмы могут существовать только при условии непрерывного поступления энергии извне. Поэтому они постоянно нуждаются в энергии для выполнения различного рода работы: механической — передвижение тела, сердечная деятельность и т. д.; гальванической — создание [[разность потенциалов|разности потенциалов]] в тканях и клетках; химической — синтез веществ и т. д. |
|||
::: '''Классификация организмов на основе их метаболизма''' |
|||
Первичным источником энергии для всего живого на Земле, за очень редким исключением<ref>В качестве альтернативы солнцу могут быть использованы [[гидротермальные источники срединно-океанических хребтов|гидротермальные источники]] или же природные источники [[излучение|излучения]]</ref>, служит [[Солнце|солнечное]] излучение. Пища образуется благодаря той же энергии Солнца. Начальное звено пищевой цепи — [[растение|растения]], аккумулирующие в процессе [[фотосинтез]]а солнечную энергию. В зелёном пигменте растений — [[хлорофилл]]е — под воздействием [[квант]]ов света из [[вода|воды]] и [[углекислый газ|углекислого газа]] синтезируются [[органическое вещество|органические вещества]] — основа жизни. |
|||
{| class="wikitable float-right" style="text-align:center" width="50%" |
|||
|+ |
|||
|- |
|||
| rowspan=2 bgcolor="#FFFF00" |'''Источник энергии''' || bgcolor="#FFFF00" | '''Солнечный свет''' || bgcolor="#FFFF00" | '''фото-''' || rowspan=2 colspan=2 | || rowspan=6 bgcolor="#7FC31C" | '''-троф''' |
|||
|- |
|||
| bgcolor="#FFFF00" | '''Первичные молекулы''' || bgcolor="#FFFF00" | '''хемо-''' |
|||
|- |
|||
| rowspan=2 bgcolor="#FFB300" | '''Донор электронов''' || bgcolor="#FFB300" | '''[[Органическое соединение]]''' || rowspan=2 | || bgcolor="#FFB300" | '''органо-''' || rowspan=2 | |
|||
|- |
|||
| bgcolor="#FFB300" | '''[[Неорганическое соединение]]''' || bgcolor="#FFB300" | '''лито-''' |
|||
|- |
|||
| rowspan=2 bgcolor="#FB805F" | '''Источник углерода''' || bgcolor="#FB805F" | '''[[Органическое соединение]]''' || rowspan=2 colspan=2 | || bgcolor="#FB805F" | '''гетеро-''' |
|||
|- |
|||
| bgcolor="#FB805F" | '''[[Неорганическое соединение]]''' || bgcolor="#FB805F" | '''ауто-''' |
|||
|} |
|||
Процесс катаболических реакций у животных может быть разделён на три основных этапа. Во-первых, крупные органические молекулы, такие как [[белок|белки]], [[полисахарид]]ы и [[липид]]ы расщепляются до более мелких компонентов вне клеток. Далее, эти небольшие молекулы усваиваются клетками и превращается в ещё более мелкие молекулы, как правило, ацетил-коэнзим А ([[ацетил-КоА]]), который производит немного энергии. Наконец, ацетил группа коэнзима А окисляется до воды и углекислого газа в [[цикл лимонной кислоты|цикле лимонной кислоты]] и [[Дыхательная цепь переноса электронов|дыхательной цепи переноса электронов]], высвобождая энергию, которая хранится за счёт окисления кофермента [[Никотинамидадениндинуклеотид|НАД<sup>+</sup>]] до НАДН. |
|||
Состав [[пища|пищи]] сложен и разнообразен. В ней больше всего главных пищевых веществ, к которым относятся белки, жиры, углеводы. |
|||
=== Пищеварение === |
|||
Содержатся в пище и минеральные элементы — [[макроэлемент]]ы [[кальций]], [[фосфор]], [[натрий]] и др., [[микроэлемент]]ы [[медь]], [[кобальт]], [[йод]], [[цинк]], [[марганец]], [[селен]] и др. Есть и вкусовые вещества, которые придают ей особые свойства. |
|||
{{further|[[Пищеварение]] и [[Желудочно-кишечный тракт]]}} |
|||
Макромолекулы, такие как крахмал, целлюлоза или белки, должны расщепляться до более мелких единиц прежде, чем они могут быть использованы в клеточном обмене веществ. Несколько классов ферментов переваривают эти полимеры. К таким пищеварительным ферментам относят [[протеаза|протеазы]], которые расщепляют белки до аминокислот, а также [[Гликозил-гидролазы|гликозидазы]], которые расщепляют полисахариды до моносахаридов. |
|||
Микробы просто выделяют пищеварительные ферменты в пространство вокруг себя,<ref>{{cite journal |author=Häse C, Finkelstein R |title=Bacterial extracellular zinc-containing metalloproteases |journal=Microbiol Rev |volume=57 |issue=4 |pages=823–37 |year=1993 |month=December |pmid=8302217 |pmc=372940 |url=http://mmbr.asm.org/cgi/pmidlookup?view=long&pmid=8302217 }}</ref><ref>{{cite journal |author=Gupta R, Gupta N, Rathi P |title=Bacterial lipases: an overview of production, purification and biochemical properties |journal=Appl Microbiol Biotechnol |volume=64 |issue=6 |pages=763–81 |year=2004 |pmid=14966663 |doi=10.1007/s00253-004-1568-8}}</ref> в то время как животные выделяют эти ферменты только из специализированных железистых клеток.<ref>{{cite journal |author=Hoyle T |title=The digestive system: linking theory and practice |journal=Br J Nurs |volume=6 |issue=22 |pages=1285–91 |year=1997 |pmid=9470654}}</ref> Аминокислоты и сахара, обработанные внеклеточными ферментами, затем поступают в клетки с помощью [[активный транспорт|активного транспорта]].<ref>{{cite journal |author=Souba W, Pacitti A |title=How amino acids get into cells: mechanisms, models, menus, and mediators |journal=JPEN J Parenter Enteral Nutr |volume=16 |issue=6 |pages=569–78 |year=1992 |pmid=1494216 |doi=10.1177/0148607192016006569}}</ref><ref>{{cite journal |author=Barrett M, Walmsley A, Gould G |title=Structure and function of facilitative sugar transporters |journal=Curr Opin Cell Biol |volume=11 |issue=4 |pages=496–502 |year=1999 |pmid=10449337 |doi=10.1016/S0955-0674(99)80072-6}}</ref> |
|||
[[Файл:Catabolism schematic ru.svg|thumb|left|300px|Упрощённая схема катаболизма [[белок|белков]], [[углевод]]ов и [[жир]]ов]] |
|||
=== Энергия из органических соединений === |
|||
{{further|[[Клеточное дыхание]], [[Брожение]], [[Липолиз]] |
|||
Углеводный катаболизм — расщепление углеводов до более мелких частиц. Углеводы, как правило, поглощаются клетками после их преобразования в [[моносахарид]]ы.<ref>{{cite journal |author=Bell G, Burant C, Takeda J, Gould G |title=Structure and function of mammalian facilitative sugar transporters |journal=J Biol Chem |volume=268 |issue=26 |pages=19161–4 |year=1993 |pmid=8366068}}</ref> Попав внутрь, сахара (например, [[глюкоза]] и [[фруктоза]]) в процессе [[гликолиз]]а превращаются в [[пируват]] и вырабатывается некоторое количество АТФ.<ref name=Bouche>{{cite journal |author=Bouché C, Serdy S, Kahn C, Goldfine A |title=The cellular fate of glucose and its relevance in type 2 diabetes |url=http://edrv.endojournals.org/cgi/content/full/25/5/807 |journal=Endocr Rev |volume=25 |issue=5 |pages=807–30 |year=2004 |pmid=15466941 |doi=10.1210/er.2003-0026}}</ref> Пируват — промежуточный продукт в нескольких метаболических путях, но в основном он превращается в [[ацетил-КоА]] и поступает в [[цикл лимонной кислоты]]. При этом также вырабатывается некоторое количество АТФ в цикле лимонной кислоты. Происходит окисление НАДН. Это окисление продуцирует [[диоксид углерода]] как продукт жизнедеятельности. В анаэробных условиях, при гликолизе образуется [[лактат]], при участии фермента [[лактатдегидрогеназа|лактатдегидрогеназы]] происходит повторное окисление НАДH до НАД<sup>+</sup> для повторного использования в гликолизе. Альтернативный путь для расщепления глюкозы — [[пентозофосфатный путь]], при котором восстанавливается кофермент [[НАДФН]] и образуются [[пентоза|пентозы]], такие как [[рибоза]], углеводный компонент нуклеиновых кислот. |
|||
Жиры катаболизируются в процессе [[гидролиз]]а в свободные жирные кислоты и глицерин. Глицерин и жирные кислоты расщепляются в процессе [[бета-окисление|бета-окисления]] с образованием ацетил-КоА, который в свою очередь попадает в цикл лимонной кислоты. Жирные кислоты выделяют больше энергии, чем углеводы, потому что углеводы содержат больше кислорода в своей структуре. |
|||
[[Аминокислота|Аминокислоты]] либо используются для синтеза белков и других биомолекул, лиюо окисляются до [[мочевина|мочевины]] и диоксида углерода в качестве источника энергии.<ref>{{cite journal |author=Sakami W, Harrington H |title=Amino acid metabolism |journal=Annu Rev Biochem |volume=32 |issue= |pages=355–98 |year=1963 |pmid=14144484 |doi=10.1146/annurev.bi.32.070163.002035}}</ref> Окислительный путь начинается с удаления аминогруппы [[трансаминазы|трансаминазами]]. Аминогруппы попадают в [[цикл мочевины]], в результате чего преобразуются в [[кетокислоты]]. Некоторые из этих кетокислот — промежуточные продукты в цикле лимонной кислоты, например при дезаминировании [[глутамат]]а образуется [[альфа-кетоглутаровая кислота]].<ref>{{cite journal |author=Brosnan J |title=Glutamate, at the interface between amino acid and carbohydrate metabolism |url=http://jn.nutrition.org/cgi/content/full/130/4/988S |journal=J Nutr |volume=130 |issue=4S Suppl |pages=988S–90S |year=2000 |pmid=10736367}}</ref> [[Гликогенные аминокислоты]] также могут быть преобразованы в глюкозу, посредством [[глюконеогенез]]а (см. ниже).<ref>{{cite journal |author=Young V, Ajami A |title=Glutamine: the emperor or his clothes? |url=http://jn.nutrition.org/cgi/content/full/131/9/2449S |journal=J Nutr |volume=131 |issue=9 Suppl |pages=2449S–59S; discussion 2486S–7S |year=2001 |pmid=11533293}}</ref> |
|||
== Энергетические превращения == |
|||
=== Окислительное фосфорилирование === |
|||
[[Файл:ATPsynthase labelled.png|right|thumb|280px|Структура [[АТФ-синтаза|АТФ-синтазы]]. Канал протонов и вращающаяся часть показаны синим цветом, а субъединицы синтазы — красным, мембрана — серым.]] |
|||
{{further|[[Окислительное фосфорилирование]], [[Хемиосмос]] и [[Митохондрия]]}} |
|||
При окислительном фосфорилировании электроны, удалённые из пищевых молекул в путях (например, цикл лимонной кислоты), переносятся на кислород и выделяемая энергия используется для синтеза АТФ. Это происходит у [[эукариоты|эукариот]] с помощью ряда белков в мембранах митохондрий, называемые [[Дыхательная цепь переноса электронов|дыхательной цепью переноса электронов]]. У [[прокариоты|прокариот]] эти белки присутствуют во внутренней мембране клеточной стенки.<ref>{{cite journal |author=Hosler J, Ferguson-Miller S, Mills D |title=Energy transduction: proton transfer through the respiratory complexes |journal=Annu Rev Biochem |volume=75 |issue= |pages=165–87 |year=2006 |pmid=16756489 |doi=10.1146/annurev.biochem.75.062003.101730 |pmc=2659341}}</ref> Эти белки используют энергию, полученную при передаче электронов от восстановленных молекул (например НАДH) на [[кислород]], для перекачки [[протон]]ов через мембрану.<ref>{{cite journal |author=Schultz B, Chan S |title=Structures and proton-pumping strategies of mitochondrial respiratory enzymes |journal=Annu Rev Biophys Biomol Struct |volume=30 |issue= |pages=23–65 |year=2001 |pmid=11340051 |doi=10.1146/annurev.biophys.30.1.23}}</ref> |
|||
При перекачке протонов создаётся [[Диффузия|разница концентраций]] и возникает [[электрохимический градиент]].<ref>{{cite journal |author=Capaldi R, Aggeler R |title=Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor |journal=Trends Biochem Sci |volume=27 |issue=3 |pages=154–60 |year=2002 |pmid=11893513 |doi=10.1016/S0968-0004(01)02051-5}}</ref> Эта сила возвращает протоны обратно в митохондрии через основание [[АТФ-синтаза|АТФ-синтазы]]. Поток протонов заставляет вращаться кольцо из c-субъединиц фермента, в результате чего [[Активный центр ферментов|активный центр]] синтазы изменяет форму и фосфорилирует [[аденозиндифосфат]], превращая его в АТФ.<ref name=Dimroth/> |
|||
=== Энергия из неорганических соединений === |
|||
Хемолитотроф — тип обмена веществ, присутствующий у прокариот, при котором энергия образуется в результате окисления [[неорганические соединеня|неорганических соединений]]. Эти организмы могут использовать [[водород]],<ref>{{cite journal |author=Friedrich B, Schwartz E |title=Molecular biology of hydrogen utilization in aerobic chemolithotrophs |journal=Annu Rev Microbiol |volume=47 |issue= |pages=351–83 |year=1993 |pmid=8257102 |doi=10.1146/annurev.mi.47.100193.002031}}</ref> окисляя соединения [[сера|серы]] (например, [[сульфид]]ы, [[сероводород]] и [[тиосульфат]]),<ref name=Physiology1/> [[Оксид железа(II)|оксида железа(II)]]<ref>{{cite journal |author=Weber K, Achenbach L, Coates J |title=Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction |journal=Nat Rev Microbiol |volume=4 |issue=10 |pages=752–64 |year=2006 |pmid=16980937 |doi=10.1038/nrmicro1490}}</ref> или [[аммиак]]а<ref>{{cite journal |author=Jetten M, Strous M, van de Pas-Schoonen K, Schalk J, van Dongen U, van de Graaf A, Logemann S, Muyzer G, van Loosdrecht M, Kuenen J |title=The anaerobic oxidation of ammonium |journal=FEMS Microbiol Rev |volume=22 |issue=5 |pages=421–37 |year=1998 |pmid=9990725 |doi=10.1111/j.1574-6976.1998.tb00379.x}}</ref>. они получают энергию от окисления этих соединений с помощью акцепторов электронов, таких как [[кислород]] или [[нитрит]]ы.<ref>{{cite journal |author=Simon J |title=Enzymology and bioenergetics of respiratory nitrite ammonification |journal=FEMS Microbiol Rev |volume=26 |issue=3 |pages=285–309 |year=2002 |pmid=12165429 |doi=10.1111/j.1574-6976.2002.tb00616.x}}</ref> Эти микробные процессы важны в [[биогеохимический цикл|биогеохимических циклах]], таких как [[ацетогенез]], [[нитрификация]] и [[денитрификация]].<ref>{{cite journal |author=Conrad R |title=Soil microorganisms as controllers of atmospheric trace gases (H<sub>2</sub>, CO, CH<sub>4</sub>, OCS, N<sub>2</sub>O, and NO) |journal=Microbiol Rev |volume=60 |issue=4 |pages=609–40 |year=1996 |pmid=8987358 |pmc=239458 |doi= |url=http://mmbr.asm.org/cgi/pmidlookup?view=long&pmid=8987358}}</ref><ref>{{cite journal |author=Barea J, Pozo M, Azcón R, Azcón-Aguilar C |title=Microbial co-operation in the rhizosphere |url=http://jxb.oxfordjournals.org/cgi/content/full/56/417/1761 |journal=J Exp Bot |volume=56 |issue=417 |pages=1761–78 |year=2005 |pmid=15911555 |doi=10.1093/jxb/eri197}}</ref> |
|||
=== Энергия из солнечного света === |
|||
Энергия солнечного света поглощается [[растения]]ми, [[цианобактерия]]ми, [[Пурпурные бактерии|пурпурными бактериями]], [[зелёные серные бактерии|зелёными серными бактериями]] и некоторыми [[простейшие|простейшими]]. Этот процесс часто сочетается с превращением диоксида углерода в органические соединения, как часть процесса фотосинтеза (см. ниже). Системы захвата энергии и фиксации углерода могут работать отдельно у прокариот (например, у пурпурных и зелёных серных бактерий).<ref>{{cite journal |author=van der Meer M, Schouten S, Bateson M, Nübel U, Wieland A, Kühl M, de Leeuw J, Sinninghe Damsté J, Ward D |title=Diel variations in carbon metabolism by green nonsulfur-like bacteria in alkaline siliceous hot spring microbial mats from Yellowstone National Park |journal=Appl Environ Microbiol |volume=71 |issue=7 |pages=3978–86 |year=2005 |month=July |pmid=16000812 |pmc=1168979 |doi=10.1128/AEM.71.7.3978-3986.2005 |url=http://aem.asm.org/cgi/pmidlookup?view=long&pmid=16000812 }}</ref><ref>{{cite journal |author=Tichi M, Tabita F |title=Interactive control of Rhodobacter capsulatus redox-balancing systems during phototrophic metabolism |journal=J Bacteriol |volume=183 |issue=21 |pages=6344–54 |year=2001 |pmid=11591679 |pmc=100130 |doi=10.1128/JB.183.21.6344-6354.2001 |url=http://jb.asm.org/cgi/pmidlookup?view=long&pmid=11591679}}</ref> |
|||
У многих организмов поглощение солнечной энергии в принципе аналогично окислительному фосфорилированию, так как при этом энергия хранится в виде градиента концентрации протонов и движущая сила протонов приводит к синтезу АТФ.<ref name=Dimroth/> Электроны, необходимые для этой транспортной цепочки электронов, поступают от светособирающих белков, называемых центром фотосинтетических реакций или [[родопсин]]ы. В зависимости от вида [[фотосинтетические пигменты|фотосинтетических пигментов]] различают 2 типа центров реакций; в настоящее время большинство фотосинтезирующих бактерий имеют только один тип, в то время как растения и цианобактерии два.<ref>{{cite journal |author=Allen J, Williams J |title=Photosynthetic reaction centers |journal=FEBS Lett |volume=438 |issue=1–2 |pages=5–9 |year=1998 |pmid=9821949 |doi=10.1016/S0014-5793(98)01245-9}}</ref> |
|||
У растений, водорослей и цианобактерий, [[фотосистема|фотосистема II]] использует энергию света для удаления электронов из воды, освобождая кислород как продукт реакции. Электроны затем поступают в [[комплекс цитохрома b6f]], который использует свою энергию для перекачки протонов через [[Тилакоид|тилакоидную]] мембрану в [[хлоропласт]]ах.<ref name="Nelson"/> Эти протоны движутся обратно через мембрану и запускают АТФ-синтазу. Электроны затем проходят через [[фотосистема|фотосистему I]] и могут быть использованы для окисления кофермента НАДФ<sup>+</sup>, для использования в [[цикл Кальвина|цикле Кальвина]] или рециркуляции для образования ещё молекул АТФ.<ref>{{cite journal |author=Munekage Y, Hashimoto M, Miyake C, Tomizawa K, Endo T, Tasaka M, Shikanai T |title=Cyclic electron flow around photosystem I is essential for photosynthesis |journal=Nature |volume=429 |issue=6991 |pages=579–82 |year=2004 |pmid=15175756 |doi=10.1038/nature02598}}</ref> |
|||
== Анаболизм == |
|||
{{further|[[Анаболизм]]}} |
|||
'''Анаболизм''' — множество метаболических процессов, при которых энергия, выделяющаяся при катаболизме, используется для синтеза сложных молекул. В общем, сложные молекулы, входящие в состав клеточных структур, строятся шаг за шагом из небольших и простых предшественников. Анаболизм включает три основных этапа. Во-первых, производство предшественников, таких как [[аминокислоты]], [[моносахарид]]ы, [[терпеноиды]] и [[нуклеотиды]], во-вторых, преобразование их в реактивные формы с использованием энергии АТФ, и в-третьих, сборка этих предшественников в сложные молекулы, такие как [[белки]], [[полисахариды]], [[липиды]] и [[нуклеиновые кислоты]]. |
|||
Организмы различаются по тому, сколько молекул в своих клетках они могут построить для себя. [[Автотроф]]ы (например, растения) могут строить сложные органические молекулы в клетках (полисахариды и белки) из простых молекул, как [[диоксид углерода]] и вода. [[Гетеротроф]]ам необходим источник более сложных веществ, таких как моносахариды и аминокислоты, для создания этих сложных молекул. Организмы могут классифицироваться по их основным источникам энергии: фотоаутотрофы и фотогетеротрофы получают энергию из солнечного света, в то время как хемоаутотрофы и хемогетеротрофы получают энергию из неорганических реакций окисления. |
|||
=== Связывание углерода === |
|||
{{further|[[Фотосинтез]] и [[Хемосинтез]]}} |
|||
[[Файл:Plagiomnium affine laminazellen.jpeg|thumb|300px|Растительные клетки, заполненные хлоропластом (зелёного цвета), которые участвуют в фотосинтезе]] |
|||
Фотосинтез — синтез углеводов из солнечного света и [[углекислый газ|углекислого газа]] (CO<sub>2</sub>). У растений, цианобактерий и водорослей, при кислородном фотосинтезе расщепляется вода с образованием кислорода, как побочного продукта. При этом процессе используется АТФ и НАДФН, продуцируемый центром фотосинтетических реакций, как описано выше, для преобразования CO<sub>2</sub> в 3-фосфоглицерат, который затем может быть преобразован в глюкозу. Эта реакция связывания углерода осуществляется с помощью фермента [[рибулозобисфосфаткарбоксилаза]] как часть [[цикл Кальвина|цикла Кальвина]].<ref>{{cite journal |author=Miziorko H, Lorimer G |title=Ribulose-1,5-bisphosphate carboxylase-oxygenase |journal=Annu Rev Biochem |volume=52 |issue= |pages=507–35 |year=1983 |pmid=6351728 |doi=10.1146/annurev.bi.52.070183.002451}}</ref> Три типа фотосинтеза происходит в растениях, [[C3 связывание углерода]], [[C4 связывание углерода]] и [[Метаболизм кислот по типу толстянковых|CAM фотосинтез]]. Они отличаются по пути, по которому диоксид углерода проходит через цикл Кальвина; у C3 растений связывание CO<sub>2</sub> происходит непосредственно, а при С4 и CAM фотосинтезах вначале включает CO<sub>2</sub> в другие соединения, во-первых для приспособления к интенсивному потоку солнечных лучей и к сухим условиям.<ref>{{cite journal |author=Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K |title=Crassulacean acid metabolism: plastic, fantastic |url=http://jxb.oxfordjournals.org/cgi/content/full/53/369/569 |journal=J Exp Bot |volume=53 |issue=369 |pages=569–80 |year=2002 |pmid=11886877 |doi=10.1093/jexbot/53.369.569}}</ref> |
|||
У фотосинтезирующих [[прокариоты|прокариот]] механизмы связывание углерода более разнообразны. Здесь, диоксид углерода может быть фиксирован в цикле Кальвина, в [[обратный цикл Кребса|обратном цикле Кребса]],<ref>{{cite journal |author=Hügler M, Wirsen C, Fuchs G, Taylor C, Sievert S |title=Evidence for autotrophic CO<sub>2</sub> fixation via the reductive tricarboxylic acid cycle by members of the epsilon subdivision of proteobacteria |journal=J Bacteriol |volume=187 |issue=9 |pages=3020–7 |year=2005 |month=May |pmid=15838028 |pmc=1082812 |doi=10.1128/JB.187.9.3020-3027.2005 |url=http://jb.asm.org/cgi/pmidlookup?view=long&pmid=15838028}}</ref> или в реакциях карбоксилирования ацетил-КоА.<ref>{{cite journal |author=Strauss G, Fuchs G |title=Enzymes of a novel autotrophic CO<sub>2</sub> fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle |journal=Eur J Biochem |volume=215 |issue=3 |pages=633–43 |year=1993 |pmid=8354269 |doi=10.1111/j.1432-1033.1993.tb18074.x}}</ref><ref>{{cite journal |author=Wood H |title=Life with CO or CO<sub>2</sub> and H<sub>2</sub> as a source of carbon and energy |url=http://www.fasebj.org/cgi/reprint/5/2/156 |journal=FASEB J |volume=5 |issue=2 |pages=156–63 |year=1991 |pmid=1900793}}</ref> Прокариотические хемоаутотрофы также связывают CO<sub>2</sub> через цикл Кальвина, но используют энергию из неорганических соединений для проведения реакции.<ref>{{cite journal |author=Shively J, van Keulen G, Meijer W |title=Something from almost nothing: carbon dioxide fixation in chemoautotrophs |journal=Annu Rev Microbiol |volume=52 |issue= |pages=191–230 |year=1998 |pmid=9891798 |doi=10.1146/annurev.micro.52.1.191}}</ref> |
|||
=== Углеводы и гликаны === |
|||
{{further|[[Глюконеогенез]] и [[Гликозилирование]]}} |
|||
В углеводном анаболизме, простые органические кислоты могут быть преобразованы в [[моносахарид]]ы, такие как [[глюкоза]], и затем использованы для сборки [[полисахарид]]ов, таких как [[крахмал]]. Образование глюкозы из соединений, как [[пируват]], [[лактат]], [[глицерин]], [[3-фосфоглицерат]] и [[аминокислоты|аминокислот]] называется [[глюконеогенез]]. Глюконеогенез преобразует пируват в [[глюкозо-6-фосфат]] через ряд промежуточных соединений, многие из которых образуются и при [[гликолиз]]е.<ref name=Bouche/> Однако этот путь не просто [[гликолиз]] в обратном направлении, а несколько этапов реакций, катализируемых негликолитическими ферментами. Это позволяет процессам образования и распада глюкозы регулироваться отдельно.<ref>{{cite journal |author=Boiteux A, Hess B |title=Design of glycolysis |journal=Philos Trans R Soc Lond B Biol Sci |volume=293 |issue=1063 |pages=5–22 |year=1981 |pmid=6115423 |doi=10.1098/rstb.1981.0056}}</ref><ref>{{cite journal |author=Pilkis S, el-Maghrabi M, Claus T |title=Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics |journal=Diabetes Care |volume=13 |issue=6 |pages=582–99 |year=1990 |pmid=2162755 |doi=10.2337/diacare.13.6.582}}</ref> |
|||
Хотя жир — распространённый способ хранения энергии. Однако у [[позвоночные|позвоночных]], таких как люди, [[жирные кислоты]] в этих запасах не могут быть преобразованы в глюкозу через [[глюконеогенез]], поскольку эти организмы не могут превращать ацетил-КоА в [[пируват]] и не имеют необходимых ферментативных механизмов.<ref name=Ensign>{{cite journal |author=Ensign S |title=Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation |journal=Mol Microbiol |volume=61 |issue=2 |pages=274–6 |year=2006 |pmid=16856935 |doi=10.1111/j.1365-2958.2006.05247.x}}</ref> В результате длительного голодания, позвоночные начинают произодить [[кетоновые тела]] из жирных кислот, чтобы заменить глюкозу в тканях, таких как мозг, который не может метаболизировать жирные кислоты.<ref>{{cite journal |author=Finn P, Dice J |title=Proteolytic and lipolytic responses to starvation |journal=Nutrition |volume=22 |issue=7–8 |pages=830–44 |year=2006 |pmid=16815497 |doi=10.1016/j.nut.2006.04.008}}</ref> У других организмов, таких как растения и бактерии, эта метаболическая проблема решается использованием [[глиоксилатный цикл|глиоксилатного цикла]], который обходит этап [[декарбоксилирование|декарбоксилирования]] в цикле лимонной кислоты и позволяет превращать ацетил-КоА в [[оксалоацетат]], где она может быть использована для образования глюкозы.<ref name=Ensign/><ref name=Kornberg>{{cite journal |author=Kornberg H, Krebs H |title=Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle |journal=Nature |volume=179 |issue=4568 |pages=988–91 |year=1957 |pmid=13430766 |doi=10.1038/179988a0}}</ref> |
|||
Полисахариды могут выполнять структурные и метаболические функции или превращаться в липиды и белки при участии ферментов [[олигосахаридтрансферазы|олигосахаридтрансфераз]].<ref>{{cite journal |author=Opdenakker G, Rudd P, Ponting C, Dwek R |title=Concepts and principles of glycobiology |url=http://www.fasebj.org/cgi/reprint/7/14/1330 |journal=FASEB J |volume=7 |issue=14 |pages=1330–7 |year=1993 |pmid=8224606}}</ref><ref>{{cite journal |author=McConville M, Menon A |title=Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review) |journal=Mol Membr Biol |volume=17 |issue=1 |pages=1–16 |year=2000 |pmid=10824734 |doi=10.1080/096876800294443}}</ref> |
|||
=== Жирные кислоты, изопреноиды и стероиды === |
|||
{{further|[[Стероиды]]}} |
|||
[[Файл:Sterol synthesis.svg|thumb|right|350px|Упрощённая версия механизма синтеза стероидов из изопентил пирофосфата (IPP), диметилаллил пирофосфата (DMAPP), геранил пирофосфата (GPP) и [[сквален]]а. Некоторые промежуточные продукты пропущены для ясности.]] |
|||
Жирные кислоты образуются [[Синтаза жирных кислот|синтазами жирных кислот]], которые полимеризируют и восстанавливают молекулы ацетил-КоА. Ацильные цепочки в жирных кислотах удлиняются в цикле реакций, где присоединяют ацетил группу, восстанавливают её до алкоголя, дегидрируют до [[алкен]]овой группы, а затем снова восстанавливают до [[алкан]]овой группы. Ферменты биосинтеза жирных кислот делятся на две группы: у животных и грибов, все эти реакции синтеза жирных кислот осуществляются одним многофункциональным белком I типа,<ref>{{cite journal |author=Chirala S, Wakil S |title=Structure and function of animal fatty acid synthase |journal=Lipids |volume=39 |issue=11 |pages=1045–53 |year=2004 |pmid=15726818 |doi=10.1007/s11745-004-1329-9}}</ref> в то время как в растительных [[пластиды|пластидах]] и у бактерий отдельные ферменты II типа выполняют каждый этап в этой цепи реакций.<ref>{{cite journal |author=White S, Zheng J, Zhang Y |title=The structural biology of type II fatty acid biosynthesis |journal=Annu Rev Biochem |volume=74 |issue= |pages=791–831 |year=2005 |pmid=15952903 |doi=10.1146/annurev.biochem.74.082803.133524}}</ref><ref>{{cite journal |author=Ohlrogge J, Jaworski J |title=Regulation of fatty acid synthesis |journal=Annu Rev Plant Physiol Plant Mol Biol |volume=48 |issue= |pages=109–136 |year=1997 |pmid=15012259 |doi=10.1146/annurev.arplant.48.1.109}}</ref> |
|||
[[Терпены]] и [[терпеноиды]] — большой класс липидов, который включают [[каротиноиды]] и образуют самый многочисленный класс растительных [[натуральные продукты|натуральных продуктов]].<ref>{{cite journal |author=Dubey V, Bhalla R, Luthra R |title=An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants |url=http://www.ias.ac.in/jbiosci/sep2003/637.pdf |format=PDF|journal=J Biosci |volume=28 |issue=5 |pages=637–46 |year=2003 |pmid=14517367 |doi=10.1007/BF02703339}}</ref> Эти вещества, образуемые при сборке и преобразовании молекул [[изопрен]]а, получаются из реактивных предшественников изопентил пирофосфата и диметилаллил пирофосфата.<ref name=Kuzuyama>{{cite journal |author=Kuzuyama T, Seto H |title=Diversity of the biosynthesis of the isoprene units |journal=Nat Prod Rep |volume=20 |issue=2 |pages=171–83 |year=2003 |pmid=12735695 |doi=10.1039/b109860h}}</ref> Эти предшественники могут быть образовываться в разных путях. У животных и архей, [[мевалонатный путь]] производит эти соединения из ацетил-КоА,<ref>{{cite journal |author=Grochowski L, Xu H, White R |title=Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate |journal=J Bacteriol |volume=188 |issue=9 |pages=3192–8 |year=2006 |month=May |pmid=16621811 |pmc=1447442 |doi=10.1128/JB.188.9.3192-3198.2006 |url=http://jb.asm.org/cgi/pmidlookup?view=long&pmid=16621811}}</ref> в то время как у растений и бактерий [[не-мевалонатный путь]] использует пируват и [[глицеральдегид-3-фосфат]] в качестве субстратов.<ref name=Kuzuyama/><ref>{{cite journal |author=Lichtenthaler H |title=The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants |journal=Annu Rev Plant Physiol Plant Mol Biol |volume=50 |issue= |pages=47–65 |year=1999 |pmid=15012203 |doi=10.1146/annurev.arplant.50.1.47}}</ref> Эти предшественники используются в биосинтезе стероидов. Молекулы изопрена объединяются и образуют [[сквален]]ы, которые в свою очередь складываются и формируют кольца с образованием [[ланостерол]]а.<ref name=Schroepfer>{{cite journal |author=Schroepfer G |title=Sterol biosynthesis |journal=Annu Rev Biochem |volume=50 |issue= |pages=585–621 |year=1981 |pmid=7023367 |doi=10.1146/annurev.bi.50.070181.003101}}</ref> Затем ланостерол может быть преобразован в другие стероиды, такие как [[холестерин]] и [[эргостерин]].<ref name=Schroepfer/><ref>{{cite journal |author=Lees N, Skaggs B, Kirsch D, Bard M |title=Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review |journal=Lipids |volume=30 |issue=3 |pages=221–6 |year=1995 |pmid=7791529 |doi=10.1007/BF02537824}}</ref> |
|||
=== Белки === |
|||
{{further|[[Биосинтез белка]]}} |
|||
Организмы различаются по способности к синтезу 20 общих аминокислот. Большинство бактерий и растений могут синтезировать все 20, но млекопитающих способны синтезировать лишь 11 заменимых аминокислот.<ref name=Nelson/> Таким образом, 9 [[Незаменимые аминокислоты|незаменимых аминокислот]] должны быть получены из пищи. Все аминокислоты синтезируются из промежуточных продуктов гликолиза, цикла лимонной кислоты или пентозофосфатного пути. Азот поступает из [[глутамат]]а и [[глутамин]]а. Синтез аминокислот зависит от образования соответствующей альфа-кетокислоты, которая затем трансаминируется с образованием аминокислоты.<ref>{{cite book | last = Guyton | first = Arthur C. | coauthors = John E. Hall | title = Textbook of Medical Physiology | publisher = Elsevier | year = 2006 | location = Philadelphia | pages = 855–6 | isbn = 0-7216-0240-1}}</ref> |
|||
Аминокислоты образуют белки, объединяясь в цепочку [[Пептидная связь|пептидными связями]]. Каждый белок имеет уникальную последовательность аминокислотных остатков([[белок|первичная структура белка]]). Подобно тому, как буквы алфавита могут комбинироваться с образованием почти бесконечных вариаций слов, аминокислоты могут связываться в той или иной последовательности для формирования огромного разнообразия белков. Аминокислоты прикрепляются к молекуле [[тРНК]] через [[Сложные эфиры|эфирные]] связи. Это предшественники аминоацил-тРНК, которые участвуют в АТФ-зависимой реакции, которая регулируется [[Аминоацил-тРНК-синтетаза|аминоацил-тРНК-синтетазой]].<ref>{{cite journal | author = Ibba M, Söll D | title = The renaissance of aminoacyl-tRNA synthesis | url=http://www.molcells.org/home/journal/include/downloadPdf.asp?articleuid={A158E3B4-2423-4806-9A30-4B93CDA76DA0} | journal = EMBO Rep | volume = 2 | issue = 5 | pages = 382–7 | year = 2001 | pmid = 11375928}}</ref> Эта аминоацил-тРНК — субстрат для [[рибосома|рибосомы]], которая объединяет аминокислоты в длинные цепочки белка, используя информацию о последовательности из [[мРНК]].<ref>{{cite journal |author=Lengyel P, Söll D |title=Mechanism of protein biosynthesis |pmc=378322 |journal=Bacteriol Rev |volume=33 |issue=2 |pages=264–301 |year=1969 |pmid=4896351}}</ref> |
|||
=== Синтез и утилизация нуклеотидов === |
|||
{{further|[[Пурин]]}} |
|||
Нуклеотиды образуются из аминокислот, диоксид углерода и [[Муравьиная кислота|муравьиной кислоты]] в цепи реакций, которой необходимо большое количество энергии.<ref name=Rudolph>{{cite journal |author=Rudolph F |title=The biochemistry and physiology of nucleotides |journal=J Nutr |volume=124 |issue=1 Suppl |pages=124S–127S |year=1994 |pmid=8283301}} {{cite journal |author=Zrenner R, Stitt M, Sonnewald U, Boldt R |title=Pyrimidine and purine biosynthesis and degradation in plants |journal=Annu Rev Plant Biol |volume=57 |issue= |pages=805–36 |year=2006 |pmid=16669783 |doi=10.1146/annurev.arplant.57.032905.105421}}</ref> Таким образом, большинство организмов имеет эффективные системы для утилизации предшественников нуклеотидов.<ref name=Rudolph/><ref>{{cite journal |author=Stasolla C, Katahira R, Thorpe T, Ashihara H |title=Purine and pyrimidine nucleotide metabolism in higher plants |journal=J Plant Physiol |volume=160 |issue=11 |pages=1271–95 |year=2003 |pmid=14658380 |doi=10.1078/0176-1617-01169}}</ref> [[Пурин]]ы синтезируются как [[нуклеозид]]ы (в основном связанные с [[рибоза|рибозой]]). [[Аденин]] и [[гуанин]] образуются из предшественников нуклеозида [[инозин]] монофосфата, который синтезируется с использованием атомов из аминокислот [[глицин]]а, [[глутамин]]а и [[аспарагиновая кислота|аспарагиновой кислоты]], также как формат, перенесённый из [[кофермент]]а [[тетрагидрофолат]]а. [[Пиримидин]]ы синтезируются из основы [[оротат]]а, которая образуется из глутамина и аспартата.<ref>{{cite journal |author=Smith J |title=Enzymes of nucleotide synthesis |journal=Curr Opin Struct Biol |volume=5 |issue=6 |pages=752–7 |year=1995 |pmid=8749362 |doi=10.1016/0959-440X(95)80007-7}}</ref> |
|||
== См. также == |
== См. также == |
||
| Строка 48: | Строка 174: | ||
== Примечания == |
== Примечания == |
||
{{Reflist|2}} |
|||
<references /> |
|||
== Ссылки == |
== Ссылки == |
||
Версия от 09:44, 23 августа 2010

Метаболи́зм (от греч. μεταβολή, «превращение, изменение»), обмен веществ — набор химических реакций, которые возникают в живом организме для поддержания жизни. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды. Метаболизм обычно делится на 2 категории. Катаболизм разрушает сложные органические вещества до более простых, например для накопления энергии при клеточном дыхании. Анаболизм использует энергию для построения элементов клетки таких, как белки и нуклеиновые кислоты.
Химические реакции обмена веществ происходят в метаболических путях, где одно химическое вещество превращается через серию реакций в другое химическое вещество при участии определённых ферментов. Ферменты имеют важное значение в метаболизме, поскольку они позволяют организмам управлять необходимыми реакцями, которые требуют энергии и не протекают самостоятельно. Ферменты действуют как катализаторы и позволяют этим реакциям протекать быстро и эффективно. Ферменты также позволяют регулировать метаболические пути в ответ на изменения среды клетки или сигналы от других клеток.
Обмен веществ организма определяет какие вещества питательные, а какие ядовитые. Например, некоторые прокариоты используют сероводород как питательное вещество, однако этот газ ядовит для животных.[1] Скорость обмена веществ также влияет на количество пищи, необходимой для организма.
Отличительная особенность метаболизма — схожесть основных метаболических путей и компонентов даже между очень разными видами.[2] Например, ряд карбоновых кислот, известные как посредники в цикле трикарбоновых кислот присутствуют во всех организмах, начиная от одноклеточных бактерий Escherichia coli и заканчивая большим количеством многоклеточных организмов, таких как слоны.[3] Эти поразительные сходства в обмене веществ вероятно связаны с высокой эффективностью метаболических путей, а также с их ранним появлением в истории эволюции.[4][5]
Основные моменты биохимии

Большинство структурных элементов, входящих в состав животных, растений и микробов, образованы тремя классами молекул: аминокислотами, углеводами и липидами (часто называемые жирами). Так как эти молекулы имеют важное значение для жизни, метаболические реакции сосредоточены на создании этих молекул при строительстве клеток и тканей или разрушении их с целью использования в качестве источника энергии. Многие важные биохимические реакции объединяются вместе для создания полимеров таких как ДНК и белки. Эти макромолекулы очень важны.
| Тип молекулы | Название формы мономера | Название формы полимера | Примеры форм полимера |
|---|---|---|---|
| Аминокислоты | Аминокислоты | Белки (синоним: полипептиды) | Волоконные и глобулярные белки |
| Углеводы | Моносахариды | Полисахариды | Крахмал, гликоген и целлюлоза |
| Нуклеиновые кислоты | Нуклеотиды | Полинуклеотиды | ДНК и РНК |
Аминокислоты и белки
Белки состоят из аминокислот, выстроенных в линейную цепочку и соединённых пептидными связями. Многие белки — ферменты, которые катализируют химические реакции обмена веществ. Другие белки выполняют структурную или механическую функцию (например, образуют цитоскелет).[6] Белки также играют важную роль в сигнальной системе клеток, иммунных реакциях, агрегации клеток, активном транспорте через мембраны и клеточном цикле.[7]
Липиды
Липиды — наиболее разнообразная группа биохимических веществ. Они используются для построения биологических мембран таких, как клеточная мембрана, или как источник энергии.[7] Липиды, как правило, гидрофобные или амфифильные биологические молекулы, которые растворяются в органических растворителях таких, как бензол или хлороформ.[8] Жиры — большая группа соединений, которые содержат жирные кислоты и глицерин; молекула глицерина, присоединившая к 3 жирным кислотам сложные эфиры называется триглицерид.[9] Существует несколько вариаций этой базовой структуры (например, сфингозин в сфинголипидах, гидрофильные группы фосфатов в фосфолипидах. Стероиды, например холестерол, — ещё один большой класс липидов, которые синтезируются в клетках.[10]
Углеводы

Углеводы — альдегиды или кетоны с множеством гидроксильных групп, которые могут существовать в виде прямой цепочки или кольца. Углеводы — наиболее распространённые биологические молекулы. Они выполняют множество функций: хранение и транспортировка энергии (крахмал, гликоген), структурная (целлюлоза растений, хитин у животных).[7] Основная углеводная единица называется моносахарид и включает галактозу, фруктозу и самое главное глюкозу. Моносахариды могут объединяться для образования разнообразных полисахаридов.[11]
Нуклеотиды
Полимеры ДНК и РНК — длинные цепочки нуклеотидов. Эти молекулы имеют важное значение для хранения и использования генетической информации через процессы транскрипции и биосинтеза белка.[7] Эта информация защищена механизмами репарации ДНК и распространяется через репликацию ДНК. Некоторые вирусы имеют геном РНК. Например, ВИЧ, который использует обратную транскрипцию для создания ДНК-шаблона из своего вирусного генома РНК.[12] РНК в рибозимах таких, как сплайсосомы и рибосомы схожи с ферментами, которые катализируют химические реакции. Нуклеозиды образуются при присоединении азотистых оснований к рибозе сахара. Эти основания — гетероциклические кольца, содержащие азот, классифицируются как пурины или пиримидины. Нуклеотиды также выступают в качестве коферментов в реакциях перемещения метаболических групп.[13]
Коферменты

Метаболизм включает широкий спектр химических реакций, но большинство подпадают под несколько основных типов реакций, которые связаны с перемещением функциональных групп.[14] Такие химически процессы позволяют клеткам использовать ряд метаболических посредников для транспортировки химических групп между различными реакциями.[13] Эту группу переносчиков называют коферментами. Каждый класс реакций с переносом групп осуществляется отдельным коферментом и рядом ферментов.[15]
Аденозинтрифосфат (АТФ) — один из центральных коферментов, универсальный источник энергии клеток. Этот нуклеотид используется для передачи химической энергии между различными химическими реакциями. В клетках существует небольшое количество АТФ, но она постоянно регенерируется. Человеческий организм способен за сутки израсходовать массу АТФ, равной массе собственного тела.[15] АТФ выступает в качестве связующего звена между катаболизмом и анаболизмом: при катаболических реакциях образуется АТФ, а при анаболических — она потребляется. АТФ также выступает в качестве носителя фосфатных групп в реакциях фосфорилирования.
Витамин — органическое соединение, которое необходимо в небольших количествах и не синтезируется в клетках. В питании человека, большинство витаминов функционируют как коферменты после преобразования. Например, все водорастворимые витамины фосфорилируются или соединяются с нуклеотидами, когда они используются в клетках.[16] Никотинамидадениндинуклеотид (НАДН), производная витамина B3 (ниацин), — важный кофермент, который выступает в качестве акцептора водорода. Сотни отдельных видов дегидрогеназ удаляют электроны из своих субстратов и окисляют НАД+ до НАДН. Эта окисленная форма кофермента выступает в качестве субстрата для различных редуктаз в клетке.[17] Никотинамидадениндинуклеотид существует в двух связанных формах в клетке: НАДН и НАДФН. НАД+/НАДН форма — важна больше в катаболических реакций, а НАДФ+/НАДФН используется в анаболических реакциях.

Минералы и кофакторы
Неорганические элементы играют важнейшую роль в обмене веществ. Около 99 % массы млекопитающего состоит из углерода, азота, кальция, натрия, хлора, калия, водорода, фосфора, кислорода и серы.[18] Органические соединения (белки, жиры и углеводы) содержат большое количество углерода и азота.[18]
Множество неорганических элементов выступают в качестве ионных электролитов. Наиболее важны для организма ионы натрия, калия, кальция, магния, хлоридов, фосфатов и органических ионов гидрокарбоната. Баланс этих ионов внутри и вне клетки определяет осмотическое давление и рН.[19] Ионы также важны для нервов и мышц. Потенциал действия в этих тканях возникает при обмене электролитами между внеклеточной жидкостью и цитозолем.[20] Электролиты входят и выходят из клетки через белки в клеточной мембране. Эти белки называют ионными каналами. Например, мышечное сокращение зависит от движения кальция, натрия и калия через ионные каналы в клеточной мембране и Т-трубочки.[21]
Переходные металлы, как правило, присутствует в организме как микроэлементы; цинк и железо наиболее распространённые элементы.[22][23] Эти металлы используются некоторыми белками (например, кофакторы) и имеют важное значение для активности ферментов, таких как каталаза и белков-переносчиков кислорода (гемоглобин).[24] Эти кофакторы тесно связаны со специфическим белком, хотя ферментативные кофакторы могут быть изменены в процессе катализа; кофакторы всегда возвращаются к своему первоначальному состоянию после катализа. Организм получает металлы-микроэлементы из специфических переносчиков (например, ферритин или металлотионеин), когда они не используются.[25][26]
Катаболизм
Катаболизм — множество метаболических процессов, при которых расщепляются и окисляются крупные пищевые молекулы. Цель катаболических реакций — получение энергии и компонентов, необходимых для анаболических реакций. Классификация организмов может быть основана на источнике получения энергии и углерода, как показано в таблице ниже. Органические молекулы используются в качестве источника энергии в органотрофами, литотрофы используют неорганические субстраты, а фототрофы поглощают солнечный свет как источник химической потенциальной энергии. Однако, все эти различные формы обмена веществ зависят от окислительно-восстановительных реакций, которые связаны с передачей электронов от восстановленных доноров молекул, таких как органические молекулы, вода, аммиак, сероводород, на акцепторные молекулы, такие как кислород, нитраты или сульфат.[27] У животных эти реакции сопряжены с расщеплением сложных органических молекул до более простых, таких как двуокись углерода и воду. В фотосинтезирующих организмах, таких как растения и цианобактерии, эти реакции переноса электрона не высвобождают энергию, но они используются как способ хранения энергии, поглощаемой из солнечного света.[7]
- Классификация организмов на основе их метаболизма
| Источник энергии | Солнечный свет | фото- | -троф | ||
| Первичные молекулы | хемо- | ||||
| Донор электронов | Органическое соединение | органо- | |||
| Неорганическое соединение | лито- | ||||
| Источник углерода | Органическое соединение | гетеро- | |||
| Неорганическое соединение | ауто- | ||||
Процесс катаболических реакций у животных может быть разделён на три основных этапа. Во-первых, крупные органические молекулы, такие как белки, полисахариды и липиды расщепляются до более мелких компонентов вне клеток. Далее, эти небольшие молекулы усваиваются клетками и превращается в ещё более мелкие молекулы, как правило, ацетил-коэнзим А (ацетил-КоА), который производит немного энергии. Наконец, ацетил группа коэнзима А окисляется до воды и углекислого газа в цикле лимонной кислоты и дыхательной цепи переноса электронов, высвобождая энергию, которая хранится за счёт окисления кофермента НАД+ до НАДН.
Пищеварение
Макромолекулы, такие как крахмал, целлюлоза или белки, должны расщепляться до более мелких единиц прежде, чем они могут быть использованы в клеточном обмене веществ. Несколько классов ферментов переваривают эти полимеры. К таким пищеварительным ферментам относят протеазы, которые расщепляют белки до аминокислот, а также гликозидазы, которые расщепляют полисахариды до моносахаридов.
Микробы просто выделяют пищеварительные ферменты в пространство вокруг себя,[28][29] в то время как животные выделяют эти ферменты только из специализированных железистых клеток.[30] Аминокислоты и сахара, обработанные внеклеточными ферментами, затем поступают в клетки с помощью активного транспорта.[31][32]

Энергия из органических соединений
{{further|Клеточное дыхание, Брожение, Липолиз
Углеводный катаболизм — расщепление углеводов до более мелких частиц. Углеводы, как правило, поглощаются клетками после их преобразования в моносахариды.[33] Попав внутрь, сахара (например, глюкоза и фруктоза) в процессе гликолиза превращаются в пируват и вырабатывается некоторое количество АТФ.[34] Пируват — промежуточный продукт в нескольких метаболических путях, но в основном он превращается в ацетил-КоА и поступает в цикл лимонной кислоты. При этом также вырабатывается некоторое количество АТФ в цикле лимонной кислоты. Происходит окисление НАДН. Это окисление продуцирует диоксид углерода как продукт жизнедеятельности. В анаэробных условиях, при гликолизе образуется лактат, при участии фермента лактатдегидрогеназы происходит повторное окисление НАДH до НАД+ для повторного использования в гликолизе. Альтернативный путь для расщепления глюкозы — пентозофосфатный путь, при котором восстанавливается кофермент НАДФН и образуются пентозы, такие как рибоза, углеводный компонент нуклеиновых кислот.
Жиры катаболизируются в процессе гидролиза в свободные жирные кислоты и глицерин. Глицерин и жирные кислоты расщепляются в процессе бета-окисления с образованием ацетил-КоА, который в свою очередь попадает в цикл лимонной кислоты. Жирные кислоты выделяют больше энергии, чем углеводы, потому что углеводы содержат больше кислорода в своей структуре.
Аминокислоты либо используются для синтеза белков и других биомолекул, лиюо окисляются до мочевины и диоксида углерода в качестве источника энергии.[35] Окислительный путь начинается с удаления аминогруппы трансаминазами. Аминогруппы попадают в цикл мочевины, в результате чего преобразуются в кетокислоты. Некоторые из этих кетокислот — промежуточные продукты в цикле лимонной кислоты, например при дезаминировании глутамата образуется альфа-кетоглутаровая кислота.[36] Гликогенные аминокислоты также могут быть преобразованы в глюкозу, посредством глюконеогенеза (см. ниже).[37]
Энергетические превращения
Окислительное фосфорилирование
При окислительном фосфорилировании электроны, удалённые из пищевых молекул в путях (например, цикл лимонной кислоты), переносятся на кислород и выделяемая энергия используется для синтеза АТФ. Это происходит у эукариот с помощью ряда белков в мембранах митохондрий, называемые дыхательной цепью переноса электронов. У прокариот эти белки присутствуют во внутренней мембране клеточной стенки.[38] Эти белки используют энергию, полученную при передаче электронов от восстановленных молекул (например НАДH) на кислород, для перекачки протонов через мембрану.[39]
При перекачке протонов создаётся разница концентраций и возникает электрохимический градиент.[40] Эта сила возвращает протоны обратно в митохондрии через основание АТФ-синтазы. Поток протонов заставляет вращаться кольцо из c-субъединиц фермента, в результате чего активный центр синтазы изменяет форму и фосфорилирует аденозиндифосфат, превращая его в АТФ.[15]
Энергия из неорганических соединений
Хемолитотроф — тип обмена веществ, присутствующий у прокариот, при котором энергия образуется в результате окисления неорганических соединений. Эти организмы могут использовать водород,[41] окисляя соединения серы (например, сульфиды, сероводород и тиосульфат),[1] оксида железа(II)[42] или аммиака[43]. они получают энергию от окисления этих соединений с помощью акцепторов электронов, таких как кислород или нитриты.[44] Эти микробные процессы важны в биогеохимических циклах, таких как ацетогенез, нитрификация и денитрификация.[45][46]
Энергия из солнечного света
Энергия солнечного света поглощается растениями, цианобактериями, пурпурными бактериями, зелёными серными бактериями и некоторыми простейшими. Этот процесс часто сочетается с превращением диоксида углерода в органические соединения, как часть процесса фотосинтеза (см. ниже). Системы захвата энергии и фиксации углерода могут работать отдельно у прокариот (например, у пурпурных и зелёных серных бактерий).[47][48]
У многих организмов поглощение солнечной энергии в принципе аналогично окислительному фосфорилированию, так как при этом энергия хранится в виде градиента концентрации протонов и движущая сила протонов приводит к синтезу АТФ.[15] Электроны, необходимые для этой транспортной цепочки электронов, поступают от светособирающих белков, называемых центром фотосинтетических реакций или родопсины. В зависимости от вида фотосинтетических пигментов различают 2 типа центров реакций; в настоящее время большинство фотосинтезирующих бактерий имеют только один тип, в то время как растения и цианобактерии два.[49]
У растений, водорослей и цианобактерий, фотосистема II использует энергию света для удаления электронов из воды, освобождая кислород как продукт реакции. Электроны затем поступают в комплекс цитохрома b6f, который использует свою энергию для перекачки протонов через тилакоидную мембрану в хлоропластах.[7] Эти протоны движутся обратно через мембрану и запускают АТФ-синтазу. Электроны затем проходят через фотосистему I и могут быть использованы для окисления кофермента НАДФ+, для использования в цикле Кальвина или рециркуляции для образования ещё молекул АТФ.[50]
Анаболизм
Анаболизм — множество метаболических процессов, при которых энергия, выделяющаяся при катаболизме, используется для синтеза сложных молекул. В общем, сложные молекулы, входящие в состав клеточных структур, строятся шаг за шагом из небольших и простых предшественников. Анаболизм включает три основных этапа. Во-первых, производство предшественников, таких как аминокислоты, моносахариды, терпеноиды и нуклеотиды, во-вторых, преобразование их в реактивные формы с использованием энергии АТФ, и в-третьих, сборка этих предшественников в сложные молекулы, такие как белки, полисахариды, липиды и нуклеиновые кислоты. Организмы различаются по тому, сколько молекул в своих клетках они могут построить для себя. Автотрофы (например, растения) могут строить сложные органические молекулы в клетках (полисахариды и белки) из простых молекул, как диоксид углерода и вода. Гетеротрофам необходим источник более сложных веществ, таких как моносахариды и аминокислоты, для создания этих сложных молекул. Организмы могут классифицироваться по их основным источникам энергии: фотоаутотрофы и фотогетеротрофы получают энергию из солнечного света, в то время как хемоаутотрофы и хемогетеротрофы получают энергию из неорганических реакций окисления.
Связывание углерода
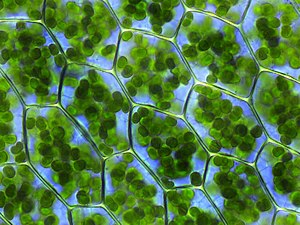
Фотосинтез — синтез углеводов из солнечного света и углекислого газа (CO2). У растений, цианобактерий и водорослей, при кислородном фотосинтезе расщепляется вода с образованием кислорода, как побочного продукта. При этом процессе используется АТФ и НАДФН, продуцируемый центром фотосинтетических реакций, как описано выше, для преобразования CO2 в 3-фосфоглицерат, который затем может быть преобразован в глюкозу. Эта реакция связывания углерода осуществляется с помощью фермента рибулозобисфосфаткарбоксилаза как часть цикла Кальвина.[51] Три типа фотосинтеза происходит в растениях, C3 связывание углерода, C4 связывание углерода и CAM фотосинтез. Они отличаются по пути, по которому диоксид углерода проходит через цикл Кальвина; у C3 растений связывание CO2 происходит непосредственно, а при С4 и CAM фотосинтезах вначале включает CO2 в другие соединения, во-первых для приспособления к интенсивному потоку солнечных лучей и к сухим условиям.[52]
У фотосинтезирующих прокариот механизмы связывание углерода более разнообразны. Здесь, диоксид углерода может быть фиксирован в цикле Кальвина, в обратном цикле Кребса,[53] или в реакциях карбоксилирования ацетил-КоА.[54][55] Прокариотические хемоаутотрофы также связывают CO2 через цикл Кальвина, но используют энергию из неорганических соединений для проведения реакции.[56]
Углеводы и гликаны
В углеводном анаболизме, простые органические кислоты могут быть преобразованы в моносахариды, такие как глюкоза, и затем использованы для сборки полисахаридов, таких как крахмал. Образование глюкозы из соединений, как пируват, лактат, глицерин, 3-фосфоглицерат и аминокислот называется глюконеогенез. Глюконеогенез преобразует пируват в глюкозо-6-фосфат через ряд промежуточных соединений, многие из которых образуются и при гликолизе.[34] Однако этот путь не просто гликолиз в обратном направлении, а несколько этапов реакций, катализируемых негликолитическими ферментами. Это позволяет процессам образования и распада глюкозы регулироваться отдельно.[57][58]
Хотя жир — распространённый способ хранения энергии. Однако у позвоночных, таких как люди, жирные кислоты в этих запасах не могут быть преобразованы в глюкозу через глюконеогенез, поскольку эти организмы не могут превращать ацетил-КоА в пируват и не имеют необходимых ферментативных механизмов.[59] В результате длительного голодания, позвоночные начинают произодить кетоновые тела из жирных кислот, чтобы заменить глюкозу в тканях, таких как мозг, который не может метаболизировать жирные кислоты.[60] У других организмов, таких как растения и бактерии, эта метаболическая проблема решается использованием глиоксилатного цикла, который обходит этап декарбоксилирования в цикле лимонной кислоты и позволяет превращать ацетил-КоА в оксалоацетат, где она может быть использована для образования глюкозы.[59][61]
Полисахариды могут выполнять структурные и метаболические функции или превращаться в липиды и белки при участии ферментов олигосахаридтрансфераз.[62][63]
Жирные кислоты, изопреноиды и стероиды

Жирные кислоты образуются синтазами жирных кислот, которые полимеризируют и восстанавливают молекулы ацетил-КоА. Ацильные цепочки в жирных кислотах удлиняются в цикле реакций, где присоединяют ацетил группу, восстанавливают её до алкоголя, дегидрируют до алкеновой группы, а затем снова восстанавливают до алкановой группы. Ферменты биосинтеза жирных кислот делятся на две группы: у животных и грибов, все эти реакции синтеза жирных кислот осуществляются одним многофункциональным белком I типа,[64] в то время как в растительных пластидах и у бактерий отдельные ферменты II типа выполняют каждый этап в этой цепи реакций.[65][66]
Терпены и терпеноиды — большой класс липидов, который включают каротиноиды и образуют самый многочисленный класс растительных натуральных продуктов.[67] Эти вещества, образуемые при сборке и преобразовании молекул изопрена, получаются из реактивных предшественников изопентил пирофосфата и диметилаллил пирофосфата.[68] Эти предшественники могут быть образовываться в разных путях. У животных и архей, мевалонатный путь производит эти соединения из ацетил-КоА,[69] в то время как у растений и бактерий не-мевалонатный путь использует пируват и глицеральдегид-3-фосфат в качестве субстратов.[68][70] Эти предшественники используются в биосинтезе стероидов. Молекулы изопрена объединяются и образуют сквалены, которые в свою очередь складываются и формируют кольца с образованием ланостерола.[71] Затем ланостерол может быть преобразован в другие стероиды, такие как холестерин и эргостерин.[71][72]
Белки
Организмы различаются по способности к синтезу 20 общих аминокислот. Большинство бактерий и растений могут синтезировать все 20, но млекопитающих способны синтезировать лишь 11 заменимых аминокислот.[7] Таким образом, 9 незаменимых аминокислот должны быть получены из пищи. Все аминокислоты синтезируются из промежуточных продуктов гликолиза, цикла лимонной кислоты или пентозофосфатного пути. Азот поступает из глутамата и глутамина. Синтез аминокислот зависит от образования соответствующей альфа-кетокислоты, которая затем трансаминируется с образованием аминокислоты.[73]
Аминокислоты образуют белки, объединяясь в цепочку пептидными связями. Каждый белок имеет уникальную последовательность аминокислотных остатков(первичная структура белка). Подобно тому, как буквы алфавита могут комбинироваться с образованием почти бесконечных вариаций слов, аминокислоты могут связываться в той или иной последовательности для формирования огромного разнообразия белков. Аминокислоты прикрепляются к молекуле тРНК через эфирные связи. Это предшественники аминоацил-тРНК, которые участвуют в АТФ-зависимой реакции, которая регулируется аминоацил-тРНК-синтетазой.[74] Эта аминоацил-тРНК — субстрат для рибосомы, которая объединяет аминокислоты в длинные цепочки белка, используя информацию о последовательности из мРНК.[75]
Синтез и утилизация нуклеотидов
Нуклеотиды образуются из аминокислот, диоксид углерода и муравьиной кислоты в цепи реакций, которой необходимо большое количество энергии.[76] Таким образом, большинство организмов имеет эффективные системы для утилизации предшественников нуклеотидов.[76][77] Пурины синтезируются как нуклеозиды (в основном связанные с рибозой). Аденин и гуанин образуются из предшественников нуклеозида инозин монофосфата, который синтезируется с использованием атомов из аминокислот глицина, глутамина и аспарагиновой кислоты, также как формат, перенесённый из кофермента тетрагидрофолата. Пиримидины синтезируются из основы оротата, которая образуется из глутамина и аспартата.[78]
См. также
Примечания
- ↑ 1 2 Friedrich C (1998). "Physiology and genetics of sulfur-oxidizing bacteria". Adv Microb Physiol. 39: 235—89. doi:10.1016/S0065-2911(08)60018-1. PMID 9328649.
- ↑ Pace NR (2001). "The universal nature of biochemistry". Proc. Natl. Acad. Sci. U.S.A. 98 (3): 805—8. doi:10.1073/pnas.98.3.805. PMC 33372. PMID 11158550.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка) - ↑ Smith E, Morowitz H (2004). "Universality in intermediary metabolism". Proc Natl Acad Sci USA. 101 (36): 13168—73. doi:10.1073/pnas.0404922101. PMC 516543. PMID 15340153.
- ↑ Ebenhöh O, Heinrich R (2001). "Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems". Bull Math Biol. 63 (1): 21—55. doi:10.1006/bulm.2000.0197. PMID 11146883.
- ↑ Meléndez-Hevia E, Waddell T, Cascante M (1996). "The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution". J Mol Evol. 43 (3): 293—303. doi:10.1007/BF02338838. PMID 8703096.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Michie K, Löwe J (2006). "Dynamic filaments of the bacterial cytoskeleton". Annu Rev Biochem. 75: 467—92. doi:10.1146/annurev.biochem.75.103004.142452. PMID 16756499.
- ↑ 1 2 3 4 5 6 7 Nelson, David L. Lehninger Principles of Biochemistry. — New York : W. H. Freeman and company, 2005. — P. 841. — ISBN 0-7167-4339-6. Ошибка в сносках?: Неверный тег
<ref>: название «Nelson» определено несколько раз для различного содержимого - ↑ Fahy E, Subramaniam S, Brown H, Glass C, Merrill A, Murphy R, Raetz C, Russell D, Seyama Y, Shaw W, Shimizu T, Spener F, van Meer G, VanNieuwenhze M, White S, Witztum J, Dennis E (2005). "A comprehensive classification system for lipids". J Lipid Res. 46 (5): 839—61. doi:10.1194/jlr.E400004-JLR200. PMID 15722563.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Nomenclature of Lipids. IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Дата обращения: 8 марта 2007.
- ↑ Hegardt F (1999). "Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis". Biochem J. 338 (Pt 3): 569—82. doi:10.1042/0264-6021:3380569. PMC 1220089. PMID 10051425.
- ↑ Raman R, Raguram S, Venkataraman G, Paulson J, Sasisekharan R (2005). "Glycomics: an integrated systems approach to structure-function relationships of glycans". Nat Methods. 2 (11): 817—24. doi:10.1038/nmeth807. PMID 16278650.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Sierra S, Kupfer B, Kaiser R (2005). "Basics of the virology of HIV-1 and its replication". J Clin Virol. 34 (4): 233—44. doi:10.1016/j.jcv.2005.09.004. PMID 16198625.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 Wimmer M, Rose I (1978). "Mechanisms of enzyme-catalyzed group transfer reactions". Annu Rev Biochem. 47: 1031—78. doi:10.1146/annurev.bi.47.070178.005123. PMID 354490.
- ↑ Mitchell P (1979). "The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems". Eur J Biochem. 95 (1): 1—20. doi:10.1111/j.1432-1033.1979.tb12934.x. PMID 378655.
- ↑ 1 2 3 4 Dimroth P, von Ballmoos C, Meier T (2006). "Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series". EMBO Rep. 7 (3): 276—82. doi:10.1038/sj.embor.7400646. PMC 1456893. PMID 16607397.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Coulston, Ann. Stanford School of Medicine Nutrition Courses / Ann Coulston, John Kerner, JoAnn Hattner … [и др.]. — SUMMIT, 2006.
- ↑ Pollak N, Dölle C, Ziegler M (2007). "The power to reduce: pyridine nucleotides—small molecules with a multitude of functions". Biochem J. 402 (2): 205—18. doi:10.1042/BJ20061638. PMC 1798440. PMID 17295611.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 Heymsfield S, Waki M, Kehayias J, Lichtman S, Dilmanian F, Kamen Y, Wang J, Pierson R (1991). "Chemical and elemental analysis of humans in vivo using improved body composition models". Am J Physiol. 261 (2 Pt 1): E190—8. PMID 1872381.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Sychrová H (2004). "Yeast as a model organism to study transport and homeostasis of alkali metal cations" (PDF). Physiol Res. 53 Suppl 1: S91—8. PMID 15119939.
- ↑ Levitan I (1988). "Modulation of ion channels in neurons and other cells". Annu Rev Neurosci. 11: 119—36. doi:10.1146/annurev.ne.11.030188.001003. PMID 2452594.
- ↑ Dulhunty A (2006). "Excitation-contraction coupling from the 1950s into the new millennium". Clin Exp Pharmacol Physiol. 33 (9): 763—72. doi:10.1111/j.1440-1681.2006.04441.x. PMID 16922804.
- ↑ Mahan D, Shields R (1998). "Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight". J Anim Sci. 76 (2): 506—12. PMID 9498359.
- ↑ Husted S, Mikkelsen B, Jensen J, Nielsen N (2004). "Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics". Anal Bioanal Chem. 378 (1): 171—82. doi:10.1007/s00216-003-2219-0. PMID 14551660.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Finney L, O'Halloran T (2003). "Transition metal speciation in the cell: insights from the chemistry of metal ion receptors". Science. 300 (5621): 931—6. doi:10.1126/science.1085049. PMID 12738850.
- ↑ Cousins R, Liuzzi J, Lichten L (2006). "Mammalian zinc transport, trafficking, and signals". J Biol Chem. 281 (34): 24085—9. doi:10.1074/jbc.R600011200. PMID 16793761.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Dunn L, Rahmanto Y, Richardson D (2007). "Iron uptake and metabolism in the new millennium". Trends Cell Biol. 17 (2): 93—100. doi:10.1016/j.tcb.2006.12.003. PMID 17194590.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Nealson K, Conrad P (1999). "Life: past, present and future". Philos Trans R Soc Lond B Biol Sci. 354 (1392): 1923—39. doi:10.1098/rstb.1999.0532. PMC 1692713. PMID 10670014.
- ↑ Häse C, Finkelstein R (1993). "Bacterial extracellular zinc-containing metalloproteases". Microbiol Rev. 57 (4): 823—37. PMC 372940. PMID 8302217.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка) - ↑ Gupta R, Gupta N, Rathi P (2004). "Bacterial lipases: an overview of production, purification and biochemical properties". Appl Microbiol Biotechnol. 64 (6): 763—81. doi:10.1007/s00253-004-1568-8. PMID 14966663.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Hoyle T (1997). "The digestive system: linking theory and practice". Br J Nurs. 6 (22): 1285—91. PMID 9470654.
- ↑ Souba W, Pacitti A (1992). "How amino acids get into cells: mechanisms, models, menus, and mediators". JPEN J Parenter Enteral Nutr. 16 (6): 569—78. doi:10.1177/0148607192016006569. PMID 1494216.
- ↑ Barrett M, Walmsley A, Gould G (1999). "Structure and function of facilitative sugar transporters". Curr Opin Cell Biol. 11 (4): 496—502. doi:10.1016/S0955-0674(99)80072-6. PMID 10449337.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Bell G, Burant C, Takeda J, Gould G (1993). "Structure and function of mammalian facilitative sugar transporters". J Biol Chem. 268 (26): 19161—4. PMID 8366068.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 Bouché C, Serdy S, Kahn C, Goldfine A (2004). "The cellular fate of glucose and its relevance in type 2 diabetes". Endocr Rev. 25 (5): 807—30. doi:10.1210/er.2003-0026. PMID 15466941.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Sakami W, Harrington H (1963). "Amino acid metabolism". Annu Rev Biochem. 32: 355—98. doi:10.1146/annurev.bi.32.070163.002035. PMID 14144484.
- ↑ Brosnan J (2000). "Glutamate, at the interface between amino acid and carbohydrate metabolism". J Nutr. 130 (4S Suppl): 988S—90S. PMID 10736367.
- ↑ Young V, Ajami A (2001). "Glutamine: the emperor or his clothes?". J Nutr. 131 (9 Suppl): 2449S—59S, discussion 2486S–7S. PMID 11533293.
- ↑ Hosler J, Ferguson-Miller S, Mills D (2006). "Energy transduction: proton transfer through the respiratory complexes". Annu Rev Biochem. 75: 165—87. doi:10.1146/annurev.biochem.75.062003.101730. PMC 2659341. PMID 16756489.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Schultz B, Chan S (2001). "Structures and proton-pumping strategies of mitochondrial respiratory enzymes". Annu Rev Biophys Biomol Struct. 30: 23—65. doi:10.1146/annurev.biophys.30.1.23. PMID 11340051.
- ↑ Capaldi R, Aggeler R (2002). "Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor". Trends Biochem Sci. 27 (3): 154—60. doi:10.1016/S0968-0004(01)02051-5. PMID 11893513.
- ↑ Friedrich B, Schwartz E (1993). "Molecular biology of hydrogen utilization in aerobic chemolithotrophs". Annu Rev Microbiol. 47: 351—83. doi:10.1146/annurev.mi.47.100193.002031. PMID 8257102.
- ↑ Weber K, Achenbach L, Coates J (2006). "Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction". Nat Rev Microbiol. 4 (10): 752—64. doi:10.1038/nrmicro1490. PMID 16980937.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Jetten M, Strous M, van de Pas-Schoonen K, Schalk J, van Dongen U, van de Graaf A, Logemann S, Muyzer G, van Loosdrecht M, Kuenen J (1998). "The anaerobic oxidation of ammonium". FEMS Microbiol Rev. 22 (5): 421—37. doi:10.1111/j.1574-6976.1998.tb00379.x. PMID 9990725.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Simon J (2002). "Enzymology and bioenergetics of respiratory nitrite ammonification". FEMS Microbiol Rev. 26 (3): 285—309. doi:10.1111/j.1574-6976.2002.tb00616.x. PMID 12165429.
- ↑ Conrad R (1996). "Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)". Microbiol Rev. 60 (4): 609—40. PMC 239458. PMID 8987358.
- ↑ Barea J, Pozo M, Azcón R, Azcón-Aguilar C (2005). "Microbial co-operation in the rhizosphere". J Exp Bot. 56 (417): 1761—78. doi:10.1093/jxb/eri197. PMID 15911555.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ van der Meer M, Schouten S, Bateson M, Nübel U, Wieland A, Kühl M, de Leeuw J, Sinninghe Damsté J, Ward D (2005). "Diel variations in carbon metabolism by green nonsulfur-like bacteria in alkaline siliceous hot spring microbial mats from Yellowstone National Park". Appl Environ Microbiol. 71 (7): 3978—86. doi:10.1128/AEM.71.7.3978-3986.2005. PMC 1168979. PMID 16000812.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Tichi M, Tabita F (2001). "Interactive control of Rhodobacter capsulatus redox-balancing systems during phototrophic metabolism". J Bacteriol. 183 (21): 6344—54. doi:10.1128/JB.183.21.6344-6354.2001. PMC 100130. PMID 11591679.
- ↑ Allen J, Williams J (1998). "Photosynthetic reaction centers". FEBS Lett. 438 (1—2): 5—9. doi:10.1016/S0014-5793(98)01245-9. PMID 9821949.
- ↑ Munekage Y, Hashimoto M, Miyake C, Tomizawa K, Endo T, Tasaka M, Shikanai T (2004). "Cyclic electron flow around photosystem I is essential for photosynthesis". Nature. 429 (6991): 579—82. doi:10.1038/nature02598. PMID 15175756.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Miziorko H, Lorimer G (1983). "Ribulose-1,5-bisphosphate carboxylase-oxygenase". Annu Rev Biochem. 52: 507—35. doi:10.1146/annurev.bi.52.070183.002451. PMID 6351728.
- ↑ Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K (2002). "Crassulacean acid metabolism: plastic, fantastic". J Exp Bot. 53 (369): 569—80. doi:10.1093/jexbot/53.369.569. PMID 11886877.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Hügler M, Wirsen C, Fuchs G, Taylor C, Sievert S (2005). "Evidence for autotrophic CO2 fixation via the reductive tricarboxylic acid cycle by members of the epsilon subdivision of proteobacteria". J Bacteriol. 187 (9): 3020—7. doi:10.1128/JB.187.9.3020-3027.2005. PMC 1082812. PMID 15838028.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Strauss G, Fuchs G (1993). "Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle". Eur J Biochem. 215 (3): 633—43. doi:10.1111/j.1432-1033.1993.tb18074.x. PMID 8354269.
- ↑ Wood H (1991). "Life with CO or CO2 and H2 as a source of carbon and energy". FASEB J. 5 (2): 156—63. PMID 1900793.
- ↑ Shively J, van Keulen G, Meijer W (1998). "Something from almost nothing: carbon dioxide fixation in chemoautotrophs". Annu Rev Microbiol. 52: 191—230. doi:10.1146/annurev.micro.52.1.191. PMID 9891798.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Boiteux A, Hess B (1981). "Design of glycolysis". Philos Trans R Soc Lond B Biol Sci. 293 (1063): 5—22. doi:10.1098/rstb.1981.0056. PMID 6115423.
- ↑ Pilkis S, el-Maghrabi M, Claus T (1990). "Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics". Diabetes Care. 13 (6): 582—99. doi:10.2337/diacare.13.6.582. PMID 2162755.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 Ensign S (2006). "Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation". Mol Microbiol. 61 (2): 274—6. doi:10.1111/j.1365-2958.2006.05247.x. PMID 16856935.
- ↑ Finn P, Dice J (2006). "Proteolytic and lipolytic responses to starvation". Nutrition. 22 (7—8): 830—44. doi:10.1016/j.nut.2006.04.008. PMID 16815497.
- ↑ Kornberg H, Krebs H (1957). "Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle". Nature. 179 (4568): 988—91. doi:10.1038/179988a0. PMID 13430766.
- ↑ Opdenakker G, Rudd P, Ponting C, Dwek R (1993). "Concepts and principles of glycobiology". FASEB J. 7 (14): 1330—7. PMID 8224606.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ McConville M, Menon A (2000). "Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review)". Mol Membr Biol. 17 (1): 1—16. doi:10.1080/096876800294443. PMID 10824734.
- ↑ Chirala S, Wakil S (2004). "Structure and function of animal fatty acid synthase". Lipids. 39 (11): 1045—53. doi:10.1007/s11745-004-1329-9. PMID 15726818.
- ↑ White S, Zheng J, Zhang Y (2005). "The structural biology of type II fatty acid biosynthesis". Annu Rev Biochem. 74: 791—831. doi:10.1146/annurev.biochem.74.082803.133524. PMID 15952903.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Ohlrogge J, Jaworski J (1997). "Regulation of fatty acid synthesis". Annu Rev Plant Physiol Plant Mol Biol. 48: 109—136. doi:10.1146/annurev.arplant.48.1.109. PMID 15012259.
- ↑ Dubey V, Bhalla R, Luthra R (2003). "An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants" (PDF). J Biosci. 28 (5): 637—46. doi:10.1007/BF02703339. PMID 14517367.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 Kuzuyama T, Seto H (2003). "Diversity of the biosynthesis of the isoprene units". Nat Prod Rep. 20 (2): 171—83. doi:10.1039/b109860h. PMID 12735695.
- ↑ Grochowski L, Xu H, White R (2006). "Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate". J Bacteriol. 188 (9): 3192—8. doi:10.1128/JB.188.9.3192-3198.2006. PMC 1447442. PMID 16621811.
{{cite journal}}: Неизвестный параметр|month=игнорируется (справка)Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Lichtenthaler H (1999). "The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants". Annu Rev Plant Physiol Plant Mol Biol. 50: 47—65. doi:10.1146/annurev.arplant.50.1.47. PMID 15012203.
- ↑ 1 2 Schroepfer G (1981). "Sterol biosynthesis". Annu Rev Biochem. 50: 585—621. doi:10.1146/annurev.bi.50.070181.003101. PMID 7023367.
- ↑ Lees N, Skaggs B, Kirsch D, Bard M (1995). "Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review". Lipids. 30 (3): 221—6. doi:10.1007/BF02537824. PMID 7791529.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Guyton, Arthur C. Textbook of Medical Physiology. — Philadelphia : Elsevier, 2006. — P. 855–6. — ISBN 0-7216-0240-1.
- ↑ Ibba M, Söll D (2001). "The renaissance of aminoacyl-tRNA synthesis". EMBO Rep. 2 (5): 382—7. PMID 11375928.
- ↑ Lengyel P, Söll D (1969). "Mechanism of protein biosynthesis". Bacteriol Rev. 33 (2): 264—301. PMC 378322. PMID 4896351.
- ↑ 1 2 Rudolph F (1994). "The biochemistry and physiology of nucleotides". J Nutr. 124 (1 Suppl): 124S—127S. PMID 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R (2006). "Pyrimidine and purine biosynthesis and degradation in plants". Annu Rev Plant Biol. 57: 805—36. doi:10.1146/annurev.arplant.57.032905.105421. PMID 16669783.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Stasolla C, Katahira R, Thorpe T, Ashihara H (2003). "Purine and pyrimidine nucleotide metabolism in higher plants". J Plant Physiol. 160 (11): 1271—95. doi:10.1078/0176-1617-01169. PMID 14658380.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Smith J (1995). "Enzymes of nucleotide synthesis". Curr Opin Struct Biol. 5 (6): 752—7. doi:10.1016/0959-440X(95)80007-7. PMID 8749362.
Ссылки
Шаблон:Link FA Шаблон:Link FA Шаблон:Link FA Шаблон:Link FA Шаблон:Link FA Шаблон:Link FA Шаблон:Link GA