Шикиматный путь: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Дополнение статьи, добавлены ещё источники |
Оформление сносок, добавлены ещё источники |
||
| Строка 8: | Строка 8: | ||
Таким образом, шикимат, который отнюдь не является ароматическим соединением, оказался промежуточным продуктом в процессах биосинтеза трёх ароматических [[:en:Proteinogenic amino acid|протеиногенных]] [[Аминокислоты|аминокислот]], ''пара''-аминобензоата и других существенных ароматических соединений.{{.ref|<ref name="mezler-T3" />}} Очевидно, у некоторых полученных Дэвисом мутантов был нарушен синтез шикимата, тогда как у других мутантов были блокированы более поздние стадии метаболического процесса. |
Таким образом, шикимат, который отнюдь не является ароматическим соединением, оказался промежуточным продуктом в процессах биосинтеза трёх ароматических [[:en:Proteinogenic amino acid|протеиногенных]] [[Аминокислоты|аминокислот]], ''пара''-аминобензоата и других существенных ароматических соединений.{{.ref|<ref name="mezler-T3" />}} Очевидно, у некоторых полученных Дэвисом мутантов был нарушен синтез шикимата, тогда как у других мутантов были блокированы более поздние стадии метаболического процесса. |
||
При помощи [[Ауксотрофы|ауксотрофных]] мутантов ''Escherichia coli'', ''Aerobacter aerogenes'' и ''[[Нейроспора густая|Neurospora]]'' и с применением [[Меченые атомы|изотопно-меченых]] соединений был прослежен весь путь от [[Углеводы|углеводных]] предшественников до первичных и [[Вторичные метаболиты|вторичных]] метаболитов ароматической природы.{{.ref|<ref name="mezler-T3" />}} Промежуточные соединения удавалось обнаружить и изолировать благодаря тому, что определённые мутанты их накапливали. Эксперименты с мутантами и выделяемыми ими соединениями позволяли выстраивать эти соединения в цепочку и отмечать в этой цепочке места недостающих метаболитов. Установить начальные этапы пути, связывающие его с известными путями, было значительно сложнее. Мутантный штамм ''Escherichia coli'', накапливающий в культуральной среде шикимовую кислоту, выращивали на средах, содержащих в качестве единственного источника углерода [[Углерод-14|<sup>14</sup>C]]- |
При помощи [[Ауксотрофы|ауксотрофных]] мутантов ''Escherichia coli'', ''Aerobacter aerogenes'' и ''[[Нейроспора густая|Neurospora]]'' и с применением [[Меченые атомы|изотопно-меченых]] соединений был прослежен весь путь от [[Углеводы|углеводных]] предшественников до первичных и [[Вторичные метаболиты|вторичных]] метаболитов ароматической природы.{{.ref|<ref name="mezler-T3" />}} Промежуточные соединения удавалось обнаружить и изолировать благодаря тому, что определённые мутанты их накапливали. Эксперименты с мутантами и выделяемыми ими соединениями позволяли выстраивать эти соединения в цепочку и отмечать в этой цепочке места недостающих метаболитов. Установить начальные этапы пути, связывающие его с известными путями, было значительно сложнее. Мутантный штамм ''Escherichia coli'', накапливающий в культуральной среде шикимовую кислоту, выращивали на средах, содержащих в качестве единственного источника углерода [[Углерод-14|<sup>14</sup>C]]-меченую по определённым позициям глюкозу и другие соединения. После этого шикимовую кислоту выделяли. Распределение радиоактивных меток определялось путём ступенчатой химической деструкции. Анализ полученных результатов привёл к выводу, что три из семи атомов углерода молекулы шикимовой кислоты приходят из гликолиза, остальные четыре — из пентозофосфатного пути.{{.ref|<ref name="Research of shikimic acid biosynthesis">{{статья|автор=P. R. Srinivasan, Harold T. Shigeura, Milon Sprecher, David B. Sprinson, Bernard D. Davis|заглавие=The biosynthesis of shikimic acid from D-glucose|ссылка=http://www.jbc.org/content/220/1/477.full.pdf+html|язык=en|издание=The Journal of Biological Chemistry|тип=Научный журнал|год=1956|том=220|номер=1|страницы=477—497|doi= |issn= |pmid=13319365}}</ref>}} Природа исходных соединений была выяснена, когда стал доступен синтетический {{.ref|<ref name="Synthetic D-Erythrose 4-Phosphate">{{статья|автор=Clinton E. Ballou, Hermann O. L. Fischer, D. L. MacDonald|заглавие=The Synthesis and Properties of D-Erythrose 4-Phosphate|ссылка= |язык=en|издание=Journal of the American Chemical Society|тип=Научный журнал|год=1955|том=77|номер=22|страницы=5967—5970|doi=10.1021/ja01627a053|issn=}}</ref>}} эритрозо-4-фосфат. Было показано, что клеточные экстракты ''Escherichia coli'' легко конвертируют этритрозо-4-фосфат и фосфоенолпируват в дегидрохиннат.{{.ref|<ref name="Concretization precursors of Dehydroquinate">{{статья|автор=P. R. Srinivasan, Masayuki Katagiri, David B. Sprinson|заглавие=The conversion of phosphoenolpyruvic acid and D-erythrose-4-phosphate to 5-dehydroquinic acid|ссылка=http://www.jbc.org/content/234/4/713.full.pdf+html|язык=en|издание=The Journal of Biological Chemistry|тип=Научный журнал|год=1959|том=234|номер=4|страницы=713—715|doi= |issn= |pmid=13654248}}</ref>}} Сначала предположили, а затем экспериментально установили, что промежуточным соединением является семиуглеродный продукт конденсации — соединение, которое теперь известно как ДАГФ.{{.ref|<ref name="Srinivasan Sprinson" />}} Также при помощи радиоизотопных меток было показано, что экспериментально наблюдаемое почти количественное превращение под действием бактериальных клеточных экстрактов седогептулозо-1,7-дифосфата в дегидрошикимат или шикимат {{.ref|<ref name="various carbohydrates to dehydroskikimate">{{статья|автор=Edwin B. Kalan, Bernard D. Davis, P. R. Srinivasan, David B. Sprinson|заглавие=The conversion of various carbohydrates to 5-dehydroskikimic acid by bacterial extracts|ссылка=http://www.jbc.org/content/223/2/907.full.pdf+html|язык=en|издание=The Journal of Biological Chemistry|тип=Научный журнал|год=1956|том=223|номер=2|страницы=907—912|doi= |issn= |pmid=13385238}}</ref>}} не может быть объяснено преобразованием цельной молекулы, без промежуточного расщепления её на {{comment|C<sub>4</sub>|D-эритрозо-4-фосфат}} и {{comment|C<sub>3</sub>|Дигидроксиацетонфосфат, который через цепочку известных реакций гликолитического пути преобразуется в фосфоенолпируват}}-фрагменты.{{.ref|<ref name="SDP to shikimate">{{статья|автор=P. R. Srinivasan, David B. Sprinson, Edwin B. Kalan, Bernard D. Davis|заглавие=The enzymatic conversion of sedoheptulose-1,7-diphosphate to shikimic acid|ссылка=http://www.jbc.org/content/223/2/913.full.pdf+html|язык=en|издание=The Journal of Biological Chemistry|тип=Научный журнал|год=1956|том=223|номер=2|страницы=913—920|doi= |issn= |pmid=13385239}}</ref>}} |
||
Важнейшая часть работы по расшифровке пути была проделана Бернардом Дэвисом в сотрудничестве с {{comment|Дэвидом Спринсоном|Родился 5 апреля 1910 года в Украине, в 1919 году с семьёй эмигрировал в США}} (1910—2007) из [[Колумбийский университет|Колумбийского университета]].{{.ref|<ref name="maasmemoir">{{статья|автор=Werner K. Maas|заглавие=Bernard David Davis (1916–1994) — A Biographical Memoir by Werner K. Maas|ссылка=http://books.nap.edu/html/biomems/bdavis.pdf|язык=en|издание=Biographical Memoirs|тип=Биографические воспоминания|год=1999|том=77|номер= |страницы=50—63|doi= |issn=}}</ref>}} Значительный вклад в изучение отдельных стадий процесса внесли также австралийцы Франк Гибсон (1923—2008), Джеймс Питтард и многие другие исследователи. Полная картина метаболического пути стала ясна в 1963—1964 г., когда Франк Гибсон наконец выделил и изучил долго ускользавшую от наблюдения субстанцию «{{comment|compound X|В ранних работах Дэвиса названием «compound X» обозначался также неустановленной структуры предшественник шикимата, который оказался дегидрошикиматом.}}» — недостающий промежуточный метаболит, структура которого до этого уже была предсказана (впоследствии подтверждена Ллойдом Джэкмэном при помощи [[ЯМР-спектроскопия|ЯМР-спектроскопии]]). По предложению своего тестя это соединение Гибсон назвал хоризматом (хоризмовой кислотой). Гипотеза Дэвиса (5-карбоксивинил-шикимат-3-фосфат, или как его тогда называли «Z1-phosphate» — предшественник как фенилаланина, тирозина, так и триптофана) была доказана, гипотеза Спринсона (последний общий предшественник трёх ароматических аминокислот — фосфошикимовая кислота) подтверждения не получила.{{.ref|<ref name="Frank William Ernest Gibson">{{статья|автор=A. J. Pittard and G. B. Cox|заглавие=Frank William Ernest Gibson 1923–2008|ссылка=http://www.publish.csiro.au/?act=view_file&file_id=HR09024.pdf|язык=en|издание=Historical Records of Australian Science|тип=Журнал, освещающий историю науки|год=2010|том=21|номер=1|страницы=55—74|doi=10.1071/HR09024|issn=}}</ref>}} |
Важнейшая часть работы по расшифровке пути была проделана Бернардом Дэвисом в сотрудничестве с {{comment|Дэвидом Спринсоном|Родился 5 апреля 1910 года в Украине, в 1919 году с семьёй эмигрировал в США}} (1910—2007) из [[Колумбийский университет|Колумбийского университета]].{{.ref|<ref name="maasmemoir">{{статья|автор=Werner K. Maas|заглавие=Bernard David Davis (1916–1994) — A Biographical Memoir by Werner K. Maas|ссылка=http://books.nap.edu/html/biomems/bdavis.pdf|язык=en|издание=Biographical Memoirs|тип=Биографические воспоминания|год=1999|том=77|номер= |страницы=50—63|doi= |issn=}}</ref>}} Значительный вклад в изучение отдельных стадий процесса внесли также австралийцы Франк Гибсон (1923—2008), Джеймс Питтард и многие другие исследователи. Полная картина метаболического пути стала ясна в 1963—1964 г., когда Франк Гибсон наконец выделил и изучил долго ускользавшую от наблюдения субстанцию «{{comment|compound X|В ранних работах Дэвиса названием «compound X» обозначался также неустановленной структуры предшественник шикимата, который оказался дегидрошикиматом.}}» — недостающий промежуточный метаболит, структура которого до этого уже была предсказана (впоследствии подтверждена Ллойдом Джэкмэном при помощи [[ЯМР-спектроскопия|ЯМР-спектроскопии]]). По предложению своего тестя это соединение Гибсон назвал хоризматом (хоризмовой кислотой). Гипотеза Дэвиса (5-карбоксивинил-шикимат-3-фосфат, или как его тогда называли «Z1-phosphate» — предшественник как фенилаланина, тирозина, так и триптофана) была доказана, гипотеза Спринсона (последний общий предшественник трёх ароматических аминокислот — фосфошикимовая кислота) подтверждения не получила.{{.ref|<ref name="Frank William Ernest Gibson">{{статья|автор=A. J. Pittard and G. B. Cox|заглавие=Frank William Ernest Gibson 1923–2008|ссылка=http://www.publish.csiro.au/?act=view_file&file_id=HR09024.pdf|язык=en|издание=Historical Records of Australian Science|тип=Журнал, освещающий историю науки|год=2010|том=21|номер=1|страницы=55—74|doi=10.1071/HR09024|issn=}}</ref>}} |
||
| Строка 22: | Строка 22: | ||
== Распространённость и локализация == |
== Распространённость и локализация == |
||
Шикиматный путь осуществляется в клетках [[Прокариоты|прокариот]] (как [[Бактерии|бактерий]], так и [[Археи|архей]]) и [[Эукариоты|эукариот]] ([[Грибы|грибов]], [[Растения|растений]], всевозможных [[Протисты|протистов]], но не [[Животные|животных]]). У растений реакции шикиматного пути проходят в [[Цитозоль|цитозоле]] и, практически независимо,{{.ref|<ref name="siteagrotext">Национальный институт биоразнообразия им. А.В.Ферсмана, Лаборатория фитоинвазий: Фенольные соединения |
Шикиматный путь осуществляется в клетках [[Прокариоты|прокариот]] (как [[Бактерии|бактерий]], так и [[Археи|архей]]) и [[Эукариоты|эукариот]] ([[Грибы|грибов]], [[Растения|растений]], всевозможных [[Протисты|протистов]], но не [[Животные|животных]]). У растений реакции шикиматного пути проходят в [[Цитозоль|цитозоле]] и, практически независимо,{{.ref|<ref name="siteagrotext">[http://agrotext2.ru/1540.html Национальный институт биоразнообразия им. А. В. Ферсмана, Лаборатория фитоинвазий: Фенольные соединения]</ref>}} в [[Пластиды|пластидах]] (главным образом в [[хлоропласт]]ах), однако [[ген]]ы практически всех [[Ферменты|ферментов]] локализованы в [[Клеточное ядро|ядре]]; при нормальных условиях роста около 20 % всего [[Фотосинтез|усваиваемого]] растением углерода протекает этим путём.{{.ref|<ref name="Klaus Herrmann Shikimate Pathway" />}} {{.ref|<ref name="siteuky">[http://www.uky.edu/~dhild/biochem/24/lect24.html Plant Biochemistry]</ref>}} У организмов, клетки которых не содержат пластиды, шикиматный путь протекает в цитозоле. Многоклеточные [[животные]] (''Metazoa'') не имеют ферментной системы шикиматного пути, так как получают протеиногенные ароматические аминокислоты и прочие необходимые продукты шикиматного пути в достаточном количестве с пищей (или от [[Симбиоз|симбионтов]]) и потому [[Эволюция|эволюцией]] освобождены от необходимости их биосинтеза de novo. С другой стороны, избавившись от «лишнего» ещё на этапе своего эволюционного становления, животные попали в зависимость от ряда экзогенных соединений ([[незаменимые аминокислоты]], значительная часть [[Витамины|витаминов]]).{{.ref|<ref name="Pauling book">{{книга|автор=Linus Pauling|часть= |ссылка часть= |заглавие=How to Live Longer and Feel Better|оригинал= |ссылка= |викитека= |ответственный= |издание= |место= |издательство=W. H. Freeman and Company|год=1986|том= |страницы= |страниц= |серия= |isbn=0-380-70289-4|тираж= }}</ref>}} Животные способны преобразовывать готовые ароматические продукты шикиматного пути,{{.ref|<ref name="semenov">{{книга|автор=Семёнов А. А.|часть= |ссылка часть= |заглавие=Очерк химии природных соединений|оригинал= |ссылка= |викитека= |ответственный=Под ред. акад. Толстикова Г. А.|издание= |место=Новосибирск|издательство=Наука|год=2000|том= |страницы= |страниц=664|серия= |isbn=5-02-031642-3|тираж=372}}</ref>}} в частности, способны превращать [[Незаменимые аминокислоты|незаменимую]] аминокислоту фенилаланин в тирозин, являющийся заменимой аминокислотой при условии достаточного поступления фенилаланина с пищей. Шикиматный путь частично или полностью утрачен также некоторыми микроорганизмами, живущими исключительно в богатых необходимыми веществами средах. |
||
У бактерий три реакции, завершающие биосинтез фенилаланина, могут проходить как в [[Цитозоль|цитозоле]], так и в [[Периплазматическое пространство|периплазматическом пространстве]] или экстрацеллюлярно.{{.ref|<ref name="sitegen">The emerging periplasm-localized subclass of AroQ chorismate mutases, exemplified by those from Salmonella typhimurium and Pseudomonas aeruginosa |
У бактерий три реакции, завершающие биосинтез фенилаланина, могут проходить как в [[Цитозоль|цитозоле]], так и в [[Периплазматическое пространство|периплазматическом пространстве]] или экстрацеллюлярно.{{.ref|<ref name="sitegen">{{статья|автор=David H. Calhoun, Carol A. Bonner, Wei Gu, Gary Xie, Roy A. Jensen|заглавие=The emerging periplasm-localized subclass of AroQ chorismate mutases, exemplified by those from Salmonella typhimurium and Pseudomonas aeruginosa|ссылка=http://genomebiology.com/2001/2/8/research/0030|язык=en|издание=Genome Biology|тип=Научный журнал|год=2001|том=2|номер=8|страницы= |doi=10.1186/gb-2001-2-8-research0030|issn=1465-6914|pmid=11532214}}</ref>}} |
||
== Начальные этапы шикиматного пути == |
== Начальные этапы шикиматного пути == |
||
| Строка 57: | Строка 57: | ||
* через '''''[[Изохоризмовая кислота|изохоризмат]]''''' к структурным производным [[нафталин]]а ([[Витамин K|нафтохинонам]]), [[Салициловая кислота|салицилату]] и другим соединениям. |
* через '''''[[Изохоризмовая кислота|изохоризмат]]''''' к структурным производным [[нафталин]]а ([[Витамин K|нафтохинонам]]), [[Салициловая кислота|салицилату]] и другим соединениям. |
||
* через '''''[[футалозин]]''''' к нафтохинонам и, возможно, к другим соединениям. |
* через '''''[[футалозин]]''''' к нафтохинонам и, возможно, к другим соединениям. |
||
Известны и другие превращения хоризмата, например, присутствующая в его структуре эфирная связь может подвергаться гидролизу. Это путь к алициклическому соединению (1''R'',3''R'',4''R'')-3,4-дигидроксициклогексан-1-карбоксилату (предшественник-стартер в биосинтезе [[Сиролимус|рапамицина]], [[такролимус]]а и др.).{{.ref|<ref name="Staunton-Wilkinson"> |
Известны и другие превращения хоризмата, например, присутствующая в его структуре эфирная связь может подвергаться гидролизу. Это путь к алициклическому соединению (1''R'',3''R'',4''R'')-3,4-дигидроксициклогексан-1-карбоксилату (предшественник-стартер в биосинтезе [[Сиролимус|рапамицина]], [[такролимус]]а и др.).{{.ref|<ref name="Staunton-Wilkinson">{{статья|автор=James Staunton, Barrie Wilkinson|заглавие=Biosynthesis of Erythromycin and Rapamycin|ссылка=http://academics.eckerd.edu/instructor/grove/AdvOrg/Corey%20Erythronolide/Review%231.pdf|язык=en|издание=Chemical Reviews|тип=Научный журнал|год=1997|том=97|номер=7|страницы=2611—2630|doi= |issn= |pmid=11851474}}</ref>}} Аналогично может начинаться биосинтез циклогексилкарбонил-КоА (предшественник [[асукамицин]]а, ω-циклогексил-жирных кислот и других соединений). |
||
==== Путь через префенат ==== |
==== Путь через префенат ==== |
||
| Строка 88: | Строка 88: | ||
==== Путь через 4-амино-4-дезоксихоризмат ==== |
==== Путь через 4-амино-4-дезоксихоризмат ==== |
||
Изомерный антранилату [[Пара-аминобензойная кислота|''пара''-аминобензоат]] синтезируется из хоризмата через 4-амино-4-дезоксихоризмат энзимом ''пара''-аминобензоат-синтазой (КФ 2.6.1.85 + КФ 4.1.3.38), требующим присутствия ионов Mg<sup>2+</sup>. Донором аминогруппы выступает амидный азот глутамина. ''Пара''-аминобензоат является предшественником коферментов ряда фолата ([[Тетрагидрофолиевая кислота|THF]], [[Тетрагидрометаноптерин|THMPT]] и др.). ''Пара''-аминобензоат и его метаболические производные являются стартерными единицами в биосинтезе некоторых антибиотиков ([[кандицидин-D]], [[хачимицины]] (трихомицин), [[леворин]] и др.), остаток ''пара''-аминобензоата входит в состав антибиотиков [[пликацетин]], [[норпликацетин]], [[амицетин]], [[бамицетин]] и др. Спонтанный или энзиматический гидролиз эфирной связи 4-амино-4-дезоксихоризмата приводит к (3''R'',4''R'')-4-амино-3-дигидроксициклогекса-1,5-диен-1-карбоксилату. У некоторых микроорганизмов выявлен энзим, катализирующий аналогичную хоризматмутазной [3,3]-сигматропную перегруппировку 4-амино-4-дезоксихоризмата в [[4-Амино-4-дезоксипрефеновая кислота|4-амино-4-дезоксипрефенат]].{{.ref|<ref name="sitegen" />}} Эта реакция составляет этап биосинтеза непротеиногенной аминокислоты ''пара''-аминофенилаланин. ''Пара''-аминофенилаланин — рекурсор нескольких известных антибиотиков, из него образуются 4-(диметиламино)-фенилаланин (остаток входит в структуру некоторых циклических пептидных антибиотиков, например, [[пристинамицин]]а-IA),{{.ref|<ref name="Tariq-Gerard"> |
Изомерный антранилату [[Пара-аминобензойная кислота|''пара''-аминобензоат]] синтезируется из хоризмата через 4-амино-4-дезоксихоризмат энзимом ''пара''-аминобензоат-синтазой (КФ 2.6.1.85 + КФ 4.1.3.38), требующим присутствия ионов Mg<sup>2+</sup>. Донором аминогруппы выступает амидный азот глутамина. ''Пара''-аминобензоат является предшественником коферментов ряда фолата ([[Тетрагидрофолиевая кислота|THF]], [[Тетрагидрометаноптерин|THMPT]] и др.). ''Пара''-аминобензоат и его метаболические производные являются стартерными единицами в биосинтезе некоторых антибиотиков ([[кандицидин-D]], [[хачимицины]] (трихомицин), [[леворин]] и др.), остаток ''пара''-аминобензоата входит в состав антибиотиков [[пликацетин]], [[норпликацетин]], [[амицетин]], [[бамицетин]] и др. Спонтанный или энзиматический гидролиз эфирной связи 4-амино-4-дезоксихоризмата приводит к (3''R'',4''R'')-4-амино-3-дигидроксициклогекса-1,5-диен-1-карбоксилату. У некоторых микроорганизмов выявлен энзим, катализирующий аналогичную хоризматмутазной [3,3]-сигматропную перегруппировку 4-амино-4-дезоксихоризмата в [[4-Амино-4-дезоксипрефеновая кислота|4-амино-4-дезоксипрефенат]].{{.ref|<ref name="sitegen" />}} Эта реакция составляет этап биосинтеза непротеиногенной аминокислоты ''пара''-аминофенилаланин. ''Пара''-аминофенилаланин — рекурсор нескольких известных антибиотиков, из него образуются 4-(диметиламино)-фенилаланин (остаток входит в структуру некоторых циклических пептидных антибиотиков, например, [[пристинамицин]]а-IA),{{.ref|<ref name="Tariq-Gerard">{{статья|автор=Tariq A. Mukhtar, Gerard D. Wright|заглавие=Streptogramins, Oxazolidinones, and Other Inhibitors of Bacterial Protein Synthesis|ссылка=http://www.novexel.com/publications/nxl103/2005 Chemical Reviews.pdf|язык=en|издание=Chemical Reviews|тип=Научный журнал|год=2005|том=105|номер=2|страницы=529—542|doi=10.1021/cr030110z|issn= |pmid=15700955}}</ref>}} ''пара''-нитрофенилсеринол (предшественник [[хлорамфеникол]]а).{{.ref|<ref name="chloramphenicol"> J. Wongtavatchai and other — «Chloramphenicol» [http://whqlibdoc.who.int/publications/2004/9241660538_chloramphenicol.pdf]</ref>}} |
||
[[Файл:Превращения 4-амино-4-дезоксихоризмата.png|center|650 px|Превращения 4-амино-4-дезоксихоризмата]] |
[[Файл:Превращения 4-амино-4-дезоксихоризмата.png|center|650 px|Превращения 4-амино-4-дезоксихоризмата]] |
||
| Строка 96: | Строка 96: | ||
==== Путь через изохоризмат ==== |
==== Путь через изохоризмат ==== |
||
Хоризмат-гидроксимутаза (изохоризмат-синтаза, КФ 5.4.4.2) осуществляет обратимую изомеризацию хоризмата в изохоризмат. Изохоризмат является предшественником салицилата, [[Орто-пирокатехиновая кислота|2,3-дигидроксибензоата]] (предшественник [[Сидерофоры|сидерофорных]] соединений, таких, как [[энтеробактины]]), сукцинилбензоата (предшественник менахинонов, филлохинонов, а также [[ализарин]]а, [[лавсон]]а, [[юглон]]а, [[люцидин]]а, [[дуннион]]а, [[моллугин]]а), множества прочих соединений. Из изохоризмата салицилат синтезируется путём элиминирования пирувата (основной, но не единственный способ биосинтеза салицилата). Известен как [[Перициклические реакции|перициклический]], так и не перициклический механизмы этой реакции, описано оба соответствующих типа ферментативной активности.{{.ref|<ref name="DeClue Isochorismate Pyruvate Lyase">{{статья|автор=Michael S. DeClue, Kim K. Baldridge, Dominik E. Künzler, Peter Kast, and Donald Hilvert|заглавие=Isochorismate Pyruvate Lyase: A Pericyclic Reaction Mechanism?|ссылка= |язык=en|издание=Journal of the American Chemical Society|тип=Научный журнал|год=2005|том=127|номер=43|страницы=15002—15003|doi=10.1021/ja055871t|issn= |pmid=16248620}}</ref>}} {{.ref|<ref name="Kerbarh Salicylate Synthase">{{статья|автор=Olivier Kerbarha, Dimitri Y. Chirgadzeb, Tom L. Blundellb, Chris Abell|заглавие=Crystal Structures of Yersinia enterocolitica Salicylate Synthase and its Complex with the Reaction Products Salicylate and Pyruvate|ссылка=http://www.sciencedirect.com/science/article/pii/S002228360501661X|язык=en|издание=Journal of Molecular Biology|тип=Научный журнал|год=2006|том=357|номер=2|страницы=524—534|doi= |issn= |pmid=16434053}}</ref>}} У некоторых организмов известен энзим (изохоризмат-мутаза), катализирующий [3,3]-сигматропную перегруппировку изохоризмата в [[Изопрефеновая кислота|изопрефенат]].{{.ref|<ref name="enzymatic formation of isoprephenate">{{статья|автор=Lolita O. Zamir, Anastasia Nikolakakis, Carol A. Bonner, Roy A. Jensen|заглавие=Evidence for enzymatic formation of isoprephenate from isochorismate|ссылка=http://www.sciencedirect.com/science/article/pii/S0960894X01804261|язык=en|издание=Bioorganic & Medicinal Chemistry Letters|тип=Научный журнал|год=1993|том=3|номер=7|страницы=1441—1446|doi= |issn= |pmid=}}</ref>}} {{.ref|<ref name="sitegen" />}} Из изопрефената образуются непротеиногенные аминокислоты ''мета''-карбоксифенилаланин и ''мета''-карбокситирозин — вторичные метаболиты высших растений (''Nicotiana silvestria''). |
Хоризмат-гидроксимутаза (изохоризмат-синтаза, КФ 5.4.4.2) осуществляет обратимую изомеризацию хоризмата в изохоризмат. Изохоризмат является предшественником салицилата, [[Орто-пирокатехиновая кислота|2,3-дигидроксибензоата]] (предшественник [[Сидерофоры|сидерофорных]] соединений, таких, как [[энтеробактины]]), сукцинилбензоата (предшественник менахинонов, филлохинонов, а также [[ализарин]]а, [[лавсон]]а, [[юглон]]а, [[люцидин]]а, [[дуннион]]а, [[моллугин]]а), множества прочих соединений. Из изохоризмата салицилат синтезируется путём элиминирования пирувата (основной, но не единственный способ биосинтеза салицилата). Известен как [[Перициклические реакции|перициклический]], так и не перициклический механизмы этой реакции, описано оба соответствующих типа ферментативной активности.{{.ref|<ref name="DeClue Isochorismate Pyruvate Lyase">{{статья|автор=Michael S. DeClue, Kim K. Baldridge, Dominik E. Künzler, Peter Kast, and Donald Hilvert|заглавие=Isochorismate Pyruvate Lyase: A Pericyclic Reaction Mechanism?|ссылка= |язык=en|издание=Journal of the American Chemical Society|тип=Научный журнал|год=2005|том=127|номер=43|страницы=15002—15003|doi=10.1021/ja055871t|issn= |pmid=16248620}}</ref>}} {{.ref|<ref name="Kerbarh Salicylate Synthase">{{статья|автор=Olivier Kerbarha, Dimitri Y. Chirgadzeb, Tom L. Blundellb, Chris Abell|заглавие=Crystal Structures of Yersinia enterocolitica Salicylate Synthase and its Complex with the Reaction Products Salicylate and Pyruvate|ссылка=http://www.sciencedirect.com/science/article/pii/S002228360501661X|язык=en|издание=Journal of Molecular Biology|тип=Научный журнал|год=2006|том=357|номер=2|страницы=524—534|doi= |issn= |pmid=16434053}}</ref>}} У некоторых организмов известен энзим (изохоризмат-мутаза), катализирующий [3,3]-сигматропную перегруппировку изохоризмата в [[Изопрефеновая кислота|изопрефенат]].{{.ref|<ref name="enzymatic formation of isoprephenate">{{статья|автор=Lolita O. Zamir, Anastasia Nikolakakis, Carol A. Bonner, Roy A. Jensen|заглавие=Evidence for enzymatic formation of isoprephenate from isochorismate|ссылка=http://www.sciencedirect.com/science/article/pii/S0960894X01804261|язык=en|издание=Bioorganic & Medicinal Chemistry Letters|тип=Научный журнал|год=1993|том=3|номер=7|страницы=1441—1446|doi= |issn= |pmid=}}</ref>}} {{.ref|<ref name="sitegen" />}} Из изопрефената образуются непротеиногенные аминокислоты ''мета''-карбоксифенилаланин и ''мета''-карбокситирозин — вторичные метаболиты высших растений (''Nicotiana silvestria''). Изопрефенат — наиболее вероятный предшественник 3-формилтирозина, найденного у ''Pseudoalteromonas tunicata''.{{.ref|<ref name="m-Formyl-Tyrosine">{{статья|автор=Leah C. Blasiak and Jon Clardy|заглавие=Discovery of 3-Formyl-Tyrosine Metabolites from Pseudoalteromonas tunicata through Heterologous Expression|ссылка=http://pubs.acs.org/doi/abs/10.1021/ja9097862|язык=en|издание=Journal of the American Chemical Society|тип=Научный журнал|год=2010|том=132|номер=3|страницы=926—927|doi=10.1021/ja9097862|issn= |pmid=20041686}}</ref>}} |
||
[[Файл:Превращения изохоризмата.png|center|825 px|Превращения изохоризмата]] |
[[Файл:Превращения изохоризмата.png|center|825 px|Превращения изохоризмата]] |
||
==== Путь через футалозин ==== |
==== Путь через футалозин ==== |
||
[[Биоинформатика|Биоинформатический]] анализ [[Секвенирование|секвенированных]] геномов привёл к обнаружению у некоторых прокариот (''Streptomyces spp.'', ''[[Helicobacter pylori]]'', ''Campylobacter jejuni'') другого пути от хоризмата к менахинонам. В начале этого пути в ходе ферментативной реакции из хоризмата, [[инозин]]а ([[аденозин]]а) и фосфоенолпирувата образуется футалозин (аминодезоксифуталозин).{{.ref|<ref name="Toyama">Hiratsuka |
[[Биоинформатика|Биоинформатический]] анализ [[Секвенирование|секвенированных]] геномов привёл к обнаружению у некоторых прокариот (''Streptomyces spp.'', ''[[Helicobacter pylori]]'', ''Campylobacter jejuni'') другого пути от хоризмата к менахинонам. В начале этого пути в ходе ферментативной реакции из хоризмата, [[инозин]]а ([[аденозин]]а) и фосфоенолпирувата образуется футалозин (аминодезоксифуталозин).{{.ref|<ref name="Toyama">{{статья|автор=Tomoshige Hiratsuka, Kazuo Furihata, Jun Ishikawa, Haruyuki Yamashita, Nobuya Itoh, Haruo Seto, Tohru Dairi|заглавие=An Alternative Menaquinone Biosynthetic Pathway Operating in Microorganisms|ссылка=http://www.sciencemag.org/content/321/5896/1670.abstract|язык=en|издание=Science|тип=Научный журнал|год=2008|том=321|номер=5896|страницы=1670—1673|doi=10.1126/science.1160446|issn= |pmid=18801996}}</ref>}} {{.ref|<ref name="Diversity of Early Step of Futalosine Pathway">{{статья|автор=C. Arakawa, M. Kuratsu, Kazuo Furihata, Tomoshige Hiratsuka, Nobuya Itoh, Haruo Seto, Tohru Dairi|заглавие=Diversity of the Early Step of the Futalosine Pathway|ссылка=http://aac.asm.org/content/55/2/913/F1.expansion|язык=en|издание=Antimicrobial Agents and Chemotherapy|тип=Научный журнал|год=2011|том=55|номер=2|страницы=913—916|doi=10.1128/AAC.01362-10|issn= |pmid=21098241}}</ref>}} |
||
[[Файл:Биосинтез нафтохинонов через футалозин.png|center|970 px|Биосинтез нафтохинонов через футалозин]] |
[[Файл:Биосинтез нафтохинонов через футалозин.png|center|970 px|Биосинтез нафтохинонов через футалозин]] |
||
При синтезе менахинонов через изохоризмат и по футалозиновому пути наблюдается разный характер включения в структуру групп атомов, составляющих скелеты исходных соединений (в этих путях второй (хиноидный) карбоцикл достраивается к карбоциклу хоризмата с разных сторон). |
При синтезе менахинонов через изохоризмат и по футалозиновому пути наблюдается разный характер включения в структуру групп атомов, составляющих скелеты исходных соединений (в этих путях второй (хиноидный) карбоцикл достраивается к карбоциклу хоризмата с разных сторон). |
||
| Строка 109: | Строка 109: | ||
Ещё пример: фенилацетат (продукт метаболических превращений фенилпирувата и фенилаланина) — биосинтетический предшественник некоторых структурных производных циклогептана (ω-циклогептил-жирных кислот). |
Ещё пример: фенилацетат (продукт метаболических превращений фенилпирувата и фенилаланина) — биосинтетический предшественник некоторых структурных производных циклогептана (ω-циклогептил-жирных кислот). |
||
В других случаях бензольные кольца шикиматного происхождения могут утрачивать ароматичность без разрушения или перестройки углеродного скелета. Так, цианобактериальный дипептид [[радиозумин]], состоит из модифицированных остатков аминокислот, предположительно являющихся метаболическими производными ''пара''-аминофенилаланина с частично гидрированными кольцами.{{.ref|<ref name="CyanobacterialPeptides"> |
В других случаях бензольные кольца шикиматного происхождения могут утрачивать ароматичность без разрушения или перестройки углеродного скелета. Так, цианобактериальный дипептид [[радиозумин]], состоит из модифицированных остатков аминокислот, предположительно являющихся метаболическими производными ''пара''-аминофенилаланина с частично гидрированными кольцами.{{.ref|<ref name="CyanobacterialPeptides">{{статья|автор=Martin Welker & Hans von Döhren|заглавие=Cyanobacterial peptides — Nature’s own combinatorial biosynthesis|ссылка=http://www.aseanbiotechnology.info/Abstract/21026380.pdf|язык=en|издание=FEMS Microbiology Reviews|тип=Научный журнал|год=2006|том=30|номер=4|страницы=530—563|doi=10.1111/j.1574-6976.2006.00022.x|issn= |pmid=16774586}}</ref>}} В то же время установлено, что собственные биосинтетические пути разнообразных неароматических структурных производных ароматических аминокислот, таких как 2,5-дигидро-тирозин, 2,5-дигидро-фенилаланин, тетрагидро-тирозин, тетрагидро-фенилаланин, 2,5-дигидро-стильбен, 2-карбокси-6-гидрокси-октагидроиндол (структурный компонент цианобактериального пептида [[эругинозин]]а), [[антикапсин]] (предшественник [[бацилизин]]а), исходят от префената. Известен энзим, префенат-декарбоксилаза, декарбоксилирующий префенат без сопутствующей дегидратации или окисления, что позволяет избежать ароматизации, характерной для более известных метаболических превращений префената. [[Кетомицин]] (антибиотик алициклической структуры) также образуется из префената. |
||
Известны также неароматические продукты, синтезируемые из промежуточных неароматических соединений шикиматного пути. В качестве примера таких продуктов можно назвать [[микоспорины]] (микоспорин-подобные аминокислоты), которые обнаруживаются в таксономически разнообразных морских, пресноводных и наземных организмах. Один из метаболических путей, приводящих к микоспоринам, ответвляется от шикиматного пути на уровне дегидрохинната. Этот путь установлен в экспериментах с аскомицетом ''Trichothecium roseum''. |
Известны также неароматические продукты, синтезируемые из промежуточных неароматических соединений шикиматного пути. В качестве примера таких продуктов можно назвать [[микоспорины]] (микоспорин-подобные аминокислоты), которые обнаруживаются в таксономически разнообразных морских, пресноводных и наземных организмах. Один из метаболических путей, приводящих к микоспоринам, ответвляется от шикиматного пути на уровне дегидрохинната. Этот путь установлен в экспериментах с аскомицетом ''Trichothecium roseum''. |
||
Другой выявленный ([[Цианобактерии|цианеи]]: ''Nostoc punctiforme'', ''Chlorogloeopsis sp.'') путь биосинтеза микоспоринов не использует промежуточные соединения шикиматного пути, но протекает с участием NpR 5600 (2-''эпи''-5-''эпи''-валиолон-синтаза) — гомолога 3-дегидрохиннат-синтазы. Исходным соединением является седогептулозо-7-фосфат — центральный метаболит, соединение, имеющее определённые черты структурного сходства с ДАГФ.{{.ref|<ref name="JoseCarreto">Jose I. Carreto and Mario O. Carignan |
Другой выявленный ([[Цианобактерии|цианеи]]: ''Nostoc punctiforme'', ''Chlorogloeopsis sp.'') путь биосинтеза микоспоринов не использует промежуточные соединения шикиматного пути, но протекает с участием NpR 5600 (2-''эпи''-5-''эпи''-валиолон-синтаза) — гомолога 3-дегидрохиннат-синтазы. Исходным соединением является седогептулозо-7-фосфат — центральный метаболит, соединение, имеющее определённые черты структурного сходства с ДАГФ.{{.ref|<ref name="JoseCarreto">{{статья|автор=Jose I. Carreto and Mario O. Carignan|заглавие=Mycosporine-Like Amino Acids: Relevant Secondary Metabolites. Chemical and Ecological Aspects|ссылка=http://www.mdpi.com/1660-3397/9/3/387/pdf|язык=en|издание=Marine Drugs|тип=Научный журнал|год=2011|том=9|номер=3|страницы=387—446|doi=10.3390/md9030387|issn= |pmid=21556168}}</ref>}} |
||
[[Файл:Биосинтез микоспоринов.png|center|490 px|Пути биосинтеза микоспоринов]] |
[[Файл:Биосинтез микоспоринов.png|center|490 px|Пути биосинтеза микоспоринов]] |
||
Известны также продукты взаимодействия ароматических продуктов шикиматного пути с неароматическими промежуточными соединениями шикиматного же пути. Так, [[Кофеоил-шикимовая кислота|кофеоил-шикимат]] содержит одновременно остаток ароматической [[Кофейная кислота|кофейной кислоты]] и неароматический карбоцикл шикимовой кислоты. Известным производным хинната аналогичного строения является [[Хлорогеновая кислота|хлорогенат]]. |
Известны также продукты взаимодействия ароматических продуктов шикиматного пути с неароматическими промежуточными соединениями шикиматного же пути. Так, [[Кофеоил-шикимовая кислота|кофеоил-шикимат]] содержит одновременно остаток ароматической [[Кофейная кислота|кофейной кислоты]] и неароматический карбоцикл шикимовой кислоты. Известным производным хинната аналогичного строения является [[Хлорогеновая кислота|хлорогенат]]. |
||
| Строка 122: | Строка 122: | ||
[[Термохимия]] и [[Химическая кинетика|кинетика]] отдельных реакций шикиматного пути достаточно хорошо изучены. Проводились специальные [[Химическая термодинамика|термодинамические]] исследования и расчёты. Ниже — данные по отдельным реакциям. |
[[Термохимия]] и [[Химическая кинетика|кинетика]] отдельных реакций шикиматного пути достаточно хорошо изучены. Проводились специальные [[Химическая термодинамика|термодинамические]] исследования и расчёты. Ниже — данные по отдельным реакциям. |
||
{{comment|1|Реакции пронумерованы в логическом порядке (таким образом, продукт предыдущей реакции служит реагентом в последующей)}}). <u>Термодинамика ДАГФ-синтазной реакции</u> {{.ref|<ref name="Energy-1"> |
{{comment|1|Реакции пронумерованы в логическом порядке (таким образом, продукт предыдущей реакции служит реагентом в последующей)}}). <u>Термодинамика ДАГФ-синтазной реакции</u> {{.ref|<ref name="Energy-1">{{статья|автор=Yadu D. Tewari, N. Kishore, R. H. Bauerle, W. R. LaCourse, Robert N. Goldberg|заглавие=Thermochemistry of the Reaction {Phosphoenolpyruvate(aq) + D-Erythrose 4-Phosphate(aq) + H2O(1) = 2-Dehydro-3-Deoxy-D-Arabino-Heptonate 7-Phosphate(aq) + Phosphate(aq)}|ссылка=http://www.nist.gov/manuscript-publication-search.cfm?pub_id=830210|язык=en|издание=Journal of Chemical Thermodynamics|тип=Научный журнал|год=2001|том=33|номер=12|страницы=1791—1805|doi= |issn= |pmid=}}</ref>}} {{.ref|<ref name="NIST">[http://xpdb.nist.gov/enzyme_thermodynamics/enzyme1.pl NIST — Thermodynamics of Enzyme-Catalyzed Reactions]</ref>}} |
||
[[Фосфоенолпируват|ФЕП]](''aq'') + [[D-Эритрозо-4-фосфат|D-Э4Ф]](''aq'') + [[Вода|H<sub>2</sub>O]](''1'') = [[ДАГФ]](''aq'') + [[Ортофосфорная кислота|Ф]](''aq'') |
[[Фосфоенолпируват|ФЕП]](''aq'') + [[D-Эритрозо-4-фосфат|D-Э4Ф]](''aq'') + [[Вода|H<sub>2</sub>O]](''1'') = [[ДАГФ]](''aq'') + [[Ортофосфорная кислота|Ф]](''aq'') |
||
| Строка 144: | Строка 144: | ||
K<sup>{{unicode|ɵ}}</sup> ≈ 7•10<sup>6</sup> |
K<sup>{{unicode|ɵ}}</sup> ≈ 7•10<sup>6</sup> |
||
2). <u>Термодинамика 3-дегидрохиннат-синтазной реакции</u> {{.ref|<ref name="Energy-2"> |
2). <u>Термодинамика 3-дегидрохиннат-синтазной реакции</u> {{.ref|<ref name="Energy-2">{{статья|автор=Yadu D. Tewari, Robert N. Goldberg, Alastair R. Hawkins, Heather K. Lamb|заглавие=A thermodynamic study of the reactions: {2-dehydro-3-deoxy-D-arabino-heptanoate 7-phosphate(aq) = 3-dehydroquinate(aq) + phosphate(aq)} and {3-dehydroquinate(aq) = 3-dehydroshikimate(aq) + H2O(l)}|ссылка=http://elibrary.ru/item.asp?id=1310706|язык=en|издание=Journal of Chemical Thermodynamics|тип=Научный журнал|год=2002|том=34|номер=10|страницы=1671—1691|doi=10.1016/S0021-9614(02)00226-4|issn=0021-9614|pmid=}}</ref>}} {{.ref|<ref name="NIST" />}} |
||
[[ДАГФ]](''aq'') = [[Дегидрохинная кислота|DHQ]](''aq'') + [[Ортофосфорная кислота|Ф]](''aq'') |
[[ДАГФ]](''aq'') = [[Дегидрохинная кислота|DHQ]](''aq'') + [[Ортофосфорная кислота|Ф]](''aq'') |
||
| Строка 196: | Строка 196: | ||
K' = 0.0361 (T = 303.15 K, pH = 7.0, Tris 0.067 моль/дм<sup>3</sup> буфер) |
K' = 0.0361 (T = 303.15 K, pH = 7.0, Tris 0.067 моль/дм<sup>3</sup> буфер) |
||
8). <u> Термодинамика хоризматмутазной реакции</u> {{.ref|<ref name="CSIRO"> |
8). <u> Термодинамика хоризматмутазной реакции</u> {{.ref|<ref name="CSIRO">{{статья|автор=P. R. Andrews and R. C. Haddon|заглавие=Molecular Orbital Studies of Enzyme Catalysed Reactions. Rearrangement of Chorismate to Prephenate|ссылка=http://www.publish.csiro.au/paper/CH9791921.htm|язык=en|издание=Australian Journal of Chemistry|тип=Научный журнал|год=1979|том=32|номер=9|страницы=1921—1929|doi=10.1071/CH9791921|issn= |pmid=}}</ref>}} {{.ref|<ref name="JPhysChemB">{{статья|автор=Peter Kast, Yadu B. Tewari, Olaf Wiest, Donald Hilvert, Kendall N. Houk, Robert N. Goldberg|заглавие=Thermodynamics of the Conversion of Chorismate to Prephenate: Experimental Results and Theoretical Predictions|ссылка=http://pubs.acs.org/doi/pdfplus/10.1021/jp972501l|язык=en|издание=Journal of Physical Chemistry B|тип=Научный журнал|год=1997|том=101|номер=50|страницы=10976—10982|doi=10.1021/jp972501l|issn= |pmid=}}</ref>}} {{.ref|<ref name="NIST" />}} |
||
хоризмат(''aq'') = префенат(''aq'') |
хоризмат(''aq'') = префенат(''aq'') |
||
| Строка 268: | Строка 268: | ||
У эукариот ([[Протисты|простейшие]], [[грибы]]) известен цитоплазматический пентафункциональный белок arom (продукт arom-супергена), сочетающий в одной полипептидной цепи [[Домен белка|домены]] с 3-дегидрохиннат-синтазной (КФ 4.2.3.4), 3-фосфошикимат-1-карбоксивинил-трансферазной (КФ 2.5.1.19), шикимат-киназной (КФ 2.7.1.71), 3-дегидрохиннат-дегидратазной (КФ 4.2.1.10, тип I), и шикимат-дегидрогеназной (КФ 1.1.1.25) активностями (домены перечислены по порядку от N-конца). Таким образом, белок arom осуществляет все пять реакций на пути от ДАГФ к 5-карбоксивинил-шикимат-3-фосфату. Белок arom ''Rhizoctonia solani'' (возбудитель корневой гнили сельскохозяйственных растений) состоит из 1618 аминокислотных остатков и имеет массу 173 кДа, в полностью функциональном состоянии помимо других необходимых кофакторов содержит два иона [[цинк]]а Zn<sup>2+</sup>.{{.ref|<ref name="uniprotarom">[http://www.uniprot.org/uniprot/Q8J294 Uniprot — Pentafunctional AROM polypeptide Rhizoctonia solani]</ref>}} |
У эукариот ([[Протисты|простейшие]], [[грибы]]) известен цитоплазматический пентафункциональный белок arom (продукт arom-супергена), сочетающий в одной полипептидной цепи [[Домен белка|домены]] с 3-дегидрохиннат-синтазной (КФ 4.2.3.4), 3-фосфошикимат-1-карбоксивинил-трансферазной (КФ 2.5.1.19), шикимат-киназной (КФ 2.7.1.71), 3-дегидрохиннат-дегидратазной (КФ 4.2.1.10, тип I), и шикимат-дегидрогеназной (КФ 1.1.1.25) активностями (домены перечислены по порядку от N-конца). Таким образом, белок arom осуществляет все пять реакций на пути от ДАГФ к 5-карбоксивинил-шикимат-3-фосфату. Белок arom ''Rhizoctonia solani'' (возбудитель корневой гнили сельскохозяйственных растений) состоит из 1618 аминокислотных остатков и имеет массу 173 кДа, в полностью функциональном состоянии помимо других необходимых кофакторов содержит два иона [[цинк]]а Zn<sup>2+</sup>.{{.ref|<ref name="uniprotarom">[http://www.uniprot.org/uniprot/Q8J294 Uniprot — Pentafunctional AROM polypeptide Rhizoctonia solani]</ref>}} |
||
Для полноценного функционирования ферментной системы шикиматного пути нужно присутствие определённого набора кофакторов, в том числе двухзарядных ионов металлов (Mg<sup>2+</sup>, Ca<sup>2+</sup>, Mn<sup>2+</sup>, Fe<sup>2+</sup>, Co<sup>2+</sup>, Ni<sup>2+</sup>, Cu<sup>2+</sup>, Zn<sup>2+</sup> и др.). Отдельные энзимы могут быть требовательны к присутствию в среде определённого иона, другие ионы могут оказывать ингибирующее влияние, в случае других энзимов эти ионы в определённой мере взаимозаменяемы. Ферменты, полученные из разных организмов, а порой и изоферменты одного организма, могут сильно отличаться по отношению к активирующим ионам. Например, дегидрохиннат-синтаза ''Pyrococcus furiosus'' проявляет максимальную активность в присутствии Cd<sup>2+</sup> (в присутствии любого другого иона активность ниже или отсутствует), для дегидрохиннат-синтаз из других источников этого не наблюдалось.{{.ref|<ref name="DHQ Synthase Pyrococcus furiosus">{{статья|автор=Leonardo Negron, Mark L. Patchett, and Emily J. Parker|заглавие=Expression, Purification, and Characterisation of Dehydroquinate Synthase from Pyrococcus furiosus|ссылка= |язык=en|издание= |тип= |год=2011|том= |номер= |страницы= |doi=10.4061/2011/134893|issn=}}</ref>}} |
Для полноценного функционирования ферментной системы шикиматного пути нужно присутствие определённого набора кофакторов, в том числе двухзарядных ионов металлов (Mg<sup>2+</sup>, Ca<sup>2+</sup>, Mn<sup>2+</sup>, Fe<sup>2+</sup>, Co<sup>2+</sup>, Ni<sup>2+</sup>, Cu<sup>2+</sup>, Zn<sup>2+</sup> и др.). Отдельные энзимы могут быть требовательны к присутствию в среде определённого иона, другие ионы могут оказывать ингибирующее влияние, в случае других энзимов эти ионы в определённой мере взаимозаменяемы. Ферменты, полученные из разных организмов, а порой и изоферменты одного организма, могут сильно отличаться по отношению к активирующим ионам. Например, дегидрохиннат-синтаза ''Pyrococcus furiosus'' проявляет максимальную активность в присутствии Cd<sup>2+</sup> (в присутствии любого другого иона активность ниже или отсутствует), для дегидрохиннат-синтаз из других источников этого не наблюдалось.{{.ref|<ref name="DHQ Synthase Pyrococcus furiosus">{{статья|автор=Leonardo Negron, Mark L. Patchett, and Emily J. Parker|заглавие=Expression, Purification, and Characterisation of Dehydroquinate Synthase from Pyrococcus furiosus|ссылка= |язык=en|издание= |тип= |год=2011|том= |номер= |страницы= |doi=10.4061/2011/134893|issn= |pmid=21603259}}</ref>}} |
||
Практически все описанные ферменты собственно шикиматного пути (7 реакций) являются мономерными, либо представляют собой гомодимерные, гомотетрамерные, гомогексамерные белки с числом активных центров соответствующим числу субъединиц. Среди различных ферментов дальнейших превращений хоризмата встречаются гетеромерные белки. |
Практически все описанные ферменты собственно шикиматного пути (7 реакций) являются мономерными, либо представляют собой гомодимерные, гомотетрамерные, гомогексамерные белки с числом активных центров соответствующим числу субъединиц. Среди различных ферментов дальнейших превращений хоризмата встречаются гетеромерные белки. |
||
| Строка 276: | Строка 276: | ||
Расположение aro-генов в хромосоме ([[нуклеоид]], [[Макроциклические соединения|кольцевая]] молекула ДНК, 4,6 млн пар нуклеотидов) ''[[Кишечная палочка|Escherichia coli K-12]]'': |
Расположение aro-генов в хромосоме ([[нуклеоид]], [[Макроциклические соединения|кольцевая]] молекула ДНК, 4,6 млн пар нуклеотидов) ''[[Кишечная палочка|Escherichia coli K-12]]'': |
||
aroP ([[Транскрипция (биология)|транскрипция]]: ←, функция: транспорт ароматических аминокислот, расположение на [[Карты хромосом|карте]]: 2,6), aroL (→, шикимат-киназа, 8,7), aroM (→, функция неизвестна, 8,8), aroG (→, ДАГФ-синтаза, регулируемая фенилаланином, 16,9), aroA (→, ЕПШФ-синтаза, 20,7), aroT (—, indole acrylic acid resistant mutants, transport, 28,3), aroD (→, 3-дегидрохиннат-дегидратаза, 38,2), aroH (→, ДАГФ-синтаза, регулируемая триптофаном, 38,5), aroC (←, хоризмат-синтаза, 52,7), aroF (←, ДАГФ-синтаза, регулируемая тирозином, 59,0), aroE (←, дегидрошикимат-редуктаза, 73,9), aroKB (←, шикимат-киназа/3-дегидрохиннат-синтаза, 75,8), aroI (—, функция неизвестна, 84,2).{{.ref|<ref name=" |
aroP ([[Транскрипция (биология)|транскрипция]]: ←, функция: транспорт ароматических аминокислот, расположение на [[Карты хромосом|карте]]: 2,6), aroL (→, шикимат-киназа, 8,7), aroM (→, функция неизвестна, 8,8), aroG (→, ДАГФ-синтаза, регулируемая фенилаланином, 16,9), aroA (→, ЕПШФ-синтаза, 20,7), aroT (—, indole acrylic acid resistant mutants, transport, 28,3), aroD (→, 3-дегидрохиннат-дегидратаза, 38,2), aroH (→, ДАГФ-синтаза, регулируемая триптофаном, 38,5), aroC (←, хоризмат-синтаза, 52,7), aroF (←, ДАГФ-синтаза, регулируемая тирозином, 59,0), aroE (←, дегидрошикимат-редуктаза, 73,9), aroKB (←, шикимат-киназа/3-дегидрохиннат-синтаза, 75,8), aroI (—, функция неизвестна, 84,2).{{.ref|<ref name="Map of Escherichia">{{статья|автор=Mary K. B. Berlyn|заглавие=Linkage map of Escherichia coli K-12, edition 10: the traditional map|ссылка=http://www.biochem.wisc.edu/faculty/weibel/lab/methods/Linkage_Map_Ed10_1998_tradional.pdf|язык=en|издание=Microbiology and molecular biology reviews|тип=Научный журнал|год=1998|том=62|номер=3|страницы=814—984|doi= |issn= |pmid=9729611}}</ref>}} |
||
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 5842795 пар нуклеотидов) ''Microcystis aeruginosa NIES-843'': |
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 5842795 пар нуклеотидов) ''Microcystis aeruginosa NIES-843'': |
||
ccmA (транскрипция: →, функция: ДАГФ-синтаза, положение в хромосоме: 557559..558614), aroA (→, ЕПШФ-синтаза, 1380521..1381861), aroC (←, хоризмат-синтаза, 1707983..1709083), aroK (→, шикимат-киназа, 1927033..1927605), aroB (→, 3-дегидрохиннат-синтаза, 2361918..2363018), aroQ (←, 3-дегидрохиннат-дегидратаза, 2783501..2783974), aroE (→, шикимат-дегидрогеназа, 3416423..3417283).{{.ref|<ref name="NCBI Microcystis aeruginosa"> NCBI — Chorismate biosynthesis biosystem Microcystis aeruginosa NIES-843 |
ccmA (транскрипция: →, функция: ДАГФ-синтаза, положение в хромосоме: 557559..558614), aroA (→, ЕПШФ-синтаза, 1380521..1381861), aroC (←, хоризмат-синтаза, 1707983..1709083), aroK (→, шикимат-киназа, 1927033..1927605), aroB (→, 3-дегидрохиннат-синтаза, 2361918..2363018), aroQ (←, 3-дегидрохиннат-дегидратаза, 2783501..2783974), aroE (→, шикимат-дегидрогеназа, 3416423..3417283).{{.ref|<ref name="NCBI Microcystis aeruginosa">[http://www.ncbi.nlm.nih.gov/biosystems/418700 NCBI — Chorismate biosynthesis biosystem Microcystis aeruginosa NIES-843]</ref>}} |
||
Расположение генов шикиматного пути в хромосоме (нуклеоид, линейная или псевдокольцевая молекула ДНК, 9025608 пар нуклеотидов) ''[[Streptomyces avermitilis|Streptomyces avermitilis MA-4680]]'': |
Расположение генов шикиматного пути в хромосоме (нуклеоид, линейная или псевдокольцевая молекула ДНК, 9025608 пар нуклеотидов) ''[[Streptomyces avermitilis|Streptomyces avermitilis MA-4680]]'': |
||
aroE (функция: шикимат-дегидрогеназа, положение в хромосоме: 2173767..2174642, complement), aroA (ЕПШФ-синтаза, 3800068..3801408), aroG (ДАГФ-синтаза, 7323905..7325257), aroD (дегидрохиннат-дегидратаза, 7538791..7539270), aroE (шикимат-дегидрогеназа, 8180666..8181502), aroC (хоризмат-синтаза, 8181892..8183076), aroK (шикимат-киназа, 8183073..8183588), aroB (3-дегидрохиннат-синтаза, 8183585..8184676).{{.ref|<ref name="NCBI Streptomyces avermitilis"> NCBI — Chorismate biosynthesis biosystem Streptomyces avermitilis MA-4680 |
aroE (функция: шикимат-дегидрогеназа, положение в хромосоме: 2173767..2174642, complement), aroA (ЕПШФ-синтаза, 3800068..3801408), aroG (ДАГФ-синтаза, 7323905..7325257), aroD (дегидрохиннат-дегидратаза, 7538791..7539270), aroE (шикимат-дегидрогеназа, 8180666..8181502), aroC (хоризмат-синтаза, 8181892..8183076), aroK (шикимат-киназа, 8183073..8183588), aroB (3-дегидрохиннат-синтаза, 8183585..8184676).{{.ref|<ref name="NCBI Streptomyces avermitilis">[http://www.ncbi.nlm.nih.gov/biosystems/442939 NCBI — Chorismate biosynthesis biosystem Streptomyces avermitilis MA-4680]</ref>}} |
||
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 4093599 пар нуклеотидов) ''[[Сенная палочка|Bacillus subtilis BSn5]]'': |
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 4093599 пар нуклеотидов) ''[[Сенная палочка|Bacillus subtilis BSn5]]'': |
||
| Строка 292: | Строка 292: | ||
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 1664970 пар нуклеотидов) ''Methanocaldococcus jannaschii DSM 2661'': |
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 1664970 пар нуклеотидов) ''Methanocaldococcus jannaschii DSM 2661'': |
||
MJ_0246 (транскрипция: ←, функция: хоризматмутаза, положение в хромосоме: 233695..233994), MJ_0400 (→, ortholog fructose-bisphosphate aldolase, 361590..362411), MJ_0502 (→, ЕПШФ-синтаза, 443159..444448), MJ_1084 (aroE) (→, шикимат-дегидрогеназа, 1022757..1023605), MJ_1175 (←, хоризмат-синтаза, 1113783..1114919), MJ_1249 (→, 3-дегидрохиннат-синтаза, 1191364..1192449), MJ_1440 (→, шикимат-киназа, 1407283..1408131), MJ_1454 (aroD) (←, 3-дегидрохиннат-дегидратаза, 1423963..1424625).{{.ref|<ref name="NCBI Methanocaldococcus jannaschii">NCBI — Phenylalanine, tyrosine and tryptophan biosynthesis — Methanocaldococcus jannaschii DSM 2661 |
MJ_0246 (транскрипция: ←, функция: хоризматмутаза, положение в хромосоме: 233695..233994), MJ_0400 (→, ortholog fructose-bisphosphate aldolase, 361590..362411), MJ_0502 (→, ЕПШФ-синтаза, 443159..444448), MJ_1084 (aroE) (→, шикимат-дегидрогеназа, 1022757..1023605), MJ_1175 (←, хоризмат-синтаза, 1113783..1114919), MJ_1249 (→, 3-дегидрохиннат-синтаза, 1191364..1192449), MJ_1440 (→, шикимат-киназа, 1407283..1408131), MJ_1454 (aroD) (←, 3-дегидрохиннат-дегидратаза, 1423963..1424625).{{.ref|<ref name="NCBI Methanocaldococcus jannaschii">[http://www.ncbi.nlm.nih.gov/biosystems/704 NCBI — Phenylalanine, tyrosine and tryptophan biosynthesis — Methanocaldococcus jannaschii DSM 2661]</ref>}} |
||
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 1669696 пар нуклеотидов) ''Aeropyrum pernix K1'': |
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 1669696 пар нуклеотидов) ''Aeropyrum pernix K1'': |
||
aroC (транскрипция: ←, функция: хоризмат-синтаза, положение в хромосоме: 384859..386001), aroA (←, ЕПШФ-синтаза, 385991..387274), aroK (←, шикимат-киназа, 387262..388104), aroE (←, шикимат-дегидрогеназа, 388104..388925), aroD (←, дегидрохиннат-дегидратаза, 388922..389590), aroB (←, 3-дегидрохиннат-синтаза, 389597..390673), aroG (←, ДАГФ-синтаза, 390655..391467), aroA (←, ЕПШФ-синтаза, 892465..893724).{{.ref|<ref name="NCBI Aeropyrum pernix"> |
aroC (транскрипция: ←, функция: хоризмат-синтаза, положение в хромосоме: 384859..386001), aroA (←, ЕПШФ-синтаза, 385991..387274), aroK (←, шикимат-киназа, 387262..388104), aroE (←, шикимат-дегидрогеназа, 388104..388925), aroD (←, дегидрохиннат-дегидратаза, 388922..389590), aroB (←, 3-дегидрохиннат-синтаза, 389597..390673), aroG (←, ДАГФ-синтаза, 390655..391467), aroA (←, ЕПШФ-синтаза, 892465..893724).{{.ref|<ref name="NCBI Aeropyrum pernix">[http://www.ncbi.nlm.nih.gov/biosystems/381768 NCBI — Chorismate biosynthesis biosystem Aeropyrum pernix K1]</ref>}} |
||
Расположение генов шикиматного пути в хромосомах ''[[Saccharomyces cerevisiae|Saccharomyces cerevisiae S288c]]'' ([[Плоидность|гаплоидное]] число [[Хромосома|хромосом]] — 16): {{.ref|<ref name="NCBI Saccharomyces cerevisiae"> |
Расположение генов шикиматного пути в хромосомах ''[[Saccharomyces cerevisiae|Saccharomyces cerevisiae S288c]]'' ([[Плоидность|гаплоидное]] число [[Хромосома|хромосом]] — 16): {{.ref|<ref name="NCBI Saccharomyces cerevisiae">[http://www.ncbi.nlm.nih.gov/biosystems/438635 NCBI — Chorismate biosynthesis biosystem Saccharomyces cerevisiae S288c]</ref>}} |
||
{| class="wide sortable" |
{| class="wide sortable" |
||
| Строка 478: | Строка 478: | ||
|Фосфоенолпируват||1934||K. Lohmann, O. Meyerhof {{.ref|<ref name="Phosphobrenztraubensaure">{{статья|автор=K. Lohmann, O. Meyerhof|заглавие=Über die enzymatische Umwandlung von Phosphoglycerinsäure in Brenztraubensäure und Phosphorsäure|ссылка= |язык=de|издание=Biochem. Zeit.|тип=Научный журнал|год=1934|том=273|номер= |страницы= |doi= |issn=}}</ref>}} {{.ref|<ref name="History of biochemistry">{{книга|автор=Giorgio Semenza, Anthony John Turner|часть= |ссылка часть= |заглавие=Selected Topics In The History Of Biochemistry: Personal Recollections IX|оригинал= |ссылка=http://books.google.ru/books?id=UNtmROveRE8C&printsec=frontcover&hl=ru#v=onepage&q&f=false|викитека= |ответственный=Giorgio Semenza|издание= |место=Amsterdam, London|издательство=Elsevier, Gulf Professional Publishing|год=2005|том=44|страницы= |страниц=438|серия=Comprehensive Biochemistry|isbn=0-444-51866-5|тираж= }}</ref>}} |
|Фосфоенолпируват||1934||K. Lohmann, O. Meyerhof {{.ref|<ref name="Phosphobrenztraubensaure">{{статья|автор=K. Lohmann, O. Meyerhof|заглавие=Über die enzymatische Umwandlung von Phosphoglycerinsäure in Brenztraubensäure und Phosphorsäure|ссылка= |язык=de|издание=Biochem. Zeit.|тип=Научный журнал|год=1934|том=273|номер= |страницы= |doi= |issn=}}</ref>}} {{.ref|<ref name="History of biochemistry">{{книга|автор=Giorgio Semenza, Anthony John Turner|часть= |ссылка часть= |заглавие=Selected Topics In The History Of Biochemistry: Personal Recollections IX|оригинал= |ссылка=http://books.google.ru/books?id=UNtmROveRE8C&printsec=frontcover&hl=ru#v=onepage&q&f=false|викитека= |ответственный=Giorgio Semenza|издание= |место=Amsterdam, London|издательство=Elsevier, Gulf Professional Publishing|год=2005|том=44|страницы= |страниц=438|серия=Comprehensive Biochemistry|isbn=0-444-51866-5|тираж= }}</ref>}} |
||
|- |
|- |
||
|Эритрозо-4-фосфат||1953||{{comment|B. L. Horecker, P. Z. Smyrniotis|Постулировали эритрозо-4-фосфат как участник углеводного метаболизма, при этом не обнаружив его. Вещество было изолировано в 1955 году (Srere, Kornberg, Racker), была показана идентичность полученному в том же году (Fischer, MacDonald, Ballou) синтетическому образцу, было продемонстрировано участие в метаболизме углеводов.}} {{.ref|<ref name="Horecker Smyrniotis">{{статья|автор=B. L. Horecker, P. Z. Smyrniotis|заглавие=Transaldolase: the formation |
|Эритрозо-4-фосфат||1953||{{comment|B. L. Horecker, P. Z. Smyrniotis|Постулировали эритрозо-4-фосфат как участник углеводного метаболизма, при этом не обнаружив его. Вещество было изолировано в 1955 году (Srere, Kornberg, Racker), была показана идентичность полученному в том же году (Fischer, MacDonald, Ballou) синтетическому образцу, было продемонстрировано участие в метаболизме углеводов.}} {{.ref|<ref name="Horecker Smyrniotis">{{статья|автор=B. L. Horecker, P. Z. Smyrniotis|заглавие=Transaldolase: the formation of fructose-6-phosphate from sedoheptulose-7-phosphate|ссылка=http://pubs.acs.org/doi/abs/10.1021/ja01104a532|язык=en|издание=Journal of the American Chemical Society|тип=Научный журнал|год=1953|том=75|номер=8|страницы=2021—2022|doi=10.1021/ja01104a532|issn=0002-7863}}</ref>}} {{.ref|<ref name="The 342nd Meeting of the Biochemical Society">Proceedings of the Biochemical Society. The 342nd Meeting of the Biochemical Society, Department of Agricultural Chemistry, University College of North Wales, Bangor, on 15 July 1955 [http://www.biochemj.org/bj/061/i/061i_1.pdf]</ref>}} |
||
|- |
|- |
||
| || || |
| || || |
||
| Строка 494: | Строка 494: | ||
!Соединение||Год||Исследователь |
!Соединение||Год||Исследователь |
||
|- |
|- |
||
|ДАГФ||1959 ({{comment|1958|Работа, в которой впервые описывается обнаружение вещества, поступила в редакцию журнала для публикации}})||P. R. Srinivasan, D. B. Sprinson {{.ref|<ref name="Srinivasan Sprinson">{{статья|автор=P. R. Srinivasan and D. B. Sprinson|заглавие=2-Keto-3-deoxy-D-arabo-heptonic Acid 7-Phosphate Synthetase|ссылка=http://intl.jbc.org/content/234/4/716.full.pdf+html|язык=en|издание=Journal of Biological Chemistry|тип=Научный журнал|год=1959|том=234|номер=4|страницы=716—722|doi= |issn=}}</ref>}} |
|ДАГФ||1959 ({{comment|1958|Работа, в которой впервые описывается обнаружение вещества, поступила в редакцию журнала для публикации}})||P. R. Srinivasan, D. B. Sprinson {{.ref|<ref name="Srinivasan Sprinson">{{статья|автор=P. R. Srinivasan and D. B. Sprinson|заглавие=2-Keto-3-deoxy-D-arabo-heptonic Acid 7-Phosphate Synthetase|ссылка=http://intl.jbc.org/content/234/4/716.full.pdf+html|язык=en|издание=Journal of Biological Chemistry|тип=Научный журнал|год=1959|том=234|номер=4|страницы=716—722|doi= |issn= |pmid=13654249}}</ref>}} |
||
|- |
|- |
||
|3-Дегидрохиннат||1953||B. D. Davis, U. Weiss, E. S. Mingioli {{.ref|<ref name="Aromatic Biosynthesis VIII">{{статья|автор=B. Davis, U. Weiss|заглавие=Aromatic biosynthesis. VIII. The roles of 5-dehydroquinic acid and quinic acid|ссылка= |язык=en|издание=Naunyn-Schmiedebergs Archiv für Experimentelle Pathologie und Pharmakologie|тип=Научный журнал|год=1953|том=220|номер=1—2|страницы=1—15|doi= |issn= |pmid=13132923}}</ref>}} {{.ref|<ref name="Aromatic Biosynthesis X Dehydroquinic Identification">{{статья|автор=Ulrich Weiss, Bernard D. Davis, Elizabeth S. Mingioli|заглавие=Aromatic Biosynthesis. X. Identification of an Early Precursor as 5-Dehydroquinic Acid|ссылка= |язык=en|издание=Journal of the American Chemical Society|тип=Научный журнал|год=1953|том=75|номер=22|страницы=5572—5576|doi=10.1021/ja01118a028|issn=}}</ref>}} |
|3-Дегидрохиннат||1953||B. D. Davis, U. Weiss, E. S. Mingioli {{.ref|<ref name="Aromatic Biosynthesis VIII">{{статья|автор=B. Davis, U. Weiss|заглавие=Aromatic biosynthesis. VIII. The roles of 5-dehydroquinic acid and quinic acid|ссылка= |язык=en|издание=Naunyn-Schmiedebergs Archiv für Experimentelle Pathologie und Pharmakologie|тип=Научный журнал|год=1953|том=220|номер=1—2|страницы=1—15|doi= |issn= |pmid=13132923}}</ref>}} {{.ref|<ref name="Aromatic Biosynthesis X Dehydroquinic Identification">{{статья|автор=Ulrich Weiss, Bernard D. Davis, Elizabeth S. Mingioli|заглавие=Aromatic Biosynthesis. X. Identification of an Early Precursor as 5-Dehydroquinic Acid|ссылка= |язык=en|издание=Journal of the American Chemical Society|тип=Научный журнал|год=1953|том=75|номер=22|страницы=5572—5576|doi=10.1021/ja01118a028|issn=}}</ref>}} |
||
| Строка 502: | Строка 502: | ||
|[[Шикимовая кислота|Шикимат]]||1885 ({{comment|1884|По указанию самого автора, впервые выделившего и описавшего вещество}})||J. F. Eykman {{.ref|<ref name="Shikimic Acid discovery">{{статья|автор=J. F. Eijkman|заглавие= Sur les principes constituants de l'Illicium religiosum (Sieb.) (Shikimi-no-ki en japonais)|ссылка=http://cybra.lodz.pl/publication/163|язык=fr|издание=Recueil des Travaux Chimiques des Pays-Bas|тип=Научный журнал|год=1885|том=4|номер= |страницы=49—53|doi= |issn=}}</ref>}} {{.ref|<ref name="Chemical Synthesis of Shikimic Acid">{{статья|автор=Shende Jiang, Gurdial Singh|заглавие=Chemical Synthesis of Shikimic Acid and Its Analogues|ссылка=http://jiang.tju.edu.cn/pdfs/shikimic-review.pdf|язык=en|издание=Tetrahedron|тип=Научный журнал|год=1998|том=54|номер=19|страницы=4697—4753|doi= |issn=}}</ref>}} |
|[[Шикимовая кислота|Шикимат]]||1885 ({{comment|1884|По указанию самого автора, впервые выделившего и описавшего вещество}})||J. F. Eykman {{.ref|<ref name="Shikimic Acid discovery">{{статья|автор=J. F. Eijkman|заглавие= Sur les principes constituants de l'Illicium religiosum (Sieb.) (Shikimi-no-ki en japonais)|ссылка=http://cybra.lodz.pl/publication/163|язык=fr|издание=Recueil des Travaux Chimiques des Pays-Bas|тип=Научный журнал|год=1885|том=4|номер= |страницы=49—53|doi= |issn=}}</ref>}} {{.ref|<ref name="Chemical Synthesis of Shikimic Acid">{{статья|автор=Shende Jiang, Gurdial Singh|заглавие=Chemical Synthesis of Shikimic Acid and Its Analogues|ссылка=http://jiang.tju.edu.cn/pdfs/shikimic-review.pdf|язык=en|издание=Tetrahedron|тип=Научный журнал|год=1998|том=54|номер=19|страницы=4697—4753|doi= |issn=}}</ref>}} |
||
|- |
|- |
||
|Фосфошикимат||1953||B. D. Davis, E. S. Mingioli, U. Weiss {{.ref|<ref name="Z1 Z2 registration">{{статья|автор=Bernard D. Davis and Elizabeth S. Mingioli|заглавие=Aromatic biosynthesis. VII. Accumulation of two derivatives of shikimic acid by bacterial mutants|ссылка=http://jb.asm.org/content/66/2/129.full.pdf+html|язык=en|издание=Journal of Bacteriology|тип=Научный журнал|год=1953|том=66|номер=2|страницы=129—136|doi= |issn=}}</ref>}} {{.ref|<ref name="Phosphoshikimic Isolation">{{статья|автор=Ulrich Weiss, Elizabeth S. Mingioli|заглавие=Aromatic Biosynthesis. XV. The Isolation and Identification of Shikimic Acid 5-Phosphate|ссылка= |язык=en|издание=Journal of the American Chemical Society|тип=Научный журнал|год=1956|том=78|номер=12|страницы=2894—2898|doi=10.1021/ja01593a067|issn=}}</ref>}} |
|Фосфошикимат||1953||B. D. Davis, E. S. Mingioli, U. Weiss {{.ref|<ref name="Z1 Z2 registration">{{статья|автор=Bernard D. Davis and Elizabeth S. Mingioli|заглавие=Aromatic biosynthesis. VII. Accumulation of two derivatives of shikimic acid by bacterial mutants|ссылка=http://jb.asm.org/content/66/2/129.full.pdf+html|язык=en|издание=Journal of Bacteriology|тип=Научный журнал|год=1953|том=66|номер=2|страницы=129—136|doi= |issn= |pmid=13084547}}</ref>}} {{.ref|<ref name="Phosphoshikimic Isolation">{{статья|автор=Ulrich Weiss, Elizabeth S. Mingioli|заглавие=Aromatic Biosynthesis. XV. The Isolation and Identification of Shikimic Acid 5-Phosphate|ссылка= |язык=en|издание=Journal of the American Chemical Society|тип=Научный журнал|год=1956|том=78|номер=12|страницы=2894—2898|doi=10.1021/ja01593a067|issn=}}</ref>}} |
||
|- |
|- |
||
|ЕПШФ||1960 (<font color="#c0c0c0">{{comment|1953|Был обнаружен дефосфорилированый метаболит (Z1, енолпирувилшикимат), как выяснилось, не являющийся участником нормального метаболизма}}</font>)||J. G. Levin, D. B. Sprinson, M. J. Clark {{.ref|<ref name="Z1 Z2 registration" />}} {{.ref|<ref name="EPSP formation">{{статья|автор= J. G. Levin, D. B. Sprinson|заглавие=The formation of 3-enolpyruvyl shikimate 5-phosphate in extracts of Escherichia coli|ссылка= |язык=en|издание=Biochemical and Biophysical Research Communications|тип=Научный журнал|год=1960|том=3|номер= |страницы=157—163|doi= |issn=}}</ref>}} |
|ЕПШФ||1960 (<font color="#c0c0c0">{{comment|1953|Был обнаружен дефосфорилированый метаболит (Z1, енолпирувилшикимат), как выяснилось, не являющийся участником нормального метаболизма}}</font>)||J. G. Levin, D. B. Sprinson, M. J. Clark {{.ref|<ref name="Z1 Z2 registration" />}} {{.ref|<ref name="EPSP formation">{{статья|автор= J. G. Levin, D. B. Sprinson|заглавие=The formation of 3-enolpyruvyl shikimate 5-phosphate in extracts of Escherichia coli|ссылка= |язык=en|издание=Biochemical and Biophysical Research Communications|тип=Научный журнал|год=1960|том=3|номер= |страницы=157—163|doi= |issn= |pmid=14416213}}</ref>}} |
||
|- |
|- |
||
|[[Хоризмовая кислота|Хоризмат]]||1963||Frank Gibson, Lloyd Jackman {{.ref|<ref name="Gibson Jackman">{{статья|автор=F. Gibson and L. M. Jackman|заглавие=Structure of chorismic acid, a new intermediate in aromatic biosynthesis|ссылка= |язык=en|издание=Nature|тип=Научный журнал|год=1963|том=198|номер= |страницы=388—389|doi= |issn=}}</ref>}} |
|[[Хоризмовая кислота|Хоризмат]]||1963||Frank Gibson, Lloyd Jackman {{.ref|<ref name="Gibson Jackman">{{статья|автор=F. Gibson and L. M. Jackman|заглавие=Structure of chorismic acid, a new intermediate in aromatic biosynthesis|ссылка= |язык=en|издание=Nature|тип=Научный журнал|год=1963|том=198|номер= |страницы=388—389|doi= |issn= |pmid=13947720}}</ref>}} |
||
|} |
|} |
||
| |
| |
||
| Строка 512: | Строка 512: | ||
!Соединение||Год||Исследователь |
!Соединение||Год||Исследователь |
||
|- |
|- |
||
|[[Префеновая кислота|Префенат]]||1954||B. D. Davis, U. Weiss и др.{{.ref|<ref name="Aromatic biosynthesis XI">{{статья|автор=U. Weiss, C. Gilvarg, E. S. Mingioli, B. D. Davis|заглавие=Aromatic biosynthesis XI. The aromatization step in the synthesis of phenylalanine|ссылка= |язык=en|издание=Science|тип=Научный журнал|год=1954|том=119|номер= |страницы=774—775|doi=10.1126/science.119.3100.774|issn=}}</ref>}} |
|[[Префеновая кислота|Префенат]]||1954||B. D. Davis, U. Weiss и др.{{.ref|<ref name="Aromatic biosynthesis XI">{{статья|автор=U. Weiss, C. Gilvarg, E. S. Mingioli, B. D. Davis|заглавие=Aromatic biosynthesis XI. The aromatization step in the synthesis of phenylalanine|ссылка= |язык=en|издание=Science|тип=Научный журнал|год=1954|том=119|номер= |страницы=774—775|doi=10.1126/science.119.3100.774|issn= |pmid=13168367}}</ref>}} |
||
|- |
|- |
||
|Арогенат||1974||S. L. Stenmark и др.{{.ref|<ref name="Pretyrosine Pathway discovery">{{статья|автор=Sherry L. Stenmark, Duane L. Pierson, Roy A. Jensen, George I. Glover|заглавие=Blue-Green Bacteria synthesise L-Tyrosine by the Pretyrosine Pathway|ссылка= |язык=en|издание=Nature|тип=Научный журнал|год=1974|том=247|номер= |страницы=290—292|doi=10.1038/247290a0|issn=}}</ref>}} |
|Арогенат||1974||S. L. Stenmark и др.{{.ref|<ref name="Pretyrosine Pathway discovery">{{статья|автор=Sherry L. Stenmark, Duane L. Pierson, Roy A. Jensen, George I. Glover|заглавие=Blue-Green Bacteria synthesise L-Tyrosine by the Pretyrosine Pathway|ссылка= |язык=en|издание=Nature|тип=Научный журнал|год=1974|том=247|номер= |страницы=290—292|doi=10.1038/247290a0|issn= |pmid=4206476}}</ref>}} |
||
|- |
|- |
||
|[[Антраниловая кислота|Антранилат]]||1840||{{comment|Ю. Ф. Фрицше|Получил разложением индиго. Метаболическую роль обнаружил Б. Дэвис в 1950 году.}} |
|[[Антраниловая кислота|Антранилат]]||1840||{{comment|Ю. Ф. Фрицше|Получил разложением индиго. Метаболическую роль обнаружил Б. Дэвис в 1950 году.}} |
||
Версия от 23:41, 4 февраля 2013
Шикима́тный путь — метаболический путь, промежуточным метаболитом которого является шикимовая кислота (шикимат). Шикиматный путь отмечается как специализированный путь биосинтеза бензоидных ароматических соединений (очень часто в этом качестве наряду с шикиматным путём отмечается также поликетидный (ацетатно-малонатный) механизм построения бензольных ядер). Шикиматным путём в природе синтезируются такие известные соединения, как фенилаланин, тирозин, триптофан, бензоат, салицилат. Шикиматный путь является источником ароматических предшественников терпеноидных хинонов (убихинонов, пластохинонов, менахинонов, филлохинонов), токоферолов, фолата, лигнинов, меланинов, таннинов и огромного множества других соединений, играющих в природе различную роль. Шикиматный путь — один из древнейших эволюционно-консервативных метаболических путей; как источник фундаментальных составляющих (в первую очередь — трёх протеиногенных аминокислот) живой материи фактически представляет собой часть первичного метаболизма. Значение шикиматного пути велико, так как этот путь является единственным установленным путём биосинтеза ряда важнейших природных соединений, в том числе значимых в плане их практического использования.
История открытия и изучения
В 1935 году немецкий химик-органик Германн Отто Лауренц Фишер (1888—1960) отметил, что кислоты хинная и шикимовая могут быть метаболически тесно связанными с бензоидными ароматическими соединениями, в частности, с галловой кислотой.Шаблон:.ref Для хинной кислоты была известна биологическая ароматизация (при участии микроорганизмов наблюдали образование из хинной кислоты некоторых фенольных соединений, а также было показано, что хинная кислота в организме млекопитающих метаболизируется в гиппуровую кислоту). Однако всё же чёткого подтверждения того, что гидроароматические кислоты являются естественными предшественниками природных ароматических соединений не существовало до 1950-х годов.Шаблон:.ref
В 1950 году американский микробиолог Бернард Дэвис (1916—1994), применяя ультрафиолетовое облучение, используя метод отбора с применением пенициллина, получил серию мутантов Escherichia coli, способных расти лишь в такой питательной среде, в которую добавлялись ароматические соединения. Многие мутанты нуждались в фенилаланине, тирозине, триптофане, пара-аминобензоате и пара-гидроксибензоате (в следовых количествах). Неожиданно оказалось, что потребность во всех пяти соединениях можно удовлетворить путём добавления шикимовой кислоты (шикимата), в то время считавшейся редким соединением, встречающимся лишь у некоторых растений. Другая группа полученных Дэвисом мутантов не отвечала на добавляемый шикимат как на заменяющий ароматические соединения фактор роста, и обнаружилось, что некоторые из этих мутантов сами накапливали в культуральной среде шикимовую кислоту. Мутанты разных групп могли синтрофно расти на минимальной питательной среде.Шаблон:.ref Шаблон:.ref
Таким образом, шикимат, который отнюдь не является ароматическим соединением, оказался промежуточным продуктом в процессах биосинтеза трёх ароматических протеиногенных аминокислот, пара-аминобензоата и других существенных ароматических соединений.Шаблон:.ref Очевидно, у некоторых полученных Дэвисом мутантов был нарушен синтез шикимата, тогда как у других мутантов были блокированы более поздние стадии метаболического процесса.
При помощи ауксотрофных мутантов Escherichia coli, Aerobacter aerogenes и Neurospora и с применением изотопно-меченых соединений был прослежен весь путь от углеводных предшественников до первичных и вторичных метаболитов ароматической природы.Шаблон:.ref Промежуточные соединения удавалось обнаружить и изолировать благодаря тому, что определённые мутанты их накапливали. Эксперименты с мутантами и выделяемыми ими соединениями позволяли выстраивать эти соединения в цепочку и отмечать в этой цепочке места недостающих метаболитов. Установить начальные этапы пути, связывающие его с известными путями, было значительно сложнее. Мутантный штамм Escherichia coli, накапливающий в культуральной среде шикимовую кислоту, выращивали на средах, содержащих в качестве единственного источника углерода 14C-меченую по определённым позициям глюкозу и другие соединения. После этого шикимовую кислоту выделяли. Распределение радиоактивных меток определялось путём ступенчатой химической деструкции. Анализ полученных результатов привёл к выводу, что три из семи атомов углерода молекулы шикимовой кислоты приходят из гликолиза, остальные четыре — из пентозофосфатного пути.Шаблон:.ref Природа исходных соединений была выяснена, когда стал доступен синтетический Шаблон:.ref эритрозо-4-фосфат. Было показано, что клеточные экстракты Escherichia coli легко конвертируют этритрозо-4-фосфат и фосфоенолпируват в дегидрохиннат.Шаблон:.ref Сначала предположили, а затем экспериментально установили, что промежуточным соединением является семиуглеродный продукт конденсации — соединение, которое теперь известно как ДАГФ.Шаблон:.ref Также при помощи радиоизотопных меток было показано, что экспериментально наблюдаемое почти количественное превращение под действием бактериальных клеточных экстрактов седогептулозо-1,7-дифосфата в дегидрошикимат или шикимат Шаблон:.ref не может быть объяснено преобразованием цельной молекулы, без промежуточного расщепления её на C4 и C3-фрагменты.Шаблон:.ref
Важнейшая часть работы по расшифровке пути была проделана Бернардом Дэвисом в сотрудничестве с Дэвидом Спринсоном (1910—2007) из Колумбийского университета.Шаблон:.ref Значительный вклад в изучение отдельных стадий процесса внесли также австралийцы Франк Гибсон (1923—2008), Джеймс Питтард и многие другие исследователи. Полная картина метаболического пути стала ясна в 1963—1964 г., когда Франк Гибсон наконец выделил и изучил долго ускользавшую от наблюдения субстанцию «compound X» — недостающий промежуточный метаболит, структура которого до этого уже была предсказана (впоследствии подтверждена Ллойдом Джэкмэном при помощи ЯМР-спектроскопии). По предложению своего тестя это соединение Гибсон назвал хоризматом (хоризмовой кислотой). Гипотеза Дэвиса (5-карбоксивинил-шикимат-3-фосфат, или как его тогда называли «Z1-phosphate» — предшественник как фенилаланина, тирозина, так и триптофана) была доказана, гипотеза Спринсона (последний общий предшественник трёх ароматических аминокислот — фосфошикимовая кислота) подтверждения не получила.Шаблон:.ref
Сринивасан, Катажири, Спринсон, Майтра установили путь через ДАГФ, долго считавшийся единственным. В 2004 году были опубликованы результаты исследований американского биохимика Роберта Уайта по рассшифровке пути через ДКФФ.Шаблон:.ref Однако предложенная Уайтом гипотетическая схема биосинтеза ДКФФ впоследствии не подтвердилась. В 2006 году Роберт Уайт и Сюй Хуэйминь сообщили, что им удалось выяснить истинный путь биосинтеза ДКФФ у Methanocaldococcus jannaschii.Шаблон:.ref
Название пути
Название «шикиматный путь» (the shikimate pathway), также можно встретить «путь шикимовой кислоты» (the shikimic acid pathway), было определено исторически (изучение началось с установления метаболической роли шикимовой кислоты, см. выше). В 1979 году H. G. Floss, желая подчеркнуть ключевую роль и мультипотентность другого важнейшего промежуточного соединения (хоризмата), предложил название «the chorismate pathway». Ввиду того, что хоризмат находится хотя и важнейшей, но не единственной точке ветвления цепочки химических превращений, и в силу того, что старое название к тому времени уже хорошо закрепилось, подобное переименование было признано контрпродуктивным и от него отказались. Другое возможное название, «the aromatic pathway», также было отвергнуто, так как многие ароматические соединения синтезируются иными путями, некоторые же неароматические продукты синтезируются из шикиматных предшественников, минуя стадию ароматизации.Шаблон:.ref
Годы открытия основных соединений смотри в приложении .
Распространённость и локализация
Шикиматный путь осуществляется в клетках прокариот (как бактерий, так и архей) и эукариот (грибов, растений, всевозможных протистов, но не животных). У растений реакции шикиматного пути проходят в цитозоле и, практически независимо,Шаблон:.ref в пластидах (главным образом в хлоропластах), однако гены практически всех ферментов локализованы в ядре; при нормальных условиях роста около 20 % всего усваиваемого растением углерода протекает этим путём.Шаблон:.ref Шаблон:.ref У организмов, клетки которых не содержат пластиды, шикиматный путь протекает в цитозоле. Многоклеточные животные (Metazoa) не имеют ферментной системы шикиматного пути, так как получают протеиногенные ароматические аминокислоты и прочие необходимые продукты шикиматного пути в достаточном количестве с пищей (или от симбионтов) и потому эволюцией освобождены от необходимости их биосинтеза de novo. С другой стороны, избавившись от «лишнего» ещё на этапе своего эволюционного становления, животные попали в зависимость от ряда экзогенных соединений (незаменимые аминокислоты, значительная часть витаминов).Шаблон:.ref Животные способны преобразовывать готовые ароматические продукты шикиматного пути,Шаблон:.ref в частности, способны превращать незаменимую аминокислоту фенилаланин в тирозин, являющийся заменимой аминокислотой при условии достаточного поступления фенилаланина с пищей. Шикиматный путь частично или полностью утрачен также некоторыми микроорганизмами, живущими исключительно в богатых необходимыми веществами средах.
У бактерий три реакции, завершающие биосинтез фенилаланина, могут проходить как в цитозоле, так и в периплазматическом пространстве или экстрацеллюлярно.Шаблон:.ref
Начальные этапы шикиматного пути
В настоящее время известно два пути биосинтеза дегидрохинната — предшественника шикимата. Это классический путь через ДАГФ и обнаруженный позже у архей путь через ДКФФ.
Путь через ДАГФ
Наиболее распространённым в органическом мире и первым изученным путём образования дегидрохинната является путь его биосинтеза из эритрозо-4-фосфата и фосфоенолпирувата. Эритрозо-4-фосфат образуется преимущественно в системе транскетолазных и трансальдолазных реакций окислительного пентозофосфатного пути и фотосинтеза. Фосфоенолпируват образуется в процессе гликолитического распада углеводов и из оксалоацетата, а у ряда организмов — также одностадийно из пирувата. Сначала происходит взаимодействие по типу альдольной конденсации эритрозо-4-фосфата и фосфоенолпирувата с образованием семи́углеродного соединения 3-дезокси-D-арабино-гепт-2-улозонат-7-фосфат (ДАГФ, англ. DAHP, множество синонимов). Осуществляющий эту реакцию энзим — ДАГФ-синтаза (КФ 2.5.1.54) — представлен, как правило, несколькими изоформами; известно 2 класса. Далее ДАГФ претерпевает внутримолекулярную альдольную конденсацию (циклизацию), что даёт дегидрохиннат. Реакцию осуществляет энзим 3-дегидрохиннат-синтаза (КФ 4.2.3.4), требующая в качестве коэнзима NAD, который участвует в механизме реакции, потому как во время каталитического акта сначала происходит окисление, а в дальнейшем — восстановление гидроксильной группы при C5-атоме углерода молекулы ДАГФ (механизм, характерный и для других циклаз фосфорилированных углеводов Шаблон:.ref). Считается, что в реакцию ДАГФ вовлекается в полукетальной α-пиранозной форме (на схеме из некоторых соображений приведена только формула открытой кето-формы ДАГФ).

Описанный путь биосинтеза дегидрохинната характерен для бактерий, эукариот и части архей.
Путь через ДКФФ
У многих архей (представители классов Archaeoglobi, Halobacteria, Methanomicrobia, Methanobacteria, Methanococci, Methanopyri, а также типа Thaumarchaeota) активность ДАГФ-синтазы не была показана, а при исследовании их геномов не удалось выявить каких-либо ортологов генов ДАГФ-синтазы. Не было обнаружено и ортологов генов известного класса 3-дегидрохиннат-синтазы. Впоследствии выяснилось, что биосинтез дегидрохинната у этих организмов осуществляется другим путём. В экспериментах на Methanocaldococcus jannaschii установлено, что исходными соединениями служат D-глицеральдегид-3-фосфат, дигидроксиацетонфосфат, L-аспартат-4-се́миальдегид. D-глицеральдегид-3-фосфат и дигидроксиацетонфосфат (глицерон-фосфат) образуются в клетке разными путями, в том числе в системе транскетолазных, трансальдолазных реакций и в ходе гликолитического распада углеводов. L-аспартат-4-семиальдегид, также как и названные триозофосфаты, не является специфическим соединением данного метаболического пути, образуется восстановлением β-карбоксильной группы L-аспартата, является предшественником ряда протеиногенных аминокислот (метионина, треонина, изолейцина, а также лизина в одной из двух известных стратегий его биосинтеза). Отщепление фосфата от D-глицеральдегид-3-фосфата генерирует пирувальдегид (метилглиоксаль), который под влиянием фруктозо-1,6-дифосфат-альдолазы класса I (энзим с достаточно низкой субстратной специфичностью)[Поясн. 1] конденсируется с дигидроксиацетонфосфатом (вступает в реакцию в свободном виде либо в виде других субстратов альдолазы — D-фруктозо-1-фосфата или D-фруктозо-1,6-дифосфата) с образованием 6-дезокси-5-кетофруктозо-1-фосфата (ДКФФ, англ. DKFP). ДКФФ далее под влиянием другой родственной неспецифической альдолазы (КФ 4.1.2.13 / 2.2.1.10)[Поясн. 1] взаимодействует с L-аспартат-4-семиальдегидом с образованием 2-амино-3,7-дидезокси-D-трео-гепт-6-улозоната (сокр. англ. ADTH, синоним: 2-амино-2,3,7-тридезокси-D-ликсо-гепт-6-улозонат). Последнее соединение окислительно дезаминируется и циклизуется в дегидрохиннат под влиянием NAD-зависимого энзима дегидрохиннат-синтазы-II (КФ 1.4.1.-).Шаблон:.ref Шаблон:.ref

Итак, возникающий в результате циклизации шестичленный карбоцикл в дальнейшем подвергается ароматизации (в большинстве случаев).
Дальнейшие превращения дегидрохинната
Дегидрохиннат может обратимо восстанавливаться NAD-, NADP- и PQQ-зависимыми дегидрогеназами в хиннат, роль в биосинтезе ароматических соединений которого обсуждается (у некоторых растений уже выявлен энзим хиннат-гидролиаза, дегидратирующий хиннат в шикимат, что создаёт возможность превращения дегидрохинната в шикимат через хиннат, а не только через дегидрошикимат путём, описанным ниже).Шаблон:.ref Шаблон:.ref Однако строго доказано, что на пути к предшественникам важнейших ароматических соединений если не необходимым, то по крайней мере основным (у всех хорошо изученных в этом отношении организмов) этапом является обратимая дегидратация (стереохимия — 1,2-син-элиминирование) дегидрохинната в дегидрошикимат (энзим: 3-дегидрохиннат-дегидратаза (КФ 4.2.1.10)). У ряда организмов дегидрошикимат окисляется NADP-зависимой дегидрогеназой в 3,5-дидегидрошикимат или под влиянием 3-дегидрошикимат-дегидратазы (КФ 4.2.1.-) может обратимо дегидратироваться в ароматическое соединение протокатехат (через эти стадии может идти образование галлата, пирокатехина, пирогаллола, флороглюцина, гидроксигидрохинона, прочих фенолов). Но на пути к наиболее важным ароматическим соединениям дегидрошикимат должен претерпеть ряд других химических изменений. Дегидрошикимат обратимо восстанавливается NAD-, NADP- и PQQ-зависимыми дегидрогеназами в шикимат, далее следует необратимая киназная реакция (энзим: шикимат-киназа (КФ 2.7.1.71), макроэргический донор фосфорильной группы — АТФ). Образовавшийся шикимат-3-фосфат (фосфошикимат) взаимодействует с фосфоенолпируватом и образуется 5-карбоксивинил-шикимат-3-фосфат (энзим: ЕПШФ-синтаза, англ. EPSP synthase (КФ 2.5.1.19)). Две последние реакции рассматриваются как подготовительные для последующих реакций элиминирования, необходимых для завершения π-электронного секстета бензольного кольца (ароматизации). Необратимая реакция элиминирования фосфат-аниона даёт хоризмат (энзим: хоризмат-синтаза (КФ 4.2.3.5), кофактором которой является FMNred либо FADred, бифункциональные хоризмат-синтазы обладают к тому же NADred или NADPred-зависимой флавин-редуктазной активностью). Стереохимически реакция происходит как 1,4-анти-элиминирование, что предполагает механизм более сложный (предположительно радикальный, принимая во внимание структурные особенности субстрата и характер кофакторов), чем простое синхронное сопряжённое элиминирование, иначе происходило бы нарушение правил орбитальных взаимодействий.Шаблон:.ref В строгом смысле, собственно шикиматный путь образованием хоризмата завершается. От хоризмата расходятся по крайней мере семь путей, ведущих к ароматическим соединениям и родственным им хинонам (в приведённом ниже общем обзоре этих путей отражена основная биосинтетическая роль шикиматного пути).

П р и м е ч а н и е к р и с у н к у: На схеме отмечены различные возможные биохимические превращения, обычно не все из которых реализуются в конкретных организмах. Отмечены наиболее важные биохимические превращения, но разнообразие возможных превращений не ограничивается лишь этими. Хотя некоторые отмеченные на схемах здесь и далее реакции принципиально обратимы (обратимость реакций отмечена в соответствии с KEGG Pathway), равновесие в физиологических условиях может быть практически нацело смещено в определённую сторону, что обусловлено термодинамическими и другими факторами. Каноническая часть шикиматного пути размещена в верхней трети рисунка.
В узком смысле шикиматный путь — каскад из 7-ми ферментативных реакций, приводящий к образованию хоризмата — общего предшественника ряда важнейших соединений. Краткая информация по этим реакциям сведена в таблицу, которая вынесена в приложение
Пути, расходящиеся от хоризмата
В живой природе выявлено не менее семи различных путей, расходящихся от хоризмата и приводящих к ароматическим соединениям, а также родственным им хинонам:
- через префенат к фенилаланину, тирозину, фенилпропаноидам и другим соединениям.
- через антранилат к индолу, триптофану и другим соединениям.
- через 2-амино-4-дезоксихоризмат к пигментам и антибиотикам феназинового ряда.
- через 4-амино-4-дезоксихоризмат к пара-аминобензоату, фолату, хлорамфениколу и другим соединениям.
- через пара-гидроксибензоат к убихинону и другим соединениям.
- через изохоризмат к структурным производным нафталина (нафтохинонам), салицилату и другим соединениям.
- через футалозин к нафтохинонам и, возможно, к другим соединениям.
Известны и другие превращения хоризмата, например, присутствующая в его структуре эфирная связь может подвергаться гидролизу. Это путь к алициклическому соединению (1R,3R,4R)-3,4-дигидроксициклогексан-1-карбоксилату (предшественник-стартер в биосинтезе рапамицина, такролимуса и др.).Шаблон:.ref Аналогично может начинаться биосинтез циклогексилкарбонил-КоА (предшественник асукамицина, ω-циклогексил-жирных кислот и других соединений).
Путь через префенат
Изомеризация хоризмата в префенат происходит в результате [3,3]-сигматропной перегруппировки, по типу напоминающей перегруппировку Кляйзена (в более широком смысле — является перегруппировкой Кляйзена). Эта реакция способна происходить спонтанно (термически), подкисление среды и нагревание ускоряют её. Энзим хоризматмутаза (КФ 5.4.99.5) в физиологических условиях ускоряет реакцию в 2•106 раз.Шаблон:.ref
Реакция дегидратации-декарбоксилирования (механизм — сопряжённое элиминирование) префената приводит к фенилпирувату. Эта реакция в прямом направлении способна проходить спонтанно (термически), для её ускорения существуют энзимы: специфическая префенатдегидратаза (КФ 4.2.1.51) и неспецифическая карбоксициклогексадиенилдегидратаза (КФ 4.2.1.91). Обратимое переаминирование фенилпирувата приводит к протеиногенной аминокислоте фенилаланину.
Окислительное декарбоксилирование (окислитель — NADox или NADPox, энзимы — префенатдегидрогеназы) префената приводит к 4-гидроксифенилпирувату, обратимое переаминирование которого приводит к протеиногенной аминокислоте тирозину.
Известен также путь к фенилаланину и тирозину через арогенат (претирозин). Арогенат получается в результате переаминирования префената. Дегидратация-декарбоксилирование арогената приводит к фенилаланину, а окислительное декарбоксилирование (окислитель — NADox или NADPox) арогената приводит к тирозину. У зелёных растений и цианобактерий путь биосинтеза фенилаланина и (или) тирозина через арогенат обычно является преобладающим.
У некоторых организмов (мутанты Neurospora crassa и др.) найдены спиро-арогенат (лактамное производное арогената) и D-префениллактат (восстановленное по карбонилу производное префената), которые также склонны к ароматизации.Шаблон:.ref
У многих организмов, в том числе у животных и человека, есть энзим аэробная тетрагидробиоптерин-зависимая фенилаланин-4-монооксигеназа (синоним: фенилаланин-4-гидроксилаза, КФ 1.14.16.1), осуществляющий однонаправленное гидроксилирование фенилаланина в тирозин.

Фенилпируват, 4-гидроксифенилпируват, фенилаланин, тирозин и продукты их обмена дают начало огромному множеству различных ароматических соединений (фенилпропаноиды, катехоламины, различные пептиды, многие алкалоиды (изохинолиновые, тропановые, протоалкалоиды), многие гликозиды (кумариновые, большинство известных цианогенных), коэнзимы PQQ и F420, лигнины, меланины и множество прочих). 4-Гидроксифенилпируват окисляется (с одновременной миграцией и декарбоксилированием кетокарбоксиэтильного заместителя) в гомогентизат, являющийся предшественником токоферолов, пластохинона. Бензоат, пара-гидроксибензоат, салицилат, протокатехат, фанилацетат, гидрохинон могут быть продуктами биодеградации соединений, синтезированных через префенат, помимо чего пара-гидроксибензоат, салицилат и гидрохинон могут быть синтезированы из хоризмата другими путями.
Путь через антранилат
Антранилат синтезируется из хоризмата энзимом антранилатсинтазой (КФ 4.1.3.27). Донором аминогруппы выступает амидный азот глутамина либо аммоний. Антранилатсинтаза требует присутствия ионов Mg2+. Антранилат является предшественником индола и протеиногенной аминокислоты триптофана. Три последних соединения являются предшественниками очень многих соединений: индольных, хинолиновых, хиназолиновых, акридоновых алкалоидов, бензоксазиноидов и др.
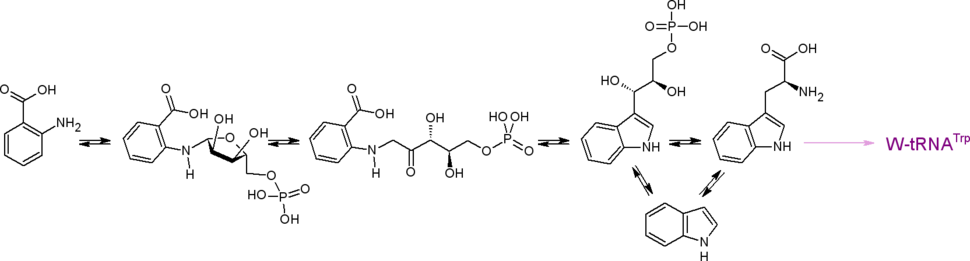
Пирокатехин (катехол) образуется в результате декарбоксилирования протокатехата, а также может быть синтезирован из антранилата, из салицилата.
Путь через антранилат близок к пути через 2-амино-4-дезоксихоризмат; эти пути рассматриваютя как самостоятельные, так как антранилат и 2-амино-4-дезоксихоризмат производятся из хоризмата разными энзимами.
Путь через 2-амино-4-дезоксихоризмат
Энзим 2-амино-4-дезоксихоризмат-синтаза (КФ 2.6.1.86) производит из хоризмата 2-амино-4-дезоксихоризмат (2-амино-2-дезоксиизохоризмат), открывая путь к структурным производным феназина. Донором аминогруппы выступает амидный азот глутамина. Далее происходит ферментативный гидролиз эфирной связи 2-амино-4-дезоксихоризмата, что даёт (5S,6S)-6-амино-5-гидроксициклогекса-1,3-диен-1-карбоксилат, который далее под влиянием транс-2,3-дигидро-3-гидрокси-антранилат-изомеразы (КФ 5.3.3.-) изомеризуется в (1R,6S)-6-амино-5-кетоциклогекса-2-ен-1-карбоксилат. Последнее соединение подвергается окислительной димеризации в (1R,6R)-1,2,5,5a,6,7-гексагидрофеназин-1,6-дикарбоксилат (энзим КФ 2.5.1.-). Спонтанная реакция декарбоксилирования приводит к (1R)-1,2,10,10a-тетрагидрофеназин-1-карбоксилату. Результатом дальнейших метаболических превращений этого соединения у бактерий является образование пигментов и антибиотиков феназинового ряда, в том числе незамещённого феназина, жёлтого феназин-карбоксилата, 2-гидроксифеназина, синего нефлуоресцирующего пигмента с антибиотической активностью пиоцианина (Pseudomonas aeruginosa), сафенамицинов, эсмеральдинов (димерные феназины).

Структурные производные хиноксалина (бензпиразина) могут синтезироваться также из триптофана. Известен FMN-содержащий энзим (КФ 1.3.99.24), который окисляет 2-амино-4-дезоксихоризмат в 3-(карбоксивинилокси)-антранилат, включающийся в структуру некоторых ендииновых антибиотиков в процессе их биосинтеза. Прекурсоры ендииновых антибиотиков могут образовываться также и через антранилат.
Путь через 4-амино-4-дезоксихоризмат
Изомерный антранилату пара-аминобензоат синтезируется из хоризмата через 4-амино-4-дезоксихоризмат энзимом пара-аминобензоат-синтазой (КФ 2.6.1.85 + КФ 4.1.3.38), требующим присутствия ионов Mg2+. Донором аминогруппы выступает амидный азот глутамина. Пара-аминобензоат является предшественником коферментов ряда фолата (THF, THMPT и др.). Пара-аминобензоат и его метаболические производные являются стартерными единицами в биосинтезе некоторых антибиотиков (кандицидин-D, хачимицины (трихомицин), леворин и др.), остаток пара-аминобензоата входит в состав антибиотиков пликацетин, норпликацетин, амицетин, бамицетин и др. Спонтанный или энзиматический гидролиз эфирной связи 4-амино-4-дезоксихоризмата приводит к (3R,4R)-4-амино-3-дигидроксициклогекса-1,5-диен-1-карбоксилату. У некоторых микроорганизмов выявлен энзим, катализирующий аналогичную хоризматмутазной [3,3]-сигматропную перегруппировку 4-амино-4-дезоксихоризмата в 4-амино-4-дезоксипрефенат.Шаблон:.ref Эта реакция составляет этап биосинтеза непротеиногенной аминокислоты пара-аминофенилаланин. Пара-аминофенилаланин — рекурсор нескольких известных антибиотиков, из него образуются 4-(диметиламино)-фенилаланин (остаток входит в структуру некоторых циклических пептидных антибиотиков, например, пристинамицина-IA),Шаблон:.ref пара-нитрофенилсеринол (предшественник хлорамфеникола).Шаблон:.ref

Путь через пара-гидроксибензоат
Хоризмат-пируват-лиаза (КФ 4.1.3.40) катализирует реакцию элиминирования пирувата из хоризмата, что приводит к пара-гидроксибензоату. Это не единственный способ биосинтеза пара-гидроксибензоата, который может также образовываться из фенилаланина и тирозина через пара-кумарат (растения, животные, многие бактерии). Пара-гидроксибензоат является предшественником убихинона, растительных гликозидов, шиконина и прочих соединений.

Путь через изохоризмат
Хоризмат-гидроксимутаза (изохоризмат-синтаза, КФ 5.4.4.2) осуществляет обратимую изомеризацию хоризмата в изохоризмат. Изохоризмат является предшественником салицилата, 2,3-дигидроксибензоата (предшественник сидерофорных соединений, таких, как энтеробактины), сукцинилбензоата (предшественник менахинонов, филлохинонов, а также ализарина, лавсона, юглона, люцидина, дунниона, моллугина), множества прочих соединений. Из изохоризмата салицилат синтезируется путём элиминирования пирувата (основной, но не единственный способ биосинтеза салицилата). Известен как перициклический, так и не перициклический механизмы этой реакции, описано оба соответствующих типа ферментативной активности.Шаблон:.ref Шаблон:.ref У некоторых организмов известен энзим (изохоризмат-мутаза), катализирующий [3,3]-сигматропную перегруппировку изохоризмата в изопрефенат.Шаблон:.ref Шаблон:.ref Из изопрефената образуются непротеиногенные аминокислоты мета-карбоксифенилаланин и мета-карбокситирозин — вторичные метаболиты высших растений (Nicotiana silvestria). Изопрефенат — наиболее вероятный предшественник 3-формилтирозина, найденного у Pseudoalteromonas tunicata.Шаблон:.ref

Путь через футалозин
Биоинформатический анализ секвенированных геномов привёл к обнаружению у некоторых прокариот (Streptomyces spp., Helicobacter pylori, Campylobacter jejuni) другого пути от хоризмата к менахинонам. В начале этого пути в ходе ферментативной реакции из хоризмата, инозина (аденозина) и фосфоенолпирувата образуется футалозин (аминодезоксифуталозин).Шаблон:.ref Шаблон:.ref
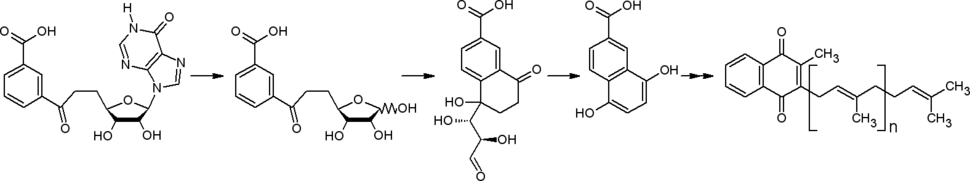
При синтезе менахинонов через изохоризмат и по футалозиновому пути наблюдается разный характер включения в структуру групп атомов, составляющих скелеты исходных соединений (в этих путях второй (хиноидный) карбоцикл достраивается к карбоциклу хоризмата с разных сторон).
Неароматические продукты шикиматного пути
Шикиматный путь является специализированным путём биосинтеза ароматических соединений, но может быть рассмотрен как источник ряда неароматических. В основном это соединения, образующиеся из ароматических продуктов шикиматного пути в результате утраты ими ароматичности. Примером может служить диен-изоцианидный антибиотик (продуцирует Trichoderma hamatum), предшественником которого является тирозин:

Ещё пример: фенилацетат (продукт метаболических превращений фенилпирувата и фенилаланина) — биосинтетический предшественник некоторых структурных производных циклогептана (ω-циклогептил-жирных кислот).
В других случаях бензольные кольца шикиматного происхождения могут утрачивать ароматичность без разрушения или перестройки углеродного скелета. Так, цианобактериальный дипептид радиозумин, состоит из модифицированных остатков аминокислот, предположительно являющихся метаболическими производными пара-аминофенилаланина с частично гидрированными кольцами.Шаблон:.ref В то же время установлено, что собственные биосинтетические пути разнообразных неароматических структурных производных ароматических аминокислот, таких как 2,5-дигидро-тирозин, 2,5-дигидро-фенилаланин, тетрагидро-тирозин, тетрагидро-фенилаланин, 2,5-дигидро-стильбен, 2-карбокси-6-гидрокси-октагидроиндол (структурный компонент цианобактериального пептида эругинозина), антикапсин (предшественник бацилизина), исходят от префената. Известен энзим, префенат-декарбоксилаза, декарбоксилирующий префенат без сопутствующей дегидратации или окисления, что позволяет избежать ароматизации, характерной для более известных метаболических превращений префената. Кетомицин (антибиотик алициклической структуры) также образуется из префената.
Известны также неароматические продукты, синтезируемые из промежуточных неароматических соединений шикиматного пути. В качестве примера таких продуктов можно назвать микоспорины (микоспорин-подобные аминокислоты), которые обнаруживаются в таксономически разнообразных морских, пресноводных и наземных организмах. Один из метаболических путей, приводящих к микоспоринам, ответвляется от шикиматного пути на уровне дегидрохинната. Этот путь установлен в экспериментах с аскомицетом Trichothecium roseum. Другой выявленный (цианеи: Nostoc punctiforme, Chlorogloeopsis sp.) путь биосинтеза микоспоринов не использует промежуточные соединения шикиматного пути, но протекает с участием NpR 5600 (2-эпи-5-эпи-валиолон-синтаза) — гомолога 3-дегидрохиннат-синтазы. Исходным соединением является седогептулозо-7-фосфат — центральный метаболит, соединение, имеющее определённые черты структурного сходства с ДАГФ.Шаблон:.ref

Известны также продукты взаимодействия ароматических продуктов шикиматного пути с неароматическими промежуточными соединениями шикиматного же пути. Так, кофеоил-шикимат содержит одновременно остаток ароматической кофейной кислоты и неароматический карбоцикл шикимовой кислоты. Известным производным хинната аналогичного строения является хлорогенат.

Термодинамический аспект
Термохимия и кинетика отдельных реакций шикиматного пути достаточно хорошо изучены. Проводились специальные термодинамические исследования и расчёты. Ниже — данные по отдельным реакциям.
1). Термодинамика ДАГФ-синтазной реакции Шаблон:.ref Шаблон:.ref
ФЕП(aq) + D-Э4Ф(aq) + H2O(1) = ДАГФ(aq) + Ф(aq)
(C3H2O6P)3−(aq) + (C4H7O7P)2−(aq) + H2O(l) = (C7H10O10P)3−(aq) + (HO4P)2−(aq)
Тепловой эффект реакции (изменение энтальпии системы, молярная энтальпия реакции), измеренный калориметрически при T = 298.15 K, pH = 8.18, Im = 0.090 моль/кг, Tris + HCl буфер; установившейся кажущейся константе равновесия K' > 1.4•103:
ΔrHm (cal) = −(67.7 ± 1.5) кДж/моль
Расчётная стандартная молярная энтальпия реакции (T = 298.15 K и Im = 0):
ΔrHɵm = −(70.0 ± 3.0) кДж/моль (~ −17 ккал/моль)
Расчётная стандартная молярная свободная энергия Гиббса реакции (T = 298.15 K и Im = 0):
ΔrGɵm ≈ −39 кДж/моль
Расчётная () константа равновесия (T = 298.15 K и Im = 0):
Kɵ ≈ 7•106
2). Термодинамика 3-дегидрохиннат-синтазной реакции Шаблон:.ref Шаблон:.ref
(C7H10O10P)3−(aq) = (C7H9O6)−(aq) + (HO4P)2−(aq)
Тепловой эффект реакции, измеренный калориметрически (HEPES + NaOH буфер, T = 298.15 K, pH = 7.46, Im = 0.070 моль/кг):
ΔrHm (cal) = −(50.9 ± 1.1) кДж/моль
Расчётная стандартная молярная энтальпия реакции (T = 298.15 K и Im = 0):
ΔrHɵm = −(51.1 ± 4.5) кДж/моль (~ −12 ккал/моль)
Расчётная константа равновесия (T = 298.15 K и Im = 0):
K ≈ 2•1014
3). Термодинамика 3-дегидрохиннат-дегидратазной реакции Шаблон:.ref Шаблон:.ref
(C7H9O6)−(aq) = (C7H7O5)−(aq) + H2O(l)
Тепловой эффект реакции, измеренный калориметрически (HEPES + NaOH буфер, T = 298.15 K, pH = 7.42, Im = 0.069 моль/кг):
ΔrHm (cal) = 2.3 ± 2.3 кДж/моль
Расчётная стандартная молярная энтальпия реакции (T = 298.15 K и Im = 0):
ΔrHɵm = 2.3 ± 2.3 кДж/моль (~ 0,5 ккал/моль)
Расчётная константа равновесия (T = 298.15 K и Im = 0):
K = 4.6 ± 1.5
4). Термодинамика шикимат-дегидрогеназной реакции Шаблон:.ref
шикимат(aq) + NADP(aq) = дегидрошикимат(aq) + NADPH(aq)
На основе данных спектрофотометрии были получены следующие значения констант равновесия для этой реакции:
K' = 0.097 (T = 298.15 K, pH = 7.6)
K' = 0.18 (T = 303.15 K, pH = 7.8, Tris + HCl буфер)
K' = 0.175 (T = 303.15 K, pH = 7.9, Tris 0.067 моль/дм3 буфер)
K' = 0.036 (T = 303.15 K, pH = 7.0, Tris + HCl буфер)
K' = 0.0361 (T = 303.15 K, pH = 7.0, Tris 0.067 моль/дм3 буфер)
8). Термодинамика хоризматмутазной реакции Шаблон:.ref Шаблон:.ref Шаблон:.ref
хоризмат(aq) = префенат(aq)
Рассчитанные (при помощи теории молекулярных орбиталей) значения энергии активации хоризмата в газовой фазе:
Дианионная форма: 277.4 кДж/моль (конформация переходного состояния «кресло»), 282.8 кДж/моль (конформация «ванна»). Протонирование стабилизирует переходные формы: энергия активации для конформации «кресло» и конформации «ванна» диацидной формы принимает значения 247.3 кДж/моль и 248.5 кДж/моль соответственно, в водном растворе может снижаться до 86.6 кДж/моль. Так как различия значений энергии активации незначительны, определить преобладающий путь (через «кресло» или через «ванну») неферментативной конверсии хоризмата в префенат затруднительно. Обладая наибольшим сродством к определённому переходному состоянию, хоризматмутаза использует путь через «кресло».
Тепловой эффект реакции, измеренный калориметрически (T = 298.15 K):
ΔrHm (cal) = −(55.4 ± 2.3) кДж/моль (~ −13 ккал/моль)
Полученное при помощи квантовомеханических расчётов значение теплового эффекта (−46.4 кДж/моль) хорошо согласуется с экспериментально измеренным, что является подтверждением как достаточно глубокого понимания природы этой реакции, так и адекватности используемых для расчётов теоретических моделей.
Оценочное значение стандартной молярной энтропии реакции:
ΔrSɵm ≈ 3 Дж/моль•К
Расчётная стандартная молярная энергия Гиббса реакции (T = 298.15 K):
ΔrGɵm ≈ −56 кДж/моль
Расчётная константа равновесия:
K ≈ 7•109 (для конверсии хоризмат2−(aq) в префенат2−(aq) при T = 298.15 K). Для всех практических целей эта реакция может считаться необратимой, в то же время на схемах KEGG Pathway реакция помечена как обратимая.
Связь с другими метаболическими путями
Помимо очевидных связей с путями, производящими исходные соединения шикиматного пути, отдельными примерами можно осветить другого рода связи с другими метаболическими путями.
Некоторые соединения могут синтезироваться шикиматным путём, но этот путь для них не является единственным возможным путём биосинтеза.
Протокатехат у некоторых организмов может синтезироваться из дегидрошикимата (в основном при его катаболической утилизации). Протокатехат также является типичным метаболитом, образующимся в процессе биодеградации ароматических и гидроароматических соединений самого различного происхождения. К примеру, продукт поликетидного пути 6-метилсалицилат под влиянием 6-метилсалицилат-декарбоксилазы (КФ 4.1.1.52) декарбоксилируется в мета-крезол, который через серию реакций окисления метильной группы NADP-зависимыми дегидрогеназами может давать протокатехат.
Следует также отметить, что протокатехат является одним из основных продуктов неполной биодеградации таких соединений как толуол,Шаблон:.ref ПАУ,Шаблон:.ref бензойная,Шаблон:.ref фталевая и терефталевая Шаблон:.ref кислоты, некоторые азакрасители Шаблон:.ref и другие соединения. В процессе биодеградации ксилолов образование протокатехата не наблюдается.Шаблон:.ref
В растениях галлат образуется в реакциях пути шикимовой кислоты, но в грибах это соединение может быть синтезировано поликетидным путём.Шаблон:.ref
Другого рода взаимодействие метаболических путей можно отметить при синтезе иногда отдельно выделяемых так называемых соединений смешенного биосинтеза. В структуре многих природных соединений присутствуют бензольные кольца, синтезированные разными способами, в том числе шикиматным и поликетидным путями. Хорошо известный пример соединений такого типа — флавоноиды, у которых кольцо B — шикиматного происхождения, а кольцо А — формируется поликетидным путём.
Кроме биосинтетического шикиматного пути различают также хиннатный и шикиматный катаболические пути, ответственные за быструю утилизацию излишних количеств хинной, шикимовой и дегидрошикимовой кислот. Избыточный шикимат и хиннат, которые могут поступать в клетку экзогенно посредством специальных переносчиков, в результате обратимых реакций превращаются в дегидрошикимат, дегидратирующийся далее в протокатехат (эти реакции уже отмечались выше). Протокатехат далее деградирует до 3-кетоадипата, который затем распадается на субстраты цикла Кребса.
Гены и ферменты
Краткая информация по ферментам и катализируемым ими реакциям сведена в таблицу, которая вынесена в приложение
Гены прокариот, отвечающие за семь реакций, составляющих путь от эритрозо-4-фосфата и фосфоенолпирувата до хоризмата в большинстве случаев имеют название aro-гены (aroA, aroB, aroC, aroD, aroE, aroF, aroG, aroH, aroK, aroL, aroQ, aro1, aroB-1, aroB-2, aroDE, aroKB и некоторые другие). Гены, ответственные за образование фенилаланина и тирозина из хоризмата — phe- и tyr-гены (pheA, pheC, tyrA, tyrAa, tyrB и др.), соответственно, гены биосинтеза триптофана — trp-гены (trpА, trpB, trpC, trpD, trpE, trpF, trpG, trpCF, trpEG, trpGD и др.). Существенное значение для шикиматного пути могут иметь также гены quiA, quiB, qutE, qa-3, ydiB, shiA и некоторые другие. Определённые aro- phe- и trp- гены не имеют прямого отношения к рассматриваемым здесь биохимическим процессам, но косвенно влияют на них. К примеру, aroP — ген, ответственный за транспорт ароматических аминокислот, pheP — ген, кодирующий фенилаланин-специфичную пермеазу, pheS, pheT, tyrS, trpS — гены соответствующих аминоацил-тРНК-синтетаз (субъединиц в случае фенилаланиновой). Функция генов aroI, aroM (не путать с эукариотическим arom-супергеном) не установлена (по состоянию на сентябрь 1998 года). Для генов растений предлагалось название shk-гены.Шаблон:.ref
Гены шикиматного пути широко разбросаны по геному, и следуют в различном порядке даже у достаточно близких видов, как правило, не входят в состав единого регулона. В геноме архебактерии Halobacterium salinarum гены начальных этапов шикиматного пути (OE1472F — ген-паралог fba2 — fructose-bisphosphate aldolase, class I и OE1475F — ген 3-дегидрохиннат-синтазы) включены в триптофановый оперон.
Ферменты шикиматного пути во многих случаях являются многофункциональными. Эти белки — продукты слившихся генов. Среди ферментов шикиматного пути известны следующие бифункциональные белки:
- 3-дегидрохиннат-синтаза/дегидрохиннат-дегидратаза (Rhizopus)
- дегидрохиннат-дегидратаза/шикимат-дегидрогеназа (продукт гена aroDE Chlamydia, Treponema и др.)
- шикимат-киназа/ЕПШФ-синтаза (Plasmodium)
- шикимат-киназа/3-дегидрохиннат-синтаза (продукт гена aroKB Escherichia и др.)
- хоризмат-синтаза/флавин-редуктаза (известен у многих аэробных организмов)
- ДАГФ-синтаза/хоризматмутаза (продукт гена aroA-aroG Bacillus subtilis).
Трифункциональные белки:
- 3-дегидрохиннат-синтаза/хоризмат-синтаза/флавин-редуктаза (NADPred-зависимая) (известен у Bacillus subtilis)
Также хорошо известны многофункциональные белки и среди ферментов дальнейших превращений хоризмата:
- хоризматмутаза/префенатдегидратаза (продукт гена pheA Escherichia и др.)
- хоризматмутаза/префенатдегидрогеназа (продукт гена tyrA Escherichia и др.)
- антранилатсинтаза/антранилат-фосфорибозилтрансфераза (продукт гена trpGD Escherichia, Shigella, Citrobacter, Salmonella, Klebsiella, Enterobacter).
- антранилатсинтаза/индол-3-глицерол-фосфат-синтаза (TRP3)
- антранилатсинтаза/индол-3-глицерол-фосфат-синтаза/фосфорибозилантранилат-изомераза (TRP1)
- индол-3-глицерол-фосфат-синтаза/фосфорибозилантранилат-изомераза (продукт гена trpCF)
- триптофан-синтаза/фосфорибозилантранилат-изомераза (продукт гена trpBF)
- пара-аминобензоат-синтаза/4-амино-4-дезоксихоризмат-лиаза (продукт гена pabBC)
- тетрафункциональный белок PHYLLO (известен у растений, катализирует 4 последовательных реакции, в результате которых из хоризмата синтезируется сукцинилбензоат)
- и др.
У эукариот (простейшие, грибы) известен цитоплазматический пентафункциональный белок arom (продукт arom-супергена), сочетающий в одной полипептидной цепи домены с 3-дегидрохиннат-синтазной (КФ 4.2.3.4), 3-фосфошикимат-1-карбоксивинил-трансферазной (КФ 2.5.1.19), шикимат-киназной (КФ 2.7.1.71), 3-дегидрохиннат-дегидратазной (КФ 4.2.1.10, тип I), и шикимат-дегидрогеназной (КФ 1.1.1.25) активностями (домены перечислены по порядку от N-конца). Таким образом, белок arom осуществляет все пять реакций на пути от ДАГФ к 5-карбоксивинил-шикимат-3-фосфату. Белок arom Rhizoctonia solani (возбудитель корневой гнили сельскохозяйственных растений) состоит из 1618 аминокислотных остатков и имеет массу 173 кДа, в полностью функциональном состоянии помимо других необходимых кофакторов содержит два иона цинка Zn2+.Шаблон:.ref
Для полноценного функционирования ферментной системы шикиматного пути нужно присутствие определённого набора кофакторов, в том числе двухзарядных ионов металлов (Mg2+, Ca2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+ и др.). Отдельные энзимы могут быть требовательны к присутствию в среде определённого иона, другие ионы могут оказывать ингибирующее влияние, в случае других энзимов эти ионы в определённой мере взаимозаменяемы. Ферменты, полученные из разных организмов, а порой и изоферменты одного организма, могут сильно отличаться по отношению к активирующим ионам. Например, дегидрохиннат-синтаза Pyrococcus furiosus проявляет максимальную активность в присутствии Cd2+ (в присутствии любого другого иона активность ниже или отсутствует), для дегидрохиннат-синтаз из других источников этого не наблюдалось.Шаблон:.ref
Практически все описанные ферменты собственно шикиматного пути (7 реакций) являются мономерными, либо представляют собой гомодимерные, гомотетрамерные, гомогексамерные белки с числом активных центров соответствующим числу субъединиц. Среди различных ферментов дальнейших превращений хоризмата встречаются гетеромерные белки.
Организация в геномах важнейших модельных организмов (подобраны наиболее эволюционно отдалённые организмы, выбраны наиболее детально изученные штаммы):
Расположение aro-генов в хромосоме (нуклеоид, кольцевая молекула ДНК, 4,6 млн пар нуклеотидов) Escherichia coli K-12:
aroP (транскрипция: ←, функция: транспорт ароматических аминокислот, расположение на карте: 2,6), aroL (→, шикимат-киназа, 8,7), aroM (→, функция неизвестна, 8,8), aroG (→, ДАГФ-синтаза, регулируемая фенилаланином, 16,9), aroA (→, ЕПШФ-синтаза, 20,7), aroT (—, indole acrylic acid resistant mutants, transport, 28,3), aroD (→, 3-дегидрохиннат-дегидратаза, 38,2), aroH (→, ДАГФ-синтаза, регулируемая триптофаном, 38,5), aroC (←, хоризмат-синтаза, 52,7), aroF (←, ДАГФ-синтаза, регулируемая тирозином, 59,0), aroE (←, дегидрошикимат-редуктаза, 73,9), aroKB (←, шикимат-киназа/3-дегидрохиннат-синтаза, 75,8), aroI (—, функция неизвестна, 84,2).Шаблон:.ref
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 5842795 пар нуклеотидов) Microcystis aeruginosa NIES-843:
ccmA (транскрипция: →, функция: ДАГФ-синтаза, положение в хромосоме: 557559..558614), aroA (→, ЕПШФ-синтаза, 1380521..1381861), aroC (←, хоризмат-синтаза, 1707983..1709083), aroK (→, шикимат-киназа, 1927033..1927605), aroB (→, 3-дегидрохиннат-синтаза, 2361918..2363018), aroQ (←, 3-дегидрохиннат-дегидратаза, 2783501..2783974), aroE (→, шикимат-дегидрогеназа, 3416423..3417283).Шаблон:.ref
Расположение генов шикиматного пути в хромосоме (нуклеоид, линейная или псевдокольцевая молекула ДНК, 9025608 пар нуклеотидов) Streptomyces avermitilis MA-4680:
aroE (функция: шикимат-дегидрогеназа, положение в хромосоме: 2173767..2174642, complement), aroA (ЕПШФ-синтаза, 3800068..3801408), aroG (ДАГФ-синтаза, 7323905..7325257), aroD (дегидрохиннат-дегидратаза, 7538791..7539270), aroE (шикимат-дегидрогеназа, 8180666..8181502), aroC (хоризмат-синтаза, 8181892..8183076), aroK (шикимат-киназа, 8183073..8183588), aroB (3-дегидрохиннат-синтаза, 8183585..8184676).Шаблон:.ref
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 4093599 пар нуклеотидов) Bacillus subtilis BSn5:
BSn5_01775 (транскрипция: ←, функция: ЕПШФ-синтаза, положение в хромосоме: 345012..346298), aroB (←, 3-дегидрохиннат-синтаза, 355073..356161), BSn5_01830 (←, хоризмат-синтаза/флавин-редуктаза, 356161..357333), aroD (←, дегидрохиннат-дегидратаза, 389768..390535), BSn5_02785 (←, дегидрохиннат-дегидратаза, 518894..519340), aroE (←, шикимат-дегидрогеназа, 622722..623564), BSn5_05730 (←, ДАГФ-синтаза/хоризматмутаза, 1053966..1055042), aroK (→, шикимат-киназа, 2554497..2555057).Шаблон:.ref
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 1664970 пар нуклеотидов) Methanocaldococcus jannaschii DSM 2661:
MJ_0246 (транскрипция: ←, функция: хоризматмутаза, положение в хромосоме: 233695..233994), MJ_0400 (→, ortholog fructose-bisphosphate aldolase, 361590..362411), MJ_0502 (→, ЕПШФ-синтаза, 443159..444448), MJ_1084 (aroE) (→, шикимат-дегидрогеназа, 1022757..1023605), MJ_1175 (←, хоризмат-синтаза, 1113783..1114919), MJ_1249 (→, 3-дегидрохиннат-синтаза, 1191364..1192449), MJ_1440 (→, шикимат-киназа, 1407283..1408131), MJ_1454 (aroD) (←, 3-дегидрохиннат-дегидратаза, 1423963..1424625).Шаблон:.ref
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 1669696 пар нуклеотидов) Aeropyrum pernix K1:
aroC (транскрипция: ←, функция: хоризмат-синтаза, положение в хромосоме: 384859..386001), aroA (←, ЕПШФ-синтаза, 385991..387274), aroK (←, шикимат-киназа, 387262..388104), aroE (←, шикимат-дегидрогеназа, 388104..388925), aroD (←, дегидрохиннат-дегидратаза, 388922..389590), aroB (←, 3-дегидрохиннат-синтаза, 389597..390673), aroG (←, ДАГФ-синтаза, 390655..391467), aroA (←, ЕПШФ-синтаза, 892465..893724).Шаблон:.ref
Расположение генов шикиматного пути в хромосомах Saccharomyces cerevisiae S288c (гаплоидное число хромосом — 16): Шаблон:.ref
| Ген | Продукт (функция) | Хромосома | Размер всей хромосомы (пар нуклеотидов) |
Положение гена в хромосоме |
Смысловая цепь |
Интроны |
|---|---|---|---|---|---|---|
| ARO3 | ДАГФ-синтаза | IV | 1 531 933 | 521816..522928 | − | |
| ARO4 | ДАГФ-синтаза | II | 813 184 | 716882..717994 | complement | − |
| ARO1 | Пентафункциональный белок arom | IV | 1 531 933 | 704484..709250 | − | |
| ARO2 | Хоризмат-синтаза | VII | 1 090 940 | 226399..227529 | − | |
| ARO7 | Хоризмат-мутаза | XVI | 948 066 | 674861..675631 | complement | − |
Расположение генов шикиматного пути в хромосомах Populus trichocarpa (гаплоидное число хромосом — 19): Шаблон:.ref
| Ген | Продукт (функция) | Хромосома | Размер всей хромосомы (пар нуклеотидов) |
Положение гена в хромосоме |
Смысловая цепь |
Интроны |
|---|---|---|---|---|---|---|
| DHS3 | ДАГФ-синтаза | LGII | 24 482 572 | 7115794..7120328 | + | |
| DHS1 | ДАГФ-синтаза | LGV | 17 991 592 | 1074502..1077390 | complement | + |
| DHS4 | ДАГФ-синтаза | LGV | 17 991 592 | 9061181..9065741 | complement | + |
| DHQS6:DHQS7 | 3-дегидрохиннат-синтаза | … NW_001492764.1 | complement | + (Оба возможных транскрипта) | ||
| DHQD1 | дегидрохиннат-дегидратаза/шикимат-дегидрогеназа | … NW_001492761.1 | + | |||
| DHQD2 | дегидрохиннат-дегидратаза/шикимат-дегидрогеназа | LGXIII | 13 101 108 | 1974817..1978681 | complement | + |
| DHQD3 | дегидрохиннат-дегидратаза/шикимат-дегидрогеназа | LGXIII | 13 101 108 | 1981754..1986754 | complement | + |
| DHQD4 | дегидрохиннат-дегидратаза/шикимат-дегидрогеназа | LGX | 21 101 489 | 4580304..4584686 | + | |
| DHQD5 | дегидрохиннат-дегидратаза/шикимат-дегидрогеназа | LGXIV | 14 699 529 | 6220933..6226210 | + | |
| SK1 | шикимат-киназа | … NW_001492757.1 | complement | + | ||
| SK2 | шикимат-киназа | LGV | 17 991 592 | 1995576..1998169 | complement | + |
| SK3 | шикимат-киназа | LGVII | 12 805 987 | 5135260..5138431 | complement | + |
| SKp | шикимат-киназа | LGII | 24 482 572 | 4138794..4141592 | complement | + |
| EPSPS | ЕПШФ-синтаза | LGII | 24 482 572 | 10940242..10944837 | + | |
| CS1 | хоризмат-синтаза | LGVIII | 16 228 216 | 2073382..2077810 | complement | + |
| CS2 | хоризмат-синтаза | LGX | 21 101 489 | 19004168..19008214 | + |
Известны и псевдогены. У не имеющей шикиматного пути лактобактерии Lactobacillus delbrueckii subsp. bulgaricus ATCC 11842, например, есть псевдогены aroA(pseudo), aroC(pseudo), aroK(pseudo).
Регуляция
Регуляция шикиматного пути осуществляется посредством контроля синтеза ключевых энзимов и путём регуляции активности этих энзимов. Механизмы регуляции шикиматного пути наиболее полно изучены на микроорганизмах. Прокариоты >90 % своих энергетических ресурсов тратят на биосинтез белка, основным выходом шикиматного пути у большинства прокариот являются ароматические протеиногенные аминокислоты.Шаблон:.ref Шаблон:.ref Поэтому у большинства прокариот решающая роль в регуляции шикиматного пути отведена именно трём протеиногенным аминокислотам — фенилаланину, тирозину и триптофану. Внутриклеточная концентрация протеиногенных аминокислот имеет критическое значение и в случае любых других живых организмов. Но в случае растений, например, ароматические аминокислоты нельзя назвать «конечными продуктами», так как из них интенсивно синтезируются вторичные метаболиты, которые могут составлять значительную часть сухой массы.Шаблон:.ref Считается, что у растений шикиматный путь регулируется сложнее и преимущественно на транскрипционном уровне.
Репрессию синтеза ДАГФ-синтазы на транскрипционном уровне могут вызывать фенилаланин, тирозин и триптофан. Репрессии подвержены гены aroG, aroF, aroH по отдельности либо одновременно.
У большинства микроорганизмов (Escherichia coli, Erwinia, Methylobacillus capsulatus) ДАГФ-синтаза представлена тремя изозимами, каждый из которых подвержен ретроингибированию одной из трёх аминокислот — фенилаланином (ДАГФ-синтаза-[Phe]), тирозином (ДАГФ-синтаза-[Tyr]) и триптофаном (ДАГФ-синтаза-[Trp]). Доминантным энзимом является ДАГФ-синтаза-[Phe], обеспечивающая 80 % активности. У Pseudomonas ДАГФ-синтаза представлена двумя изозимами (ДАГФ-синтаза-[Tyr], ДАГФ-синтаза-[Trp]), доминантным является ДАГФ-синтаза-[Tyr]. У многих микроорганизмов ингибирующую активность помимо трёх аминокислот проявляют также фенилпируват и антранилат.Шаблон:.ref
Фенилаланин, тирозин и триптофан помимо влияния на начальный этап шикиматного пути задействованы также в регуляции более поздних этапов собственного биосинтеза и биосинтеза друг друга. Триптофановый оперон, объединяющий гены энзимов, ответственных за путь от хоризмата к триптофану, регулируется триптофаном посредством репрессии, и феномена, получившего название аттенуации.Шаблон:.ref Активность энзимов, кодируемых триптофановым опероном, подвержена регуляции триптофаном по типу обратной связи. У многих микроорганизмов триптофан оказывает регулирующее влияние также на биосинтез фенилаланина и тирозина. Синтез хоризматмутазы у некоторых микроорганизмов репрессируется фенилаланином, который, однако, стимулирует её активность. Ингибиторами префенатдегидратазы у различных микроорганизмов могут выступать фенилаланин, тирозин, триптофан.
Помимо триптофанового оперона аттенуация показана также для так называемого фенилаланинового оперона (У Escherichia coli он двухцистронный: pheL pheA).
Доказано также, что у некоторых организмов значительное регуляторное влияние на энзимы шикиматного пути могут оказывать и продукты шикиматного пути, являющиеся вторичными метаболитами (например, феназиновые соединения у производящих их бактерий).
Системы регуляторных механизмов на примерах конкретных организмов: Шаблон:.ref
Escherichia coli:
Репрессия:
Фенилаланин репрессирует синтез ДАГФ-синтазы-[Phe] и хоризматмутазы/префенатдегидратазы (в экспрессии оперона pheL pheA наблюдается аттенуация, лидерный пептид PheL: MKHIPFFFAFFFTFPstop). Тирозин репрессирует синтез ДАГФ-синтазы-[Tyr] и хоризматмутазы/префенатдегидрогеназы (гены этих ферментов находятся в одном опероне). Триптофан репрессирует синтез ДАГФ-синтазы-[Trp] и ферментов триптофанового оперона.
Ген шикимат-киназы aroL у Escherichia coli подвержен транскрипционному контролю тирозином.Шаблон:.ref
Ингибирование:
Фенилаланин аллостерически ингибирует активность ДАГФ-синтазы-[Phe] и хоризматмутазы/префенатдегидратазы. Тирозин аллостерически ингибирует активность ДАГФ-синтазы-[Tyr] и хоризматмутазы/префенатдегидрогеназы. Триптофан аллостерически ингибирует активность ДАГФ-синтазы-[Trp] и антранилатсинтазы/антранилат-фосфорибозилтрансферазы.
Шикимат-дегидрогеназа Escherichia coli аллостерически регулируется шикиматом.Шаблон:.ref
Bacillus subtilis:
Репрессия:
Фенилаланин и тирозин репрессируют синтез ДАГФ-синтазы/хоризматмутазы. Фенилаланин репрессирует синтез префенатдегидратазы, тирозин — префенатдегидрогеназы, триптофан — ферментов триптофанового оперона.
Индукция:
Хоризмат индуцирует синтез ферментов триптофанового оперона.
Ингибирование:
Хоризмат и префенат аллостерически ингибируют ДАГФ-синтазную активность ДАГФ-синтазы/хоризматмутазы. Фенилаланин аллостерически ингибирует префенатдегидратазу, тирозин — префенатдегидрогеназу, триптофан — антранилатсинтазу.
У Euglena gracilis ключевые реакции шикиматного пути при освещении протекают в хлоропластах, а в отсутствие света — в цитозоле. Это свойство связывают с очевидной рациональностью такой подстройки метаболизма под соответствующие условия освещения (исходные и макроэргические соединения, восстановительные эквиваленты легко образуются в процессе фотосинтеза). За цитозольный и хлоропласт-локализованный варианты шикиматного пути ответственны разные гены и, соответственно, разные изозимы.Шаблон:.ref
Эволюция
Продуктами шикиматного пути являются протеиногенные аминокислоты и предшественники важнейших кофакторов; шикиматный путь достаточно консервативен, выявлен у наиболее эволюционно отдалённых организмов — представителей трёх доменов (бактерии, археи, эукариоты) и, по-видимому, не имеет альтернативы. Эти факты указывают на то, что эта система химических превращений в близком к современному виде сформировалась на заре эволюции более 3 млрд лет назад, а зародилась, вероятно, ещё до становления генетического кода. Факт специфичности для большинства архей иных начальных этапов шикиматного пути, имеющих лишь некоторые черты сходства с начальными этапами шикиматного пути бактерий и эукариот, становится в ряд с множеством других существенных отличительных признаков и согласуется с представлениями об очень раннем эволюционном обособлении этой группы живых организмов.
Представляется вполне вероятным то, что эукариоты унаследовали шикиматный путь (в том числе распространённый только среди эукариот пентафункциональный белок arom) от последнего общего эукариотического предка, затем частью эукариот (Metazoa) шикиматный путь был безвозвратно утрачен в связи с гетеротрофностью, а другой частью (Plantae) он был утрачен и повторно приобретён путём симбиоза с цианобактериями, давшими, как полагают, начало пластидам. Кодирование энзимов шикиматного пути ядерным геномом растений, объясняется эндосимбиотическим переносом генов. Эволюционная история шикиматного пути в грибах, так же как и в растениях, видимо, была под влиянием событий горизонтального переноса прокариотических генов.Шаблон:.ref
Не исключено также, что arom-суперген мог ещё не существовать во времена последнего общего эукариотического предка. В этом случае аrom-суперген, очевидно являясь очень ранней эукариотической инновацией, должен был быть распространён путём горизонтального переноса генов на самых ранних этапах эволюции эукариот.Шаблон:.ref
Гены и продукты этих генов, как известно, являются эволюционирующими образованиями. Изучение различий в структурах генов и энзимов шикиматного пути, а также различия в его регуляторных механизмах даёт ценную информацию для построения кладограмм. К примеру, изозимный состав ДАГФ-синтазы используется как филогенетический маркер. Заслуживают особого внимания многофункциональные белки — продукты слившихся генов. Слияние генов — относительно редкое эволюционное событие, а слившиеся гены достаточно устойчивы и не склонны к повторному реверсивному обособлению, поэтому слившиеся гены — маркеры, позволяющие уточнить филогенетические взаимоотношения таксонов на различных иерархических уровнях. Для исследователей происхождения и эволюционных взаимоотношений эукариот особенно привлекателен arom-суперген.Шаблон:.ref
Родственные метаболические пути
Гомологи ферментов шикиматного пути участвуют в других метаболических процессах (обмен углеводов и синтез вторичных метаболитов). Аминошикиматный путь — этот путь, имеющий значение для синтеза определёнными актиномицетами некоторых вторичных метаболитов (рифамицины, нафтомицины, стрептоварицин, гельданамицин, ансамитоцины, ансатриенины, митомицины и другие), эволюционно произошёл от шикиматного (отдельные ферменты гомологичны ферментам шикиматного пути и осуществляют похожие реакции).

Практическое значение
Изучение шикиматного пути, его регуляторных механизмов, а также сопряжённое с этим получение, изучение и отбор различных мутантов позволило выявить «рычаги управления» и создать качественные штаммы-продуценты ароматических аминокислот и других ценных соединений.Шаблон:.ref
Шикиматный путь отсутствует у Metazoa, но некоторые патогенные для животных микроорганизмы не способны обходиться без его протекания. Поэтому шикиматный путь — потенциальная цель в борьбе с этими патогенами. In vitro было показано, что фторшикиматные аналоги тормозят рост Plasmodium falciparum.Шаблон:.ref К тому же, на основе болезнетворных микроорганизмов, ослабленных блокировкой шикиматного пути, возможно приготовление вакцин.
Конкурентный ингибитор растительной ЕПШФ-синтазы — N-(фосфонометил)-глицин (глифосат) — широко используется в качестве неселективного системного гербицида. Известно, что ЕПШФ-синтазы ряда организмов (штаммы Agrobacterium tumefaciens, Salmonella typhimurium, Klebsiella pneumoniae и др.) практически не ингибируются глифосатом. Это стало предпосылкой для создания специальных генетически модифицированных культур, достаточно резистентных к действию гербицидов на основе глифосата. Эффективность борьбы с сорняками на посевах таких культур значительно повышается (обычно имеется в виду повышение урожайности, но не снижение расхода глифосата). Установлено, что глифосат может понижать активность ещё двух ферментов шикиматного пути: ДАГФ-синтазы и дегидрохиннат-синтазы, а также оказывать некоторое влияние на активность ещё нескольких ферментов других метаболических процессов.Шаблон:.ref
Интересные факты
Кодоны, кодирующие аминокислоты, относящиеся к семейству шикимата (синтезируемые шикиматным путём), начинаются с U (матричная РНК, 5´→3´). Кодоны фенилаланина — UUU, UUC, кодоны тирозина — UAU, UAC, кодон триптофана — UGG (в митохондриях — ещё и UGA, являющийся в стандартном варианте генетического кода стоп-кодоном). Как правило, аминокислоты, порождаемые одним метаболическим путём, кодируются кодонами с одинаковым нуклеотидом на 5´-конце. Вероятность случайности подобной организации генетического кода достаточно низка, поэтому вполне обоснованны попытки найти объяснение. Указанный факт находит это объяснение в рамках представлений о коэволюции генетического кода и путей биосинтеза аминокислот, ставших протеиногенными аминокислотами.
Прочие факты и аспекты
Американская музыкальная группа из Беллингхэма, «Portals Align», играющая в жанре грув-метал, инструментальная музыка, прогрессивный рок, экспериментальная музыка, джент, в ноябре 2011 года записала музыкальную композицию с названием «Shikimate Pathway», на YouTube был опубликован соответствующий видеоклип.Шаблон:.ref Не менее любопытна также дабстеп-композиция «Shikimat» от «Toneless Bombast». На статичной заставке в клипе различимы нарисованные от руки формулы и надписи, имеющие отношение к шикиматному пути.Шаблон:.ref
См. также
- Ароматичность и ароматизация
- Ароматические соединения
- Поликетиды, Поликетидсинтаза
- en:Aminoshikimate pathway
Наиболее известные бензоидные ароматические продукты других путей:
- Тетрагидроканнабинол — пример природного бензоидного ароматического соединения, биосинтез бензольного ядра которого происходит не шикиматным путём, а поликетидным. Второй карбоцикл (пренильного просхождения) молекулы тетрагидроканнабинола может ароматизоваться с образованием системы бифенила, что даёт молекулу каннабинола.
- Гиперицин — пример природного бензоидного ароматического соединения, образованного путём окислительной конденсации антроновой и антрахиноновой единиц поликетидного происхождения.
- Рибофлавин — важный пример природного бензоидного ароматического соединения, биосинтез которого не связан с шикиматным путём. Бензольное ядро рибофлавина строится в две реакции (обе способны происходить спонтанно в относительно мягких условиях) Шаблон:.ref из L-3,4-дигидроксибутан-2-он-4-фосфата (1-дезокси-L-глицеро-тетрулозо-4-фосфата), генерируемого из D-рибулозо-5-фосфата.
- Эстрадиол — пример бензоидного ароматического соединения, биосинтез бензольного ядра которого осуществляется не специализированным шикиматным путём, а в результате ароматизации, спорадически встречающейся среди метаболических превращений биогенных соединений самых различных типов. В метаболизме изопреноидных соединений, к которым относятся и стероиды, известно довольно много реакций ароматизации.
Приложение
| Реакции шикиматного пути | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Годы открытия некоторых наиболее важных соединений, являющихся исходными, промежуточными соединениями шикиматного пути, а также продуктами шикиматного пути. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Пояснения
- ↑ 1 2 При исследвании генома гипертермофильной метаногенной археи Methanocaldococcus jannaschii (усиленно изучающийся модельный организм; первая архея, геном которой был полностью секвенирован) было выявлено, что гены MJ_0400 и MJ_1585 — паралоги и гомологичны гену фруктозо-1,6-дифосфат-альдолазы архейного типа класса I. Функция продуктов этих генов оставалась невыясненной и была оценена как «предположительно белок, вероятно альдолаза». В некоторых научных публикациях априори считалось, что ген MJ_0400 детерминируюет фруктозо-1,6-дифосфат-альдолазу. Далее выяснилось, что продукт гена MJ_1585 образует ДКФФ, а продукт гена MJ_0400 осуществляет взаимодействие ДКФФ с L-аспартат-4-семиальдегидом. То есть продукты генов MJ_1585 и MJ_0400 осуществляют следующие друг за другом альдолазную и трансальдолазную реакции в процессе биосинтеза дегидрохинната. Позже было установлено, что продукты этих генов проявляют (не утратили) также и фруктозо-1,6-дифосфат-альдолазную активность (свойственна некоторая субстратная неразборчивость). Таким образом, экспериментальные данные говорят о том, что MJ_0400 и MJ_1585 участвуют как в центральном углеводном метаболизме, так и в шикиматном пути. Фруктозо-1,6-дифосфат-альдолазой/фосфатазой является также продукт гена MJ_0299. Ортологи генов MJ_0299, MJ_0400, MJ_1585 идентифицированы в геномах множества других архей.
Примечания
Литература
- Мецлер Д. — «Биохимия. Химические реакции в живой клетке» (том 3). Перевод на русский язык под ред. академика А. Е. Браунштейна; Москва, «Мир», 1980 г.
Теме шикиматного пути посвящено несколько обзорных публикаций:
- Ronald Bentley — «The shikimate pathway — a metabolic tree with many branches»; Biochemistry and Molecular Biology, 1990, 307—384
- John Wiley & Sons, Ltd — «The shikimate pathway: aromatic amino acids and phenylpropanoids»; Medicinal Natural Products, 2002, 121—166
Ссылки
- KEGG — Phenylalanine, tyrosine and tryptophan biosynthesis — Reference pathway
- BioCyc — Aromatic Compounds Biosynthesis
- Shikimate and Chorismate Biosynthesis
- SKPDB (ShiKimate Pathway DataBase)
- PharmSpravka.ru — Как осуществляется биосинтез фенольных соединений?
- Биосинтез фенольных соединений
- The Shikimic Acid Pathway
