Оксид америция(IV)
| Оксид америция(IV) | |
|---|---|
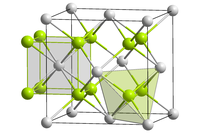 __ Am4+ __ O2− | |
| Общие | |
| Систематическое наименование |
Оксид америция(IV) |
| Хим. формула | AmO2 |
| Физические свойства | |
| Состояние | чёрные кристаллы |
| Молярная масса | 275,07 г/моль |
| Термические свойства | |
| Температура | |
| • разложения | > 1000 °C |
| Энтальпия | |
| • образования | -932,2 ± 2,7 кДж/моль |
| Классификация | |
| Рег. номер CAS | 12005-67-3 |
| PubChem | 57461988 |
| Рег. номер EINECS | 234-471-0 |
| SMILES | |
| InChI | |
| Безопасность | |
| Токсичность | Радиоактивно |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид америция(IV) (диоксид америция, окись америция(IV)) — бинарное неорганическое соединение америция и кислорода. Представляет собой чёрные кристаллы. Первое полученное соединение америция[1].
Получение
[править | править код]- Прокаливание на воздухе или в атмосфере кислорода нитрата, гидроксида, оксалата или карбоната америция при температуре 600—800 °C[1]:
- Сжигание металлического америция на воздухе[2]:
- Данный способ, однако, не находит практического применения из-за загрязнения продукта реакции другими оксидами америция, в том числе нестехиометрического состава.
Физические свойства
[править | править код]Оксид америция(IV) образует чёрные кристаллы гранецентрированной кубической сингонии. Параметр ячейки a = 0,5374 нм[3]. Под действием радиоактивного излучения, однако, происходит увеличение параметра ячейки кристаллической решётки, а приведенная величина есть результат экстраполяции к нулевому моменту времени[1]. Пространственная группа , изоструктурен фториду кальция[3].
Состав данного оксида соответствует стехиометрическому AmO2,00, и даже при температуре 1000 °C отношение кислорода к америцию в нём не меньше, чем 1,99[1].
Химические свойства
[править | править код]- При температуре 600 °C в атмосфере водорода восстанавливается до оксида америция(III)[1]:
- При температуре выше 1000 °C разлагается, отщепляя кислород и переходя в оксид америция(III)[4][5]:
- При температуре 1400—1500 °C реагирует со смесью сероводорода и сероуглерода с образованием сульфида америция(III)[6]:
- Восстанавливается газообразным фтороводородом при температуре 150 °C до фторида америция(III)[6]:
- Восстанавливается тетрахлорметаном (800 °C) или хлороводородом (250—300 °C) до хлорида америция(III) при повышенной температуре[6]:
- При температуре 500 °C восстанавливается бромидом алюминия и иодидом алюминия до бромида америция(III) и иодида америция(III) соответственно[6].
- При фторировании элементарным фтором при температуре 400—500 °C образуется фторид америция(IV)[6]:
Примечания
[править | править код]- ↑ 1 2 3 4 5 Вейгель и др., 1997, с. 429.
- ↑ Лидин, 2000, с. 348.
- ↑ 1 2 Вейгель и др., 1997, с. 424.
- ↑ Никольский и др., 1971, с. 22-23.
- ↑ Угай, 1997, с. 513.
- ↑ 1 2 3 4 5 6 Кнунянц и др., 1988, с. 126.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 625 с.
- Вейгель Ф., Кац Д., Сиборг Г. и др. Химия актиноидов. — М.: Мир, 1997. — Т. 2. — 654 с. — ISBN 5-03-001885-9.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Угай Я.А. Общая и неорганическая химия. — М.: Высшая школа, 1997. — 527 с.










