Оксид рутения(IV)
Перейти к навигации
Перейти к поиску
| Оксид рутения(IV) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Оксид рутения(IV) |
| Традиционные названия | Окись рутения(IV) |
| Хим. формула | RuO2 |
| Физические свойства | |
| Состояние | сине-чёрные кристаллы |
| Молярная масса | 133,07 г/моль |
| Плотность | 6,97 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | разл. 955 °C |
| Энтальпия | |
| • образования | −305 кДж/моль[1] |
| Классификация | |
| Рег. номер CAS | 12036-10-1 |
| PubChem | 82848 |
| Рег. номер EINECS | 234-840-6 |
| SMILES | |
| InChI | |
| ChemSpider | 74760 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид рутения(IV) — неорганическое соединение, оксид металла рутения с формулой RuO2, сине-чёрные кристаллы, не растворимые в воде, образует гидраты.
Получение[править | править код]
- Окисление рутения при нагревании:
- Разложение при нагревании оксида рутения(VIII):
- Реакция оксида рутения(VIII) и перекиси водорода:
- Разложение кислотами тетраоксорутенат(VI) калия
- Окисление кислородом хлорида рутения(III)
Физические свойства[править | править код]
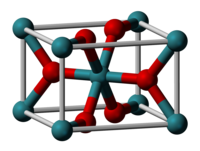
Оксид рутения(IV) образует сине-чёрные кристаллы тетрагональной сингонии, пространственная группа P 4/mnm, параметры ячейки a = 0,451 нм, c = 0,311 нм, Z = 2.
Из раствора осаждается гидрат RuO2•n H2O.
Не растворяется в воде, р ПР = 49,0.
Химические свойства[править | править код]
- Разлагается при нагревании:
- Растворяется в концентрированной соляной кислоте, насыщенной хлором:
- Окисляется кислородом:
- Реагирует с перекисью натрия при сплавлении:
- Восстанавливается водородом:
Примечания[править | править код]
- ↑ Holleman A. F. Holleman-Wiberg Lehrbuch der Anorganischen Chemie — 103 — Walter de Gruyter. — Т. 2. — С. 1975.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |










