Оксид цинка
| Оксид цинка | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
оксид цинка |
| Традиционные названия | окись цинка |
| Хим. формула | |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 81,408 г/моль |
| Плотность | 5,61 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1975 °C |
| • сублимации | 1800 °C |
| Мол. теплоёмк. | 40,28 Дж/(моль·К) |
| Энтальпия | |
| • образования | −350,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Оптические свойства | |
| Показатель преломления |
2,015 и 2,068CRC Handbook of Chemistry and Physics. — 92nd. — CRC Press, 2011. — ISBN 978-1439855119. |
| Структура | |
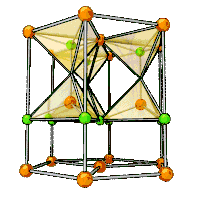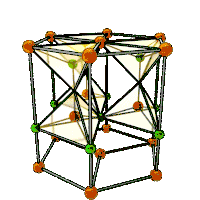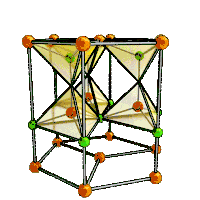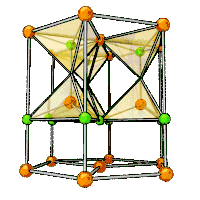
| Кристаллическая структура |
гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 |
| Классификация | |
| Рег. номер CAS | 1314-13-2 |
| PubChem | 14806 |
| Рег. номер EINECS | 215-222-5 |
| SMILES | |
| InChI | |
| RTECS | ZH4810000 |
| ChEBI | ZH4810000 |
| ChemSpider | 14122 |
| Безопасность | |
| Предельная концентрация |
аэрозоль в воздухе рабочей зоны 0,5 мг/м3 в атмосферном воздухе 0,05 мг/м3 |
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку |
| Фразы риска (R) | R50/53 |
| Фразы безопасности (S) | S60, S61 |
| Краткие характер. опасности (H) |
H410 |
| Меры предостор. (P) |
P273 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д ци́нка (о́кись цинка) — бинарное неорганическое соединение цинка и кислорода с формулой , белый кристаллический порошок или бесцветные кристаллы. Кристаллизуется в гексагональной сингонии типа вюрцита. Нерастворим в воде, желтеет при нагревании. В природе встречается в виде минерала цинкита.
Свойства
[править | править код]Физические свойства
[править | править код]- Молекулярная масса: 81,408
- Температура плавления:
- Плотность:
- в порошке 5,5…5,6 г/см³
- в виде кристалла 5,61 г/см³.
- Растворимость в воде:
- при 18 °C — 0,00052 г/100 мл
- при 29 °C — 1,6⋅10−4 г/100 мл
- Теплопроводность: 54 Вт/(м·К)[2].
Образует кристаллы гексагональной сингонии, параметры ячейки a = 0,32495 нм, c = 0,52069 нм, Z = 2
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное смещение стехиометрического отношения в сторону обогащения кислородом придаёт ему электронный тип проводимости.
Эффективная масса носителей заряда mp = 0,59me; mn = 0,24me.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю область видимого спектра.
При температурах 1350—1800 °C оксид цинка сублимируется, сублимация идет через механизм разложения оксида цинка на цинк и кислород в высокотемпературной зоне и образование оксида в низкотемпературной зоне, скорости сублимации зависят от состава газовой среды, в которой она проводится[3].
Химические свойства
[править | править код]Химически оксид цинка амфотерен — реагирует с кислотами с образованием соответствующих солей цинка, при взаимодействии с растворами щелочей образует комплексные три-, тетра- и гексагидроксоцинкаты (например, и др.):
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
При сплавлении со щелочами и оксидами некоторых металлов оксид цинка образует цинкаты:
При сплавлении с оксидом бора и диоксидом кремния оксид цинка образует стеклообразные бораты и силикаты:
При смешивании порошка оксида цинка с концентрированным раствором хлорида цинка образуется быстро (за 2—3 минуты) твердеющая масса — цинковый цемент[4].
Нахождение в природе
[править | править код]Известен природный минерал цинкит, состоящий в основном из оксида цинка.
Получение
[править | править код]- Сжиганием паров цинка в кислороде («французский процесс»).
- Термическим разложением некоторых солей цинка:
- Окислительным обжигом сульфида .
- С помощью гидротермального синтеза[5].
- Извлечением из пылей и шламов заводов чёрной металлургии, особенно перерабатывающих металлолом (он содержит значительную долю оцинкованного железа).
Применение
[править | править код]Оксид цинка широко применяют в химической и фармацевтической промышленности. Применяется в составе зубных паст и цементов в терапевтической стоматологии, в солнцезащитных кремах, в косметических процедурах, в производстве в качестве наполнителя резины, искусственной кожи и резинотехнических изделий. Применяется в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка применяют при производстве стекла и керамики.
В химической промышленности
[править | править код]- Активатор вулканизации некоторых типов каучуков.
- Вулканизирующий агент хлоропреновых каучуков.
- Катализатор получения метанола.
- Белый пигмент при производстве красок и эмалей (с начала XXI века вытесняется нетоксичным диоксидом титана ). Был особенно востребован художниками во второй половине XIX века в виде цинковых белил — долго сохнущих красок, необходимых для новой масляной техники alla prima, основанной на письме в один приём[6].
- Наполнитель и пигмент в производстве:
- Добавка к кормам для животных.
- В производстве стекла и красок на основе жидкого стекла;
- Как один из компонентов преобразователя ржавчины[7].
Известно также, что оксид цинка обладает фотокаталитической активностью[8], что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время пока ещё не используется[9].
В электронике
[править | править код]Оксид цинка применяется для производства варисторов, которые используются в современных ограничителях перенапряжений (ОПН) взамен морально устаревших газонаполненных разрядников.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров[10]. На основе оксида цинка в комбинации с нитридом галлия создан светодиод голубого цвета[11][12].
Тонкие плёнки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры[13][14].
Также оксид цинка входит в состав теплопроводных паст, например, пасты КПТ-8.
В медицине
[править | править код]
В медицине используется в качестве компонента лекарственных средств наружного применения, используемых в дерматологии. Обладает противовоспалительным, подсушивающим, адсорбирующим, вяжущим и антисептическим действием.
Применяют в виде присыпки, мази, пасты, линимента, из него делают временные пломбы. Является одним из компонентов ряда комплексных дерматологических и косметических препаратов, таких как «Цинковая мазь», «Паста Лассара» и пр.
Фармакологическое действие обусловлено тем, что оксид цинка образует альбуминаты и денатурирует белки. При нанесении на поражённую поверхность уменьшает явления экссудации, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов.
Может применяться при дерматите, в том числе пелёночном, опрелостях, потнице, поверхностных ранах и ожогах (солнечные ожоги, порезы, царапины), язвенных поражениях кожи (трофических язвах), пролежнях, экземе в стадии обострения, простом герпесе, стрептодермии.
Безопасность и токсичность
[править | править код]Соединение малотоксично, но его пыль вредна для органов дыхания и может вызвать литейную лихорадку, ПДК в воздухе рабочих помещений — 0,5 мг/м³ (по ГОСТ 10262-73). Пыль соединения может образовываться при термической обработке изделий из латуни и литья медных сплавов, содержащих цинк.
Примечания
[править | править код]- ↑ http://www.cdc.gov/niosh/npg/npgd0675.html
- ↑ Термопрокладки. Дата обращения: 8 июля 2012. Архивировано 15 марта 2011 года.
- ↑ Anthrop D. F., Searcy A. W. Sublimation and Thermodynamic Properties of Zinc Oxide (англ.) // The Journal of Physical Chemistry. — 1964. — Vol. 68, iss. 8. — P. 2335–2342. — doi:10.1021/j100790a052.
- ↑ Справочник химика. Цинковый цемент.
- ↑ Baruah S., Dutta J. Review: Hydrothermal growth of ZnO nanostructures (англ.) // Science and Technology of Advanced Materials. — 2009. — Vol. 10, iss. 1. — P. 013001. — doi:10.1088/1468-6996/10/1/013001.
- ↑ Киплик Д. И. Техника живописи. — М.: Сварог и К., 2002. — С. 175. — ISBN 5-93070-014-1.
- ↑ Natallia Преобразователь ржавчины с цинком: свойства, применение. Цинковый портал (10 апреля 2023). Дата обращения: 19 августа 2024.
- ↑ Schimpf A. M. et al. Controlling Carrier Densities in Photochemically Reduced Colloidal ZnO Nanocrystals: Size Dependence and Role of the Hole Quencher (англ.) // Journal of the American Chemical Society. — 2013. — Vol. 135, iss. 44. — P. 16569–16577. — ISSN 0002-7863. — doi:10.1021/ja408030u. Архивировано 30 июля 2023 года.
- ↑ Вода и свет улучшили способность оксида цинка разрушать органические загрязнители. InScience (5 декабря 2023). Дата обращения: 19 августа 2024.
- ↑ Оксид цинка. scilead.ru. Дата обращения: 19 августа 2024.
- ↑ Liu X. Y. et al. Ultraviolet Lasers Realized via Electrostatic Doping Method (англ.) // Scientific Reports. — 2015. — Vol. 5. — P. 13641. — doi:10.1038/srep13641. — . — PMID 26324054. — PMC 4555170.
- ↑ Bakin A. et al. ZnMgO-ZnO quantum wells embedded in ZnO nanopillars: Towards realisation of nano-LEDs (англ.) // Physica Status Solidi C. — 2007. — Vol. 4, iss. 1. — P. 158–161. — doi:10.1002/pssc.200673557. — .
- ↑ Wang H. T. et al. Hydrogen-selective sensing at room temperature with ZnO nanorods (англ.) // Applied Physics Letters. — 2005. — Vol. 86, iss. 24. — P. 243503. — doi:10.1063/1.1949707. — .
- ↑ Tien L. C. et al. Hydrogen sensing at room temperature with Pt-coated ZnO thin films and nanorods // Applied Physics Letters. — 2005. — Т. 87, вып. 22. — С. 222106. — doi:10.1063/1.2136070. — .
Литература
[править | править код]- Перельман В. И. Краткий справочник химика. — М.—Л.: Химия, 1964.
- Бовина Л. А. и др. Физика соединений AIIBVI / Под ред. А. Н. Георгобиани, М. К. Шейнкмана. — М.: Наука, 1986. — 319, [1] с. — 2600 экз.
- Статья «Цинка окись» в Большой советской энциклопедии.
Дополнительная литература
[править | править код]- Özgür Ü., Alivov Ya. I., Liu C., Teke A., Reshchikov M. A., Doğan S., Avrutin V., Cho S.-J., Morkoç H. A comprehensive review of ZnO materials and devices // Journal of Applied Physics. — 2005. — Vol. 98. — P. 041301. — ISSN 00218979. — doi:10.1063/1.1992666.
- Химические вещества по алфавиту
- Кристаллы гексагональной сингонии
- Оксиды
- Ингибиторы коррозии
- Пигменты
- Катализаторы
- Соединения цинка
- Полупроводники
- Амфотерные оксиды
- Лекарственные средства по алфавиту
- Дерматотропные средства
- Антисептики и дезинфицирующие средства
- Полупроводниковые материалы
- Соединения A2B6
- Фармпрепараты, содержащие цинк


![{\displaystyle {\ce {Na2[Zn(OH)4],}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5fe0c645cfa870a55ab8ce7fe8d2b33ab3da9cd1)
![{\displaystyle {\ce {Ba2[Zn(OH)6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6942d7642b58bf88a659f6ebc05118ea434b7300)
![{\displaystyle {\ce {[Zn(OH)3]- + OH- -> [Zn(OH)4]^{2-}.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b990d10b8bc1e36ed7dccc6b6a9b2fc1d3cb3054)
2.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c12136821e205c3f6c42331779fc8803ac9e0f57)









