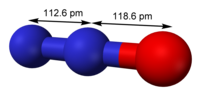
Оксид азота(I)
| Оксид азота(I) | |
|---|---|
  | |
 | |
| Общие | |
| Систематическое наименование |
Оксонитрид азота(I) |
| Хим. формула | N2O |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 44,0128 г/моль |
| Плотность | 1,98 г/л (при н. у.) |
| Энергия ионизации | 12,89 ± 0,01 эВ[1][2] |
| Термические свойства | |
| Температура | |
| • плавления | -90,86 °C |
| • кипения | -88,48 °C |
| • разложения | выше +500 °C |
| Давление пара | 51,3 ± 0,1 атм[1] |
| Структура | |
| Дипольный момент | 5,4E−31 Кл·м[2] |
| Классификация | |
| Рег. номер CAS | 10024-97-2 |
| PubChem | 948 |
| Рег. номер EINECS | 233-032-0 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E942 |
| RTECS | QX1350000 |
| ChEBI | 17045 |
| ChemSpider | 923 |
| Безопасность | |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д азо́та(I) (оксид диазота, закись азота, веселящий газ) — соединение с химической формулой N2O. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта с приступами смеха. При нормальных условиях это бесцветный негорючий газ с приятным сладковатым запахом и привкусом.
Закись азота является третьим по значимости долгоживущим парниковым газом, накопление которого в атмосфере Земли — одна из причин глобального потепления. Также N2O является веществом, разрушающим стратосферный озон[3].
История
[править | править код]Впервые был получен в 1772 году Джозефом Пристли, который назвал его «дефлогистированным нитрозным воздухом»[4]. В 1799 году его исследовал Г. Дэви.
Строение молекулы
[править | править код]Строение молекулы оксида азота(I) описывается следующими резонансными формами:
Наибольший вклад вносит N-оксидная форма оксида азота(I). Порядок связи N-N оценивается как 2,73, порядок связи N-O — как 1,61. Резонансная структура с возможностью противоположного расположения зарядов в молекуле N2O обусловливает низкий дипольный момент молекулы, равный 0,161 Д.
Физические свойства
[править | править код]Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде (0,6 объёма N2O в 1 объёме воды при 25 °C, или 0,15 г/100 мл воды при 15 °C), растворим также в этиловом спирте, эфире, серной кислоте. При 0 °C и давлении 30 атм, а также при комнатной температуре и давлении 40 атм сгущается в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Молекула закиси азота имеет дипольный момент 0,161 Д, коэффициент преломления в жидком виде равен 1,330 (для жёлтого света с длиной волны 589 нм). Давление паров жидкого N2O при 20 °C равно 5150 кПа.
Химические свойства
[править | править код]Относится к несолеобразующим оксидам, с водой, с растворами щелочей и кислот не взаимодействует. Не воспламеняется, но поддерживает горение: тлеющая лучина, опущенная в него, загорается, как в чистом кислороде. Смеси с эфиром, циклопропаном, хлорэтаном в определённых концентрациях взрывоопасны. Оксид азота(I) является озоноразрушающим веществом, а также парниковым газом. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
При нагревании выше +500°C N2O разлагается:
Оксид азота(I) реагирует с амидами металлов с образованием соответствующих неорганических азидов:
При взаимодействии с аммиаком над катализатором образуется азид аммония:
Получение
[править | править код]Оксид азота(I) получают осторожным (опасность взрывного разложения!) нагреванием сухого нитрата аммония:
Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой:
Также одним из удобных и безопасных способов получать оксид азота(I) является реакция раствора гидрохлорида гидроксиламина с раствором нитрита натрия:
В химической промышленности закись азота является побочным продуктом, и для её разрушения используют каталитические конвертеры, так как выделение в виде товарного продукта, как правило, экономически нецелесообразно.
Биологическое значение
[править | править код]Закись азота образуется как при ферментативном, так и при неферментативном восстановлении из окиси азота(II)[5]. В опытах in vitro было обнаружено, что закись азота образуется при реакции между окисью азота(II) и тиолом или тиол-содержащими соединениями[6]. Сообщается, что образование N2O из окиси азота было обнаружено в цитозоле гепатоцитов, что заставляет предполагать возможное образование этого газа в клетках млекопитающих в физиологических условиях[7]. В организме бактерий закись азота образуется в ходе процесса денитрификации, катализируемого нитрооксид-редуктазой. Ранее этот процесс предполагался специфичным для некоторых видов бактерий и отсутствующим у млекопитающих, но новые данные заставляют предполагать, что это не так. Было показано, что физиологически релевантные концентрации закиси азота ингибируют как ионные токи, так и опосредуемые эксайтотоксичностью нейродегенеративные процессы, происходящие при чрезмерном возбуждении NMDA-рецепторов[8]. Также закись азота ингибирует биосинтез метионина, угнетая активность метионинсинтазы[англ.] и скорость превращения гомоцистеина в метионин и повышая концентрацию гомоцистеина в культурах лимфоцитов[9] и в биоптатах человеческой печени[10]. Хотя закись азота не является лигандом для гема, и не реагирует с тиоловыми группами, она обнаруживается во внутренних структурах гемосодержащих белков, таких, как гемоглобин, миоглобин, цитохромоксидаза[11]. Способность закиси азота нековалентно, обратимо изменять структуру и функции гемосодержащих белков была показана исследованием сдвига инфракрасных спектров тиоловых групп цистеинов гемоглобина[12] и тем, что закись азота способна частично и обратимо ингибировать функцию цитохромоксидазы C[13]. Точные механизмы этого нековалентного взаимодействия закиси азота с гемосодержащими белками и биологическое значение этого явления заслуживают дальнейших исследований. В настоящее время представляется возможным, что эндогенная закись азота участвует в регуляции активности NMDA[8] и опиоидной системы[14][15]. Обладает нейротоксическими свойствами.
Применение
[править | править код]Существует два вида закиси азота — пищевая, или медицинская для медицинского применения (высокой степени очистки), и техническая — технический оксид диазота, в котором есть примеси, количество которых указывается в соответствующих техусловиях (ТУ) на данный газ. «Медицинская» закись азота используется в основном как средство для ингаляционного наркоза, находит применение и в пищевой промышленности (например, для изготовления взбитых сливок) в качестве пропеллента. Как пищевой продукт имеет индекс E942. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В промышленности применяется как пропеллент и упаковочный газ. Может использоваться в ракетных двигателях в качестве окислителя, а также как единственное топливо в монокомпонентных ракетных двигателях.
Средство для ингаляционного наркоза
[править | править код]Малые концентрации закиси азота вызывают лёгкое опьянение. При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз. Часто применяют комбинированный наркоз, при котором закись азота сочетают с другими средствами для наркоза, анальгетиками, миорелаксантами и т. п. Например, применяется комбинированный наркоз закисью азота и гексеналом с фентаниловой анальгезией и миорелаксацией дитилином.
Закись азота, предназначенная для медицинских нужд (высокой степени очистки от примесей), не вызывает раздражения дыхательных путей. Будучи в процессе вдыхания растворённой в плазме крови, практически не изменяется и не метаболизируется, с гемоглобином не связывается. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде. Период полувыведения — 5 минут.
Закись азота используется для ингаляционного наркоза в хирургии, она удобна для кратковременного наркоза (и рауш-наркоза) в хирургической стоматологии, а также для обезболивания родов (поскольку слабо влияет на родовую деятельность и нетоксична для плода).
Смесь закиси азота с кислородом получают и непосредственно применяют при помощи специальных аппаратов для наркоза. Обычно начинают со смеси, содержащей 70—80 % закиси азота и 30—20 % кислорода, затем количество кислорода увеличивают до 40—50 %[источник не указан 4132 дня]. Если не удается получить необходимую глубину наркоза, при концентрации закиси азота 70—75 % добавляют более мощные наркотические средства: фторотан, диэтиловый эфир, барбитураты.
Для более полного расслабления мускулатуры применяют миорелаксанты, при этом не только усиливается расслабление мышц, но также улучшается течение наркоза.
После прекращения подачи закиси азота следует во избежание гипоксии продолжать давать кислород в течение 4—5 мин.
Применять закись азота, как и любое средство для наркоза, необходимо с осторожностью, особенно при выраженных явлениях гипоксии и нарушении диффузии газов в лёгких.
Для обезболивания родов пользуются методом прерывистой аутоанальгезии с подачей при помощи специальных наркозных аппаратов смеси закиси азота (75 %) и кислорода. Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончании.
Для уменьшения эмоционального возбуждения, предупреждения тошноты и рвоты и потенцирования действия закиси азота возможна премедикация внутримышечным введением 0,5%-го раствора диазепама (седуксена, сибазона) в количестве 1—2 мл (5—10 мг).
Форма выпуска: в металлических баллонах вместимостью 10 л под давлением 50 атм в сжиженном состоянии. Баллоны окрашены в серый цвет и имеют надпись «Для медицинского применения».
При использовании закиси азота для анестезии и пограничных уровнях витамина B12 развивается полинейропатия, вызванная дефицитом B12[16][17]. Необходима терапия фолатами и B12.
Федеральный закон об ограничении оборота закиси азота
[править | править код]Запрет на продажу и ограничение по применению закиси азота для физических лиц ввели с 1 января 2021 года Федеральным законом от 29 декабря 2020 г. № 472-ФЗ «Об ограничении оборота закиси азота в Российской Федерации». Корреспондирующие изменения внесены в Кодекс об административных правонарушениях, введена статья 6.13.1 Пропаганда закиси азота, по которой грозит штраф от 1 тысячи рублей до 150 тысяч. Кроме того, вводится уголовная ответственность по статье 238 УК РФ «Производство, хранение, перевозка либо сбыт товаров и продукции, выполнение работ или оказание услуг, не отвечающих требованиям безопасности» и статье 151 УК РФ «Вовлечение несовершеннолетнего в совершение антиобщественных действий». Газ входит в число одурманивающих веществ, утверждённых Правительством Российской Федерации 4 августа 2021 года[18][19][20].
В двигателях внутреннего сгорания
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Закись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
- снижает температуру всасываемого в двигатель воздуха, обеспечивая плотный поступающий заряд смеси.
- увеличивает содержание кислорода в поступающем заряде (воздух содержит лишь ~23,15 масс. % кислорода).
- повышает скорость (интенсивность) сгорания в цилиндрах двигателя.
В реактивных двигателях
[править | править код]Иногда используется в качестве окислителя в однокомпонентном топливе с этаном, этиленом или ацетиленом в качестве топлива.
В пищевой промышленности
[править | править код]В пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ (предотвращают порчу продукта). Закись азота используется в основном для распыления пищевых продуктов.
Парниковый газ
[править | править код]Оксид азота(I) является сильным парниковым газом, третьим по вкладу в парниковый эффект среди антропогенных газов, после углекислого газа и метана, причем его среднее время жизни в атмосфере составляет 120 лет[21]. Eго потенциал глобального потепления равен примерно 270[22] (т.е. он вызывает парниковый эффект в 270 раз сильнее углекислого газа при равной концентрации).
Примечания
[править | править код]- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0465.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Thompson, R.L., Lassaletta, L., Patra, P.K. et al. Acceleration of global N2O emissions seen from two decades of atmospheric inversion. — Nat. Clim. Chang. (2019) doi:10.1038/s41558-019-0613-7
- ↑ Joseph Priestly. Experiments and observations on different kinds of air. — Vol. 1. — 1775.
- ↑ Neil Hogg, Ravinder J. Singh, B. Kalyanaraman. The role of glutathione in the transport and catabolism of nitric oxide (англ.) // FEBS Letters[англ.] : journal. — 1996. — 18 March (vol. 382, no. 3). — P. 223—228. — doi:10.1016/0014-5793(96)00086-5. — PMID 8605974. Архивировано 24 сентября 2015 года.
- ↑ DeMaster E. G., Quast B. J., Redfern B., Nagasawa HT. Reaction of nitric oxide with the free sulfhydryl group of human serum albumin yields a sulfenic acid and nitrous oxide (англ.) // Biochemistry : journal. — 1995. — 12 September (vol. 34, no. 36). — P. 11494—11499. — PMID 7547878. Архивировано 17 ноября 2015 года.
- ↑ Jinjoo Hyun, Gautam Chaudhuri, Jon M. Fukuto. The Reductive Metabolism of Nitric Oxide in Hepatocytes: Possible Interaction with Thiols (англ.) // Drug Metabolism & Disposition[англ.] : journal. — 1999. — 1 September (vol. 27, no. 9). — P. 1005—1009. — PMID 10460799. Архивировано 4 декабря 2018 года.
- ↑ 1 2 Jevtović-Todorović V., Todorović S. M., Mennerick S., Powell S., Dikranian K., Benshoff N., Zorumski C. F., Olney JW. Nitrous oxide (laughing gas) is an NMDA antagonist, neuroprotectant and neurotoxin (англ.) // Nat. Med. : journal. — 1998. — April (vol. 4, no. 4). — P. 460—463. — PMID 9546794. Архивировано 16 декабря 2017 года.
- ↑ Christensen B., Refsum H., Garras A., Ueland PM. Homocysteine remethylation during nitrous oxide exposure of cells cultured in media containing various concentrations of folates (англ.) // J Pharmacol Exp Ther.[англ.] : journal. — 1992. — June (vol. 261, no. 3). — P. 1096—1105. — PMID 1602376. Архивировано 17 ноября 2015 года.
- ↑ Koblin D. D., Waskell L., Watson J. E., Stokstad E. L., Eger EI 2nd. Nitrous oxide inactivates methionine synthetase in human liver (англ.) // Anesth Analg[англ.] : journal. — 1982. — February (vol. 61, no. 2). — P. 75—78. — PMID 7198880.
- ↑ Vijaya Sampath, Xiao-Jian Zhao, and Winslow S. Caughey. Anesthetic-like interactions of nitric oxide with albumin and hemeproteins. A mechanism for control of protein function (англ.) // The Journal of Biological Chemistry : journal. — 2001. — 27 April (vol. 276, no. 17). — P. 13635—13643. — doi:10.1074/jbc.M006588200. — PMID 11278308.
- ↑ Aichun Dong, Ping Huang, Xiao-Jian Zhao, Vijaya Sampath, and Winslow S. Caughey. Characterization of sites occupied by the anesthetic nitrous oxide within proteins by infrared spectroscopy (англ.) // The Journal of Biological Chemistry : journal. — 1994. — 30 September (vol. 269, no. 39). — P. 23911—23917. — PMID 7929038.
- ↑ Olof Einarsdottir, Winslow S. Caughey. Interactions of the anesthetic nitrous oxide with bovine heart cytochrome c oxidase. Effects on protein structure, oxidase activity, and other properties (англ.) // The Journal of Biological Chemistry : journal. — 1988. — 5 July (vol. 263, no. 19). — P. 9199—9205. — PMID 2837481.
- ↑ Gillman M. A., Lichtigfeld FJ. Nitrous oxide acts directly at the mu opioid receptor (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 1985. — March (vol. 62, no. 3). — P. 375—376. — PMID 2983587.
- ↑ Gillman M. A., Lichtigfeld FJ. A comparison of the effects of morphine sulphate and nitrous oxide analgesia on chronic pain states in man (англ.) // J Neurol Sci[англ.] : journal. — 1981. — January (vol. 49, no. 1). — P. 41—45. — PMID 7205318. Архивировано 17 ноября 2015 года.
- ↑ I Chanarin. Cobalamins and nitrous oxide: a review // Journal of Clinical Pathology. — 1980-10. — Т. 33, вып. 10. — С. 909—916. — ISSN 0021-9746.
- ↑ R. B. Layzer. Myeloneuropathy after prolonged exposure to nitrous oxide // The Lancet. — Elsevier, 1978-12-09. — Т. 2, вып. 8102. — С. 1227—1230. — ISSN 0140-6736. Архивировано 14 апреля 2019 года.
- ↑ «Веселящий газ» получил статус одурманивающего вещества. www.pnp.ru (24 сентября 2023). Дата обращения: 24 сентября 2023. Архивировано 5 октября 2023 года.
- ↑ Путин подписал закон о запрете продажи «веселящего газа». РБК (29 декабря 2020). Дата обращения: 24 сентября 2023. Архивировано 5 октября 2023 года.
- ↑ 25 декабря 2020 года Советом Федерации Российской Федерации одобрен Федеральный закон «Об ограничении оборота закиси азота в Российской Федерации». Законом запрещен ряд действий, связанных с оборотом закиси азота в немедицинских и непромышленных целях, а также для производства пищевой продукции. Министерство внутренних дел Российской Федерации (25 декабря 2020). Дата обращения: 24 сентября 2023. Архивировано 28 марта 2023 года.
- ↑ Источник. Дата обращения: 6 февраля 2024. Архивировано 13 марта 2019 года.
- ↑ Источник. Дата обращения: 6 февраля 2024. Архивировано 19 января 2024 года.
Литература
[править | править код]- Леонтьев А. В., Фомичева О. А., Проскурнина М. В., Зефиров Н. С. Современная химия оксида азота(I) // Успехи химии. — Российская академия наук, 2001. — Т. 70, № 2. — С. 107—122.
- Машковский, М. Д. Закись азота // Лекарственные средства. — 15-е изд. — М. : Новая Волна, 2005. — 1200 с. — ISBN 5-7864-0203-7.






![{\displaystyle {\mathsf {2NH_{3}+N_{2}O{\xrightarrow[{}]{Ni-Al_{2}O_{3}}}NH_{4}N_{3}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/15abbaecda2c68518b6ec0f22e7bf16956327c9c)


