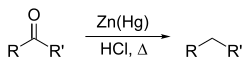Алканы
 |
 |
Химическая структура (вверху) и 3D-модель (внизу) метана — простейшего алкана
|
Алка́ны (парафи́ны, также насы́щенные или преде́льные углеводоро́ды) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые (одинарные) связи и образующие гомологический ряд с общей формулой CnH2n+2.
Все алканы и алкены относятся к классу алифатических углеводородов. Алканы являются насыщенными углеводородами, то есть содержат максимально возможное число атомов водорода для заданного числа атомов углерода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28'. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг[1].
Номенклатура
[править | править код]Рациональная
[править | править код]Выбирается один из атомов углеродной цепи, он считается замещённым метаном, и относительно него строится название «алкил1алкил2алкил3алкил4метан», например:
- а: н-бутил-втор-бутилизобутилметан
- б: триизопропилметан
- в: триэтилпропилметан
Систематическая ИЮПАК
[править | править код]По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь, при этом нумерация этой цепи начинается со стороны ближайшего к концу цепи заместителя. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.[2]
Например:

При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра является наименьшей. Таким образом, правильное название — 2,2,6-триметил-5-этилгептан.
Гомологический ряд и изомерия
[править | править код]Алканы образуют гомологический ряд.
| Гомологический ряд алканов (первые 10 членов) | ||
|---|---|---|
| Метан | CH4 | CH4 |
| Этан | CH3—CH3 | C2H6 |
| Пропан | CH3—CH2—CH3 | C3H8 |
| Бутан | CH3—CH2—CH2—CH3 | C4H10 |
| Пентан | CH3—CH2—CH2—CH2—CH3 | C5H12 |
| Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | C6H14 |
| Гептан | CH3—CH2—CH2—CH2—CH2—CH2—CH3 | C7H16 |
| Октан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C8H18 |
| Нонан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C9H20 |
| Декан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C10H22 |
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета, а начиная с C7H16 — также оптической изомерией[3]. Число структурных изомеров алканов CnH2n+2 в зависимости от числа атомов углерода n без учёта стереоизомерии[4][5] и с учётом стереоизомерии[6]:
| n | Число изомеров | С учётом стереоизомерии |
|---|---|---|
| 4 | 2 | 2 |
| 5 | 3 | 3 |
| 6 | 5 | 5 |
| 7 | 9 | 11 |
| 8 | 18 | 24 |
| 9 | 35 | 55 |
| 10 | 75 | 136 |
| 11 | 159 | 345 |
| 12 | 355 | 900 |
| 13 | 802 | 2412 |
| 14 | 1858 | 6563 |
| 15 | 4347 | 18 127 |
| 20 | 366 319 | 3 396 844 |
| 25 | 36 797 588 | 749 329 719 |
| 30 | 4 111 846 763 | 182 896 187 256 |
Число структурных изомеров низших углеводородов до C14H30 было установлено прямым подсчётом; в 1931 году был разработан рекурсивный метод подсчёта числа изомеров[7]. Какой-либо простой связи между числом атомов углерода n и числом изомеров обнаружено не было[7]. При число различных структурных изомеров алканов можно оценить посредством теоремы Редфилда — Пойи[8].
Физические свойства
[править | править код][источник не указан 1555 дней]
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При стандартных условиях, установленных ИЮПАК (давление 105 Па, температура 0 °C), неразветвлённые алканы с CH4 до C4H10 являются газами, с C5H12 до C15H32 — жидкостями, а начиная с C16H34 и далее — твёрдыми веществами.
- Температуры плавления и кипения понижаются от менее разветвлённых к более разветвлённым. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
- Газообразные и твердые алканы не пахнут, некоторые жидкие алканы обладают характерным «бензиновым» запахом.
- Все алканы бесцветны, легче воды и нерастворимы в ней. Алканы хорошо растворяются в органических растворителях, жидкие алканы (пентан, гексан) используются как растворители.
| n | Название | Тпл, °C | Ткип, °C | Плотность, г/см3 | Показатель преломления |
|---|---|---|---|---|---|
| 1 | Метан | −182,48 | −161,5 | 0,416 при Tкип | |
| 2 | Этан | −183,3 | −88,63 | 0,546 при Tкип | |
| 3 | Пропан | −187,7 | −42,1 | 0,585 при Tкип | |
| 4 | Бутан | −138,35 | −0,5 | 0,6 при Tкип | 1,3326 |
| Изобутан | −159,60 | −11,73 | 0,5510 при Tкип | ||
| 5 | Пентан | −129,7 | 36,07 | 0,6262 | 1,3575 |
| 6 | Гексан | −95,3 | 68,7 | 0,6594 | 1,3749 |
| 7 | Гептан | −90,6 | 98,4 | 0,6795 | 1,3876 |
| 8 | Октан | −55,8 | 125,7 | 0,7025 | 1,3974 |
| 9 | Нонан | −54 | 150,8 | 0,718 | 1,4054 |
| 10 | Декан | −29,7 | 174,1 | 0,730 | 1,4119 |
| 11 | Ундекан | −25,6 | 195,9 | 0,7402 | 1,4151 |
| 12 | Додекан | −9,6 | 216,3 | 0,7487 | 1.4216 |
| 13 | Тридекан | −5,4 | 235,5 | 0,7564 | 1,4256 |
| 14 | Тетрадекан | 5,9 | 253,6 | 0,7628 | 1,4289 |
| 15 | Пентадекан | 9,9 | 270,6 | 0,7685 | 1,4310 |
| 16 | Гексадекан | 18,2 | 286,8 | 0,7734 | 1,4345 |
| 17 | Гептадекан | 22,0 | 301,9 | 0,778* | 1,4369* |
| 18 | Октадекан | 28,2 | 316,1 | 0,7819* | 1,4390* |
| 19 | Нонадекан | 32,1 | 329,76 | 0,7855* | 1,4409* |
| 20 | Эйкозан | 36,8 | 342,7 | 0,7887* | 1,4426* |
| 21 | Генэйкозан | 40,5 | 355,1 | 0,7917* | 1,4441* |
| 22 | Докозан | 44,4 | 367,0 | 0,7944* | 1,4455* |
| 23 | Трикозан | 47,6 | 380,2 | 0,7969* | 1,4468* |
| 24 | Тетракозан | 50,9 | 389,2 | 0,7991* | 1,4480* |
| 25 | Пентакозан | 53,7 | 401,0 | 0,8012* | 1,4491* |
| 26 | Гексакозан | 57 | 262 (15 мм рт. ст.) | 0,778 | |
| 27 | Гептакозан | 60 | 270 (15 мм рт. ст.) | 0,780 | |
| 28 | Октакозан | 61,1 | 280 (15 мм рт. ст.) | 0,807 | |
| 29 | Нонакозан | 64 | 286 (15 мм рт. ст.) | 0,808 | |
| 30 | Триаконтан | 65,8 | 446,4 | 0,897* | 1,4536* |
| 31 | Гентриаконтан | 67,9 | 455 | 0,8111* | 1,4543* |
| 32 | Дотриаконтан | 69,7 | 463 | 0,8124* | 1,4550* |
| 33 | Тритриаконтан | 71 | 474 | 0,811 | |
| 34 | Тетратриаконтан | 73,1 | 478 | 0,8148* | 1,4563* |
| 35 | Пентатриаконтан | 74,7 | 486 | 0,8159* | 1,4568* |
| 36 | Гексатриаконтан | 75 | 265 при 130 Па | 0,814 | |
| 37 | Гептатриаконтан | 77,4 | 504,14 | 0,815 | |
| 38 | Октатриаконтан | 79 | 510,93 | 0,816 | |
| 39 | Нонатриаконтан | 78 | 517,51 | 0,817 | |
| 40 | Тетраконтан | 81,4 | 523,88 | 0,817 | |
| 41 | Гентетраконтан | 80,7 | 530,75 | 0,818 | |
| 42 | Дотетраконтан | 82,9 | 536,07 | 0,819 | |
| 43 | Тритетраконтан | 85,3 | 541,91 | 0,820 | |
| 44 | Тетратетраконтан | 86,4 | 547,57 | 0,820 | |
| 45 | Пентатетраконтан | 553,1 | 0,821 | ||
| 46 | Гексатетраконтан | 558,42 | 0,822 | ||
| 47 | Гептатетраконтан | 563,6 | 0,822 | ||
| 48 | Октатетраконтан | 568,68 | 0,823 | ||
| 49 | Нонатетраконтан | 573,6 | 0,823 | ||
| 50 | Пентаконтан | 93 | 421 | 0,824 | |
| 51 | Генпентаконтан | 583 | 0,824 | ||
| 52 | Допентаконтан | 94 | 587,6 | 0,825 | |
| 53 | Трипентаконтан | 592 | 0,825 | ||
| 54 | Тетрапентаконтан | 95 | 596,38 | 0,826 | |
| … | … | … | … | … | … |
| 60 | Гексаконтан | 98,9 | |||
| … | … | … | … | … | … |
| 70 | Гептаконтан | 105,3 | |||
| … | … | … | … | … | … |
| 100 | Гектан | 115,2 | |||
| … | … | … | … | … | … |
| 150 | Пентаконтагектан | 123 | |||
| … | … | … | … | … | … |
| 390 | Нонаконтатриктан | 132 |
Примечание к таблице: * отмечены значения, полученные для переохлаждённой жидкости.
Спектральные свойства
[править | править код]ИК-спектроскопия
[править | править код]В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С—Н в области 2850—3000 см−1. Частоты валентных колебаний связи С—С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С—Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см−1, однако метильная группа даёт в спектрах слабую полосу при 1380 см−1.
УФ-спектроскопия
[править | править код]Чистые алканы не поглощают излучение в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для измерения УФ-спектров других соединений.
Химические свойства
[править | править код]Алканы имеют низкую химическую активность. Это объясняется тем, что одинарные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку связи С—C неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Реакции радикального замещения
[править | править код]Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного, и в 2 раза меньше, чем вторичного. Таким образом, хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно с последовательным образованием хлорметана, дихлорметана, хлороформа и тетрахлорметана: за один этап замещается не более одного атома водорода:
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, отрывая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Цепной механизм галогенирования:
1) Инициирование
2) Рост цепи
3) Обрыв цепи
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем.
При одновременном действии на алканы оксидом серы (IV) и кислородом, при ультрафиолетовом облучении или при участии веществ, являющихся донорами свободных радикалов (диазометан, органические перекиси), протекает реакция сульфирования с образованием алкилсульфокислот:
Сульфохлорирование (реакция Рида)
[править | править код] При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Развитие цепного процесса:
Легче всего сульфохлорируются углеводороды линейного строения, в отличие от реакций хлорирования и нитрования.[9]
Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
Имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления
[править | править код]Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
- Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
- Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
Реакция окисления алканов диметилдиоксираном:
Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
Термические превращения алканов
[править | править код]- Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
Во время крекинга одна из связей (С-С) разрывается, образуя два радикала. Далее одновременно происходят три процесса, вследствие которых реакция дает множество различных продуктов:
1) Рекомбинация:
2) Диспропорционирование:
3) β-распад (разрыв связи (C-H)):
- Дегидрирование
1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3, например, образование этилена из этана:
2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов, например, бутадиена-1,3 и бутадиена-1,2 из бутана:
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
Конверсия метана
[править | править код]В присутствии никелевого катализатора протекает реакция:
Продукт этой реакции (смесь CO и H2) называется «синтез-газом».
Реакции электрофильного замещения
[править | править код]Изомеризация:
Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.
С марганцевокислым калием (KMnO4) и бромной водой (раствор Br2 в воде) алканы не взаимодействуют.
Нахождение в природе
[править | править код]Нахождение в космосе
[править | править код]В небольших количествах алканы содержатся в атмосфере внешних газовых планет Солнечной системы: на Юпитере — 0,1 % метана, 0,0002 % этана, на Сатурне метана 0,2 %, а этана — 0,0005 %, метана и этана на Уране — соответственно 1,99 % и 0,00025 %, на Нептуне же — 1,5 % и 1,5⋅10−10, соответственно[10]. На спутнике Сатурна Титане метан (1,6 %) содержится в жидком виде, причём, подобно воде, находящейся на Земле в круговороте, на Титане существуют (полярные) озёра метана (в смеси с этаном) и метановые дожди. К тому же, как предполагается, метан поступает в атмосферу Титана в результате деятельности вулкана[11]. Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах (углистых хондритах). Предполагается также, что метановые и этановые кометные льды образовались в межзвёздном пространстве[12].
Нахождение на Земле
[править | править код]
В земной атмосфере метан присутствует в очень небольших количествах (около 0,0001 %), он производится некоторыми археями (архебактериями), в частности, находящимися в кишечном тракте крупного рогатого скота. Промышленное значение имеют месторождения низших алканов в форме природного газа, нефти и, вероятно, в будущем — газовых гидратов (найдены в областях вечной мерзлоты и под океанами). Также метан содержится в биогазе.
Высшие алканы содержатся в кутикуле растений, предохраняя их от высыхания, паразитных грибков и мелких растительноядных организмов. Это обыкновенно цепи с нечётным числом атомов углерода, образующиеся при декарбоксилировании жирных кислот с чётным количеством углеродных атомов. У животных алканы встречаются в качестве феромонов у насекомых, в частности у мухи цеце (2-метилгептадекан C18H38, 17,21-диметилгептатриаконтан C39H80, 15,19-диметилгептатриаконтан C39H80 и 15,19,23-триметилгептатриаконтан C40H82). Некоторые орхидеи при помощи алканов-феромонов привлекают опылителей.
Получение
[править | править код]Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно.
Восстановление галогенпроизводных алканов:
При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы[13]:
Восстановление иодалканов происходит при нагревании последних с иодоводородной кислотой:
Для восстановления галогеналканов пригодны также амальгама натрия, гидриды металлов, натрий в спирте, цинк в соляной кислоте или цинк в спирте[13]
Восстановление спиртов:
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода[14].
Восстановление карбонильных соединений
Реакцию проводят в избытке гидразина в высококипящем растворителе в присутствии KOH[15].
Реакция Клемменсена[16]:
Гидрирование непредельных углеводородов
- Из алкенов
- Из алкинов
Катализатором реакции являются соединения никеля, платины или палладия[17].
При электролизе солей карбоновых кислот, анион кислоты — RCOO− перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путём сдваивания с подобным радикалом, и образуется R—R[18]. Например:
Газификация твёрдого топлива (Процессы Бертло, Шрёдера, Бергиуса)
Проходит при повышенной температуре и давлении. Катализатор — Ni (для Бертло), Mo (для Шрёдера) или без катализатора (для Бергиуса):
Реакция идёт в ТГФ при температуре −80 °C[19]. При взаимодействии R и R` возможно образование смеси продуктов (R—R, R`—R`, R—R`)
Реакция Дюма
[править | править код]Получением алканов с помощью декарбоксилирования солей карбоновых кислот, при сплавлении со щелочью (обычно NaOH или KOH):
Биологическое действие
[править | править код]Низшие алканы обладают наркотическим действием, вызывают асфиксию, раздражают органы дыхания. При хроническом действии алканы нарушают работу нервной системы, что проявляется в виде бессонницы, брадикардии, повышенной утомляемости и функциональных неврозов. Вследствие раздражающего действия газов при подострых, острых и хронических отравлениях развивается пневмония и отёк лёгких.
Примечания
[править | править код]- ↑ Bidd, Ilesh and Whiting, Mark C. The synthesis of pure n-paraffins with chain-lengths between one and four hundred. J. Chem. Soc., Chem. Commun., Issue 19, 1985, p. 543—544
- ↑ Дерябина Г. И., Кантария Г. В. 2.4.2. Правила построения названий алканов по систематической международной номенклатуре ИЮПАК. Интерактивный мультимедиа-учебник «Органическая химия». Кафедра органической, биоорганической и медицинской химии СамГУ. Дата обращения: 10 октября 2012. Архивировано из оригинала 14 октября 2012 года.
- ↑ Химическая энциклопедия, т. 3, 1992, с. 177.
- ↑ Физер Л., Физер М. Органическая химия, т. 1, 1966, с. 125.
- ↑ Последовательность A000602 в OEIS = Number of n-node unrooted quartic trees; number of n-carbon alkanes C(n)H(2n+2) ignoring stereoisomers
- ↑ Последовательность A000628 в OEIS = Number of n-node unrooted steric quartic trees; number of n-carbon alkanes C(n)H(2n+2) taking stereoisomers into account
- ↑ 1 2 Henze Henry R., Blair Charles M. The number of isomeric hydrocarbons of the methane series (англ.) // Journal of the American Chemical Society. — ACS Publishers, 1931. — Vol. 53, no. 8. — P. 3077–3085. — doi:10.1021/ja01359a034. Архивировано 29 марта 2019 года.
- ↑ G. Pólya. Kombinatorische Anzahlbestimmungen für Gruppen, Graphen und chemische Verbindungen // Acta Mathematica. — 1937. — Vol. 68. — P. 145–254. — doi:10.1007/BF02546665.
- ↑ Перекалин В. В., Зонис С. А. Органическая химия
- ↑ (англ.)Dr. David R. Williams. Jupiter Fact Sheet (англ.). NASA (2007). Дата обращения: 6 октября 2010. Архивировано из оригинала 5 октября 2011 года.
- ↑ (англ.)Emily Lakdawalla. Titan: Arizona in an Icebox? Дата обращения: 21 января 2004. Архивировано из оригинала 6 апреля 2008 года.
- ↑ (англ.)Mumma, M.J.; Disanti, M.A., dello Russo, N., Fomenkova, M., Magee-Sauer, K., Kaminski, C.D., and D.X. Xie. Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin (англ.) // Science : journal. — 1996. — Vol. 272, no. 5266. — P. 1310. — doi:10.1126/science.272.5266.1310. — PMID 8650540.
- ↑ 1 2 Химический каталог >> Органическая химия стр 63. Дата обращения: 10 июня 2009. Архивировано 2 декабря 2011 года.
- ↑ СПИРТЫ — статья из энциклопедии «Кругосвет»
- ↑ Кижнера — Вольфа реакция // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ Источник. Дата обращения: 10 июня 2009. Архивировано 20 октября 2008 года.
- ↑ Катализаторы гидрирования. Дата обращения: 10 июня 2009. Архивировано из оригинала 22 апреля 2009 года.
- ↑ Кольбе реакция // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ ВЮРЦА РЕАКЦИЯ. Дата обращения: 10 июня 2009. Архивировано из оригинала 3 мая 2011 года.
- ↑ карбид, гидролиз его - Справочник химика 21. chem21.info. Дата обращения: 12 апреля 2018. Архивировано 5 декабря 2018 года.
Литература
[править | править код]- Активация и каталитические реакции алканов / Пер. с англ.; под ред. К. Хилла. — М.: Мир, 1992.
- Общая токсикология / Под ред. Лойта А. О.. — СПб.: ЭЛБИ-СПб., 2006.
- Петров Ал. А. Химия алканов. — М.: Наука, 1974. — 243 с.
- Пойа Д. Комбинаторные вычисления для групп, графов и химических соединений // Перечислительные задачи комбинаторного анализа. — М.: Мир, 1979. — С. 36—138.
- Пэрэушану В. Производство и использование углеводородов. — М.: Химия, 1987.
- Рудаков Е. С. Реакции алканов с окислителями, металлокомплексами и радикалами в растворах. — Киев: Наукова думка, 1985.
- Физер Л., Физер М. Органическая химия. Углубленный курс. — М., 1966. — Т. 1. — 680 с.
- Хейнс А. Методы окисления органических соединений. Алканы, алкены, алкины и арены. — М.: Мир, 1988.
- Химическая энциклопедия / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди сульфиды — Полимерные красители. — 640 с. — ISBN 5-85270-039-8.
- Перекалин В.В., Зонис С. А. Органическая химия. — 4-е изд., переработанное. — М.: Просвещение, 1982. — 560 с.
- Неотложная помощь при острых отравлениях. Справочник по токсикологии / Под ред. академика АМН СССР С. Н. Голикова. — М.: Медицина, 1977.






![{\displaystyle {\ce {\mathsf {Cl{\text{:}}Cl->[{h\nu }]Cl{\text{·}}+{\text{·}}Cl}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/541855de60e8ee945e8eeb2b311c20d1a4a56830)

















![{\displaystyle {\mathsf {CH_{4}{\xrightarrow[{}]{^{o}t>1000^{o}C}}C+2H_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f10d34c7bcb0601c0c53767fc4a8cde04bbd900)

![{\displaystyle {\mathsf {2CH_{4}{\xrightarrow[{}]{^{o}t>1500^{o}C}}C_{2}H_{2}+3H_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b09aec162fc81c5ca99e8746c44442cac12cd87)














![{\displaystyle {\mathsf {CH_{3}CH_{2}CH_{2}CH_{2}OH{\xrightarrow[{}]{LiAlH_{4}}}CH_{3}CH_{2}CH_{2}CH_{3}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/710e85520863ccedbc9aec5cba5aef8754924ca6)